98株河南省结核分枝杆菌氧氟沙星耐药株gyrA基因突变的研究*
2012-01-24赵玉玲马晓光
赵玉玲,马晓光,李 辉
随着耐药结核病的不断增加,作为二线药物的的第三代喹诺酮类在结核病治疗中广为使用,氧氟沙星耐药菌的检出也呈上升趋势。早期检测并发现喹诺酮类药物作用靶点为DNA回旋酶,编码该酶A亚单位的基因gyrA发生突变与氟喹诺酮类耐药关系密切[1]。这些耐药菌耐药程度、耐药基因的突变情况及其与耐药程度间的相互关系等需要进一步的研究。为了解结核分枝杆菌(Mycobacterium tuberculosis,MTB)耐氧氟沙星相关gyrA基因的突变情况及其耐药机制,通过PCR和DNA测序技术测定98株gyrA基因喹诺酮耐药决定区(Quinoloneresistance determining regions,QRDR)测序,发现了目前河南省结核分枝杆菌gyrA基因突变的新特点。
1 材料与方法
1.1 材料
1.1.1 菌株来源 结核分枝杆菌 H37Rv(菌株号:ATCC27294)和H37Ra(菌株号:ATCC35835)由中国基本预防控制中心结核病预防控制中心参比实验室提供。126株结核分枝杆菌临床分离株均分离自河南省结核病控制机构,为2007-2010年结核病患者(男78例,女48例,年龄19~81岁)的标本培养物,并经噻吩-2-羧酸肼(TCH)对硝荃苯甲酸(PNB)菌种鉴定为结核分枝杆菌。
1.2 方法
1.2.1 药物敏感性试验 应用比例法药物敏感性试验,参照[2]。链霉素(SM)、异烟肼(INH)、利福平(RFP)、乙胺丁醇(EMB)、卷曲霉素(CPM)、阿米卡星(AMK)、卡那霉素(KM)和氧氟沙星(OFLX)所采用的浓度分别为:4、0.2、40、2、40、30、30、3μg/mL。氧氟沙星 MIC测定用罗氏培养基,所用 浓 度 为 0.125,0.25,1,2,4,8,10,16,20,32μg/mL。
1.2.2 PCR扩增 采用煮沸离心取上清法提取结核菌基因组DNA,-20℃冻存备用。gyrA QRDR部位227bp进行 PCR 扩 增,所 用 引 物 为:gyrA1:5′-GACCGCAGCCACGCCAAG-3′, gyrA2: 5′-AGCATCACCATCGCCAACG-3′,PCR所用扩增酶为 Ampli Taq Gold,由生工生物公司合成。PCR扩增条件:预变性94℃4min,然后(94℃1min,60℃1min,72℃1min)共40个循环后,72℃延伸7min。
1.2.3 DNA测序 测序所用引物与PCR扩增所用引物相同。由生工生物公司完成测序,所用测序仪为ABI PRISM 310基因分析仪(Perkin Elmer Applied Biosystems)
2 结 果
GyrA基因QRDR突变情况 DNA测序结果表明,126株临床分离株gyrA基因95位密码子均与H37Rv AGC不同,呈现出来ACC的自然多态性。氧氟沙星耐药的98株中,有19株没有突变检出,其余81株(82.6%)检测到gyrA基因。其中68株(84%,68/81)带有94位密码子的突变,共发现4种类型,GAC→GGC,GCC,TAC,AAC,见表1。导致94Asp→Gly,Ala,Tyr,Asn,其中36株(44.4%,36/81)携 有 Asp94Gly 突 变,其 余Asp94Asn,Asp94Tyr和Asp94Ala的发生率各自为31.0%(25/81),4.9%(4/81)和3.7%(3/81)。除了94位密码子检出突变以外,74位,90位和91位也发现有突变发生,如表1所示,58株(71.6%)氧氟沙星耐药株携有Ala90Val突变,16株(19.8%)带有 Ser91Pro突变,12株(14.8%)带有Ala74Ser突变。总之,氧氟沙星耐药株中gyrA QRDR部位突变发生于74,94,90和91位密码子,而在88,89,92和93位没有突变检出。81株gyrA基因突变株中,有30株为单个位点突变,51株为双位点突变,占63%(51/81)。在28株氧氟沙星敏感株(MIC小于2μg/mL)中,有3株(其 MIC为1 μg/mL)也有单个位点突变检出,分别为Ala90Val,Asp94Gly和Ser91Pro。
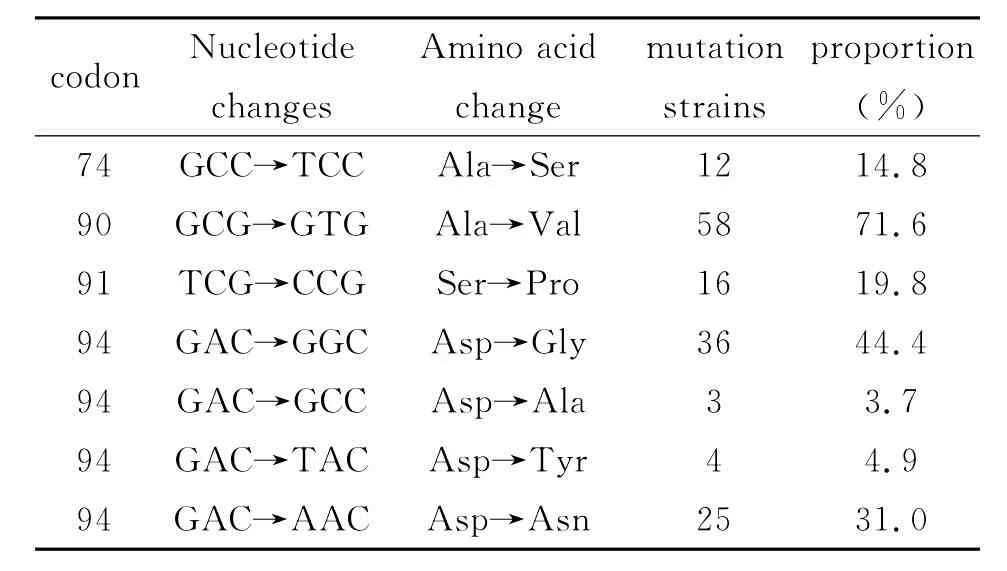
表1 81株氧氟沙星耐药菌株gyrA基因突变特征Tab.1 Mutation character in gryA of 81strains with ofloxacin-resistant
51株(63%)被检出带有双位点突变。双位点突变之中,Asp94Gly的发生率较高。有7株(14%)的双位点突变株携有Ala74Ser突变。没有三位点或多位点突变发生。携有双位点突变的菌株中,氧氟沙星MIC值相对较高。在MIC 8~16μg/mL的菌株中,有63%(32/51)携有双位点突变,MIC 2~4 μg/mL的菌株中,37.3%(19/51)携有双位点突变。MIC小于2μg/mL的敏感株中,未见双位点突变发生。
3 讨 论
Takiff[3]、George[4]、Kocagoz[5]、Onodera[6]、Ruiru S[7]及 Pitaksajjakul P[8]、Kim H[9]等曾先后研究gyrA基因第90位、94位密码子的突变是导致结核分枝杆菌对喹诺酮类药物耐药的主要因素。本文通过传统药敏试验筛选98株耐氧氟沙星结核分枝杆菌临床分离株,发现氧氟沙星耐药株gyrA突变总突变率为84%(81/96),且突变主要集中在94,90和91位密码子而且94位有4种类型的突变(Asp→Gly,Ala,Tyr和Asn),这与以往的报道相一致[3,10-11]。 既往 曾 有 报 道 88 位 密 码 子 的 突 变[11]在我们的研究中未发现。本研究发现两个新的突变特点:一是63%的耐氧氟沙星株(51/81)携有双位点突变;二是在所有的双位点突变株中,14%(7/51)双位点突变株中携有Ala74Ser突变,该种突变类型在既往结核分枝杆菌耐药相关基因研究中鲜见报道,通常认为它仅存在于其它类型的细菌中,在结核分枝杆菌中发生突变非常罕见[3,10-11]。这可能与菌株的来源不同、不同国家或地区对喹诺酮类药物的选择使用原则有所差异以及所入选的样本量大小等因素有关。另外,除了gyrA基因突变外,是否存在其他的耐药机制如:膜通透性降低[13]、药物主动外排出现[14]及gyrB基因突变[3]等导致结核分枝杆菌对喹诺酮类药物耐药,及gyrA基因突变与耐药水平的相互关系等需进行进一步的研究。
我国氟喹诺酮类虽尚为二线抗结核药,但由于广大地区在临床治疗其他疾病时广泛应用,因此耐药形势不容低估。以往报道显示菲律宾的一项全国调查表明[15],结核分枝杆菌临床分离株对环丙沙星的耐药率为27%,氧氟沙星的耐药率为35%,两药的共同耐药率为17%;但美国和加拿大结核分枝杆菌氟喹诺酮类耐药罕见[16]。为确保耐多药结核病人有针对性的治疗,了解河南省结核分枝杆菌的耐药机制势在必行。本研究工作发现河南地区结核分枝杆菌临床分离株gyrA基因双位点突变率高,表明氟喹诺酮类耐药形势不容乐观。应特别引起注意,采取针对性措施,特别是对耐一线药的耐药结核病及耐多药结核病的治疗中,在选择二线药时应充分注意结核分枝杆菌氟喹诺酮类耐药现象,有条件的省级结核病实验室可以常规开展结核分枝杆菌氟喹诺酮类耐药检测,以便指导临床治疗。
[1]Ginsburg AS,JH Grosset,WR Bishai.Fluoroquinolones,tuberculosis,and resistance[J].Lancet Infect Dis,2003,3(7):432-442.
[2]中国防痨协会,结核病诊断细菌学检验规程[S],1995,11.
[3]Takiff HE,Salazar L,Guerrero C,et al.cloning and nucleotide sequence of the Mycobacterium tuberculosis gyrA and gyrB genes,and detection of quinolone resistance mutations[J].Antimicro Agents Chemother,1994,38(4):773-780.
[4]Alangaden GJ,Manavathu EK,Vakulenko,SB,et al.Characterization of fluoroquinolone resistant mutant strains of Mycobacterium tuberculosis selected in the laboratory and isolated from patients[J].Antimicrobial Agents Chemother,1995,39(8):1700-1703.
[5]Kocagoz T,Hackbarth C,Unsal Z,et al.Gyrase mutation in laboratory-selected,fluoroquinolone-resistant,mutants of Mycobac-terium tuberculosis H37Ra[J].Antimicro Agents Chemother,1996,40(8):1768-1774.
[6]Onodera Y,Tanaka M,Sato K.Inhibitory activity of quinolones against DNA gyrase of Mycobacterium tuberculosis[J].Journal of Antimicrobial Chemotherapy,2001,47,(4):447-450.
[7]Shi R,Otomo K,Yamada H,et al.Temperature-mediated heteroduplex analysis for the detection of drug-resistant gene mutations in clinical isolates of Mycobacterium tuberculosis by denaturing HPLC,SURVEYOR nuclease[J].Microbes and Infection,2006,8(1):128-135.
[8]Pitaksajjakul P,Worakhunpiset S,Chaiprasert A,et al.gyrA and gyrB mutations in ofloxacin-resistant Mycobacterium tuberculosis clinical isolates in Thailand[J].Southeast Asian J Trop Med Public Health,2011 ,42(5):1163-1167.
[9]Kim H,Nakajima C,Kim YU,et al.Influence of lineage-specific amino acid dimorphisms in GyrA on Mycobacterium tuberculosis resistance to fluoroquinolones[J].Jpn J Infect Dis,2012,65(1):72-74.
[10]Cheng AF,Yew WW,Chan EW,et al..2004.Multiplex PCR amplimer conformation analysis for rapid detection of gyrA mutations in fluoroquinolone-resistant Mycobacterium tuberculosis clinical isolates[J].Antimicrob.Agents Chemother,2004,48(2):596-601.
[11]Xu C,Kreiswirth BN,Sreeratsan S,et al.Fluoroquinolone resistance associated with specific gyrase mutations in clinical isolates of multidrug-resistant Mycobacterium tuberculosis[J].Infect Dis,1996,174(5):1127-1130.
[12]Ginsburg AS,Sun R,Calamita H,et al.Grosset.Emergence of Fluoroquinolone resistance in Mycobacterium tuberculosis during continuously dosed moxifloxacin monotherapy in a mouse model[J].Antimicrob Agents Chemother,2005,49(9):3977-3979.
[13]Wang JY,Lee LN,Lai HC,et al.Fluoroquinolone resistance in Mycobacterium tuberculosis isolates:associated genetic mutations and relationship to antimicrobial exposure[J].J Antimicrob Chemother,2007,59:860-865.
[14]Takiff H E,Cimino M,Musso MC,et al.Efflux pump of the proton antiporter family confers low-level fluoroquinolone resistance in Mycobacterium smegmetis[J].Proc Natl Acad Sci USA,1996,93(1):362-366.
[15]Grimaldo ER,Tupasi TE,Rivera AB.Increased resistance to ciprofloxacin and ofloxacin in multidrug-resistant Mycobacterium tuberculosis isolates from patients seen at a tertiary hospital in the Philippines[J].Int J Tuberc Lung Dis,2001,5(6):546-550.
[16]Bozeman L,Burman W,Metchock B,et al.Fluoroquinolone susceptibility among Mycobacterium tuberculosis isolates from the United States and Canada[J].Clin Infect Dis,2005,40(3):386-391.
