氧化应激下伤寒沙门菌诱导的巨噬细胞凋亡*
2012-01-24刘婷婷马丽娜李凤云
刘婷婷,马丽娜,李凤云,刘 勇
伤寒沙门菌(Salmonella typhi)是重要的肠道致病菌,属胞内寄生菌,可引起伤寒等严重疾病。巨噬细胞是人体主要的吞噬细胞,在许多病原体的清除和破坏中起重要作用。伤寒沙门菌在巨噬细胞内生存、增殖的能力与其致病密切相关。伤寒沙门菌侵袭性蛋白Sip-B可以诱导caspase1介导的巨噬细胞凋亡[1],但这些细菌毒力因子的表达在宿主体内、外是不同的[2],人体内环境因素对伤寒沙门菌诱导细胞凋亡的影响还有待于进一步研究,其中就包括伤寒沙门菌被巨噬细胞吞噬后所遭遇的细胞内氧化应激环境。本实验拟用H2O2刺激伤寒沙门菌以模拟体内氧化条件,采用人单核细胞株经PMA分化的巨噬细胞为模型,探讨伤寒沙门菌在氧化应激状态下诱导的巨噬细胞凋亡,以深入了解伤寒沙门菌的致病机制。
1 材料与方法
1.1 材料
1.1.1 菌种 伤寒沙门菌标准菌株ATCC 19430,购自北京中国药品生物制品鉴定所;氧化应激伤寒沙门菌,参照文献[3]方法制备。
1.1.2 主要试剂 Annexin VFITC凋亡检测试剂盒(深圳晶美生物工程公司),人TNFα定量酶联检测试剂盒(上海森雄生物技术有限公司),SOD检测试剂盒(南京建成生物工程研究所)。
1.1.3 主要仪器 流式细胞仪FACS Calibur(美国BD公司)。
1.2 方法
1.2.1 细胞培养 用含小牛血清的RPMI-1640培养液培养人单核细胞株,加入20ng/mL使其分化,37℃,5%CO2条件下培养48h,镜下观察90%以上细胞出现棘状突起时判定细胞已分化成巨噬细胞。收获指数生长期巨噬细胞,以5×105接种于无菌6孔板中,常规培养5h后更换不含小牛血清的营养液进行试验。
1.2.2 细菌培养 细菌分别在LB液体培养基和加有15mmol/L H2O2的LB培养基中培养,16h后使用酶标仪测A600值;计算菌液浓度,用不含小牛血清的RPMI-1640调整菌液浓度。
1.2.3 细胞感染 弃去细胞培养孔中陈旧培养液,加入1.0mL不含小牛血清营养液,按细菌与细胞数之比为20∶1加入细菌。实验分为A组(伤寒沙门菌诱导组)、B组(氧化应激组)和C组(空白对照组)。
1.2.4 细胞凋亡检测 分别于感染细菌后2、4、8、12h收集细胞,Annexin V-FITC染色,1h内流式细胞仪检测细胞凋亡,Cellquest软件获取数据。
1.2.5 TNF-α、SOD检测 细菌感染8h后收集细胞培养上清,采用定量酶联法检测TNF-α,按照说明书操作,用酶标仪测A492值,根据标准曲线得到TNF-α含量。SOD的检测采用黄嘌呤氧化酶法检测细菌感染8h细胞培养液上清,用可见光分光光度计在550nm处检测,通过公式可求出样本SOD活力。1.2.6 数据处理 所得数据用Excel和SPSS10.0进行计算和分析。采用one-way ANOVA后t检验。
2 结 果
2.1 氧化应激状态下伤寒沙门菌及自然状态伤寒沙门菌诱导巨噬细胞凋亡的流式分析 各时间段氧化应激状态下伤寒沙门菌及自然状态伤寒沙门菌均可诱导巨噬细胞凋亡,与对照组相比细胞凋亡率差异有统计学意义(P<0.01),随时间延长,各组细胞凋亡率亦相应增加(P<0.01);各时间段氧化应激状态下伤寒沙门菌诱导巨噬细胞凋亡率与自然状态伤寒沙门菌组比较差异均有统计学意义(P<0.01)。

图1 巨噬细胞凋亡的流式图A:对照组;B:自然状态伤寒沙门菌组;C:氧化应激状态伤寒沙门菌组)Fig.1 Time-dependent effect of macrophage apoptosis inducedA:control;B:s.typhi;C:H2O2stressed s.typhi with flow cytometry
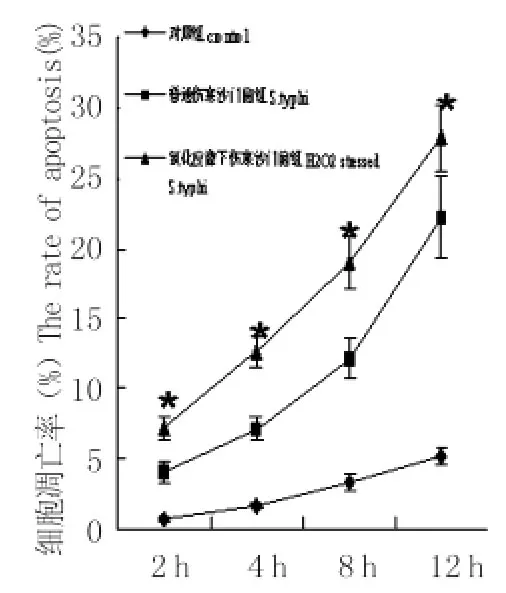
图2 氧化应激状态下伤寒沙门菌及自然状态下伤寒沙门菌诱导巨噬细胞不同时间的细胞凋亡率 (ni=6,±s)*:与自然状态伤寒沙门菌组及对照组比较Fig.2 Apoptosis rates of macrophage induced by S.typhi grown under normal and H2O2stressed conditionCompared to control and normal S.typhi infected macrophages,P<0.01
2.2 细菌诱导8h后TNF-α及SOD的产生量氧化应激状态伤寒沙门菌及自然状态伤寒沙门菌组诱导巨噬细胞8h后,TNF-α的产生量均比加入诱导因素前明显增高,且氧化应激菌TNF-α高于自然状态伤寒沙门菌组;SOD的产生量均比加入诱导因素前明显减少,且氧化应激菌SOD的产生量均低于自然状态伤寒沙门菌组,见图4-6。

图3 自然状态伤寒沙门菌及氧化应激状态伤寒沙门菌诱导巨噬细胞TNF-α产生量 (ni=6,±s)*:与对照组及自然状态伤寒沙门菌作用巨噬细胞组比较Fig.3 Production of TNF-αafter 8hin the culture supernantants of macrophages interacted with S.typhi under normal and H2O2stressed conditionsCompared to control and normal S.typhi infected macrophages,P<0.01
3 讨 论
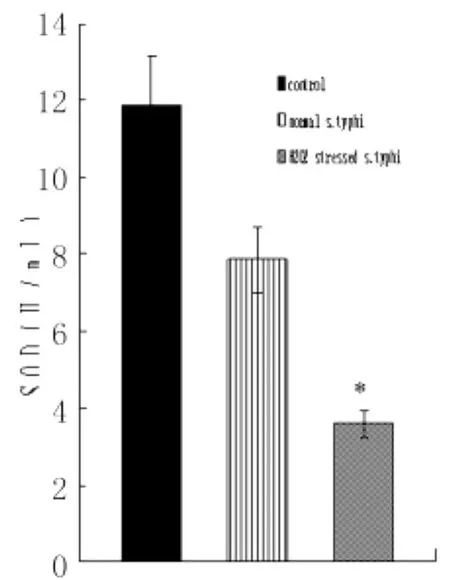
图4 自然状态伤寒沙门菌及氧化应激状态伤寒沙门菌诱导巨噬细胞SOD产生量 (ni=6,±s)*:与对照组及自然状态伤寒沙门菌作用巨噬细胞组比较Fig.4 Production of TNF-αafter 8hin the culture supernantants of macrophages interacted with S.typhi under normal and H2O2stressed conditionsCompared to control and normal S.typhi infected macrophages),P<0.01
氧化应激即机体活性氧(reactive oxygen specises,ROS)产生过多或/和抗氧化能力下降,ROS清除不足,导致ROS在体内过多堆积而造成细胞损伤。感染过程中,在细胞因子的影响下,伤寒沙门菌遭遇了巨噬细胞内的氧化环境,巨噬细胞利用其产生的氧衍生物分子以抑制或杀死伤寒沙门菌,但仍有部分伤寒沙门菌在巨噬细胞内生存并导致感染。为了应对环境的应激,伤寒沙门菌经历了遗传以及物理性状的改变。这些应激反应可能会显著的增强伤寒沙门菌在巨噬细胞内的生存能力及毒性[4]。本实验着重探讨了伤寒沙门菌如何应对巨噬细胞内的氧化环境以及巨噬细胞凋亡与ROS之间的关系。
氧化应激状态下自然状态伤寒沙门菌,采用Annexin V-FITC染色、流式细胞仪检测细胞凋亡情况。结果两组细菌均可诱导巨噬细胞凋亡,且细胞凋亡率随时间延长而增高(P<0.01),各组氧化应激状态伤寒沙门菌引发巨噬细胞凋亡能力均高于自然状态伤寒沙门菌组,说明模拟巨噬细胞内氧化应激条件伤寒沙门菌诱导巨噬细胞凋亡能力增强。
本实验结果显示,氧化应激状态伤寒沙门菌组较自然状态伤寒沙门菌感染组诱导巨噬细胞产生的SOD明显降低。SOD是一种重要的抗氧化酶,具有清除自由基,抑制脂质过氧化的作用。SOD水平的下降可能引起过氧化自由基的产生从而引起巨噬细胞的凋亡,已经有报道这种过氧化物可引起神经细胞的凋亡[5]。早期的研究中有人发现,缺乏SOD的大肠杆菌在需氧生长中突变率增强,这表明缺乏SOD可导致DNA的损害。另外,SOD的显著减少有可能阻碍了超氧阴离子防止突变以及H2O2的解毒作用,因而可能造成凋亡的羟基离子和其他活性氧成分的形成[6]。
许多研究已证实氧化应激可引起细胞凋亡,这其中凋亡可由活性氧中间物产生,也可由抗氧化剂的使用而被阻止。TNF-α就是这样一种调剂因子。Larrick和Wright曾报导给予TNF受体刺激后可导致细胞内活性氧中间物水平的迅速上升[7]。而且在不同的细胞,TNF-α介导的细胞凋亡可由硫氧化还原剂,或 N-已酰半胱氨酸,和GSH 前体所抑制[8]。TNF-α,INF-α和IL-1也曾经被报道可引起不同类型细胞凋亡[9]。本实验研究发现氧化应激下伤寒沙门菌组较原菌感染组诱导巨噬细胞释放的TNF-α明显增多,这个结果跟Hirose早期研究发现细胞对TNF-α敏感度和抵抗力是和SOD水平的降低或升高密切相关是一致的,SOD缺陷的T细胞已被证实更易被 TNF-α杀伤[10]。
氧化应激状态下伤寒沙门菌可诱导巨噬细胞凋亡,TNF-α在伤寒沙门菌氧化应激时通过增加ROS和减少抗氧化物SOD的产生来介导巨噬细胞凋亡,本研究结果有助于我们更好的理解伤寒沙门菌的致病机理,为我们进一步的诊断与治疗提供了新的思路。
[1]Hersh D,Monack DM,Smith MR,et al.The Salmonellainvasion Sip B induces macrophage apoptosis by binding to caspase-1[J].Proc Natl Acad Sci USA,1999,96(5):396-401.
[2]Smith H.What happens to bacterial pathogens in vivo[J].Trends Microbiol,1998,6(6):239-243.
[3]Ozkanca R,Sahin N,Isik K,et al.The effect of toluidine blue on the survival,dormancy and outer member porin proteins(OmpC and OmpF)and Salmonella typhimurium LT2in seawater[J].J Appl Microbiol,2002,92(6):1097-1104.
[4]刘婷婷,马丽娜,李凤云,等.短链脂肪酸作用下伤寒沙门菌诱导巨噬细胞凋亡机制的探讨[J].中国微生态学杂志,2010,22(10):903-905.
[5]Troy CM,Shelanski ML.Down-regulation of Copper/Zinc superoxide dismutase causes apoptotic cell death in PCL2neuronal cells[J].Proc Natl Acad Sci USA,1994,91(14):6384-6387.
[6]Granger DN,Grisham MB,Hernandez LA.Reactive oxygen metabolites:mediators of cell injury in the digestive system[J].Viewpoints Dig Dis,1986,18:13-16.
[7]Larrick JW,Wright SC.Cytotoxic mechanism of tumor necrosis factor-alpha[J].FASEB J,1990,4(14):3215-3223.
[8]Matsuda M,Masutani H,Nakamura H,et al.Protective activity of adult T cell lerkenia-derived factor(ADF)against tumor necrosis factor-dependent cytoxicity on U937cells[J].Jimmunol,1991,147(11):3837-3841.
[9]Van Antwerp DJ,Martin SJ,Kafri T,et al.Suppression of TNF-a induced apoptosis by NF-Kb[J].Science.1996,274:787-789.
[10]Hirose K,Longo DL,Oppenheim JJ,et al.Overexpression of mitochondrial manganese superoxide dismutase promotes the surbival of tumor cells exposed to interleukin-1,tmor necrosis factor,selected anti cancer drugs,and ionizing radiation[J].Faseb,1993,7(2):361-368.
