2010年南京人群甲型H3N2流感分离毒株全基因组特性分析*
2012-01-24罗鹏飞秦圆方崔仑标焦永军卫平民
罗鹏飞,曹 尚,李 伟,李 亮,吴 斌,秦圆方,邓 斐,崔仑标,焦永军,祁 贤,卫平民
因为抗原漂移,甲型H3N2变异株每隔2~8年形成一次新的流行,东亚和东南亚地区位于全球季节性H3N2流感病毒传播网络的中心位置[1],该地区的流感毒株基因变异对于全球流感流行株的发展具有预警作用。
江苏省2004-2008年间的优势流行株依次为H3N2亚型、乙型 Victoria系、H3N2亚型、乙型Yamagata系[2]。自2009年4月爆发以来,猪源性甲型H1N1成为人群中优势流感流行株,在此期间甲型H3N2流感病毒的流行情况和基因特征极少被关注。为探讨猪源性甲型流感大流行后季节性H3N2病毒的基因特征,尤其是病毒表面蛋白(血凝素和神经氨酸酶)基因的变异情况,特对在南京市2010年早期监测的3株季节性H3N2流感病毒的全县同组测序,分析毒株基因片段的遗传特性,现将结果报告如下。
1 材料与方法
1.1 材料 2010年9月,从江苏省流感监测网络上报的3例南京地区H3N2流感病例的咽拭子中分离到流感病毒,并经过血凝抑制实验和流感病毒核酸监测证实,分别命名为:A/Nanjing/1654/2010(H3N2)、A/Nanjing/1655/2010(H3N2)和 A/Nanjing/1663/2010(H3N2),依次简称为 Nanjing/1654、Nanjing/1655和Nanjing/1663。
1.2 方法
1.2.1 病毒RNA提取 采用德国QIAGEN公司RNeasy Mini Kit试剂盒,按试剂盒说明书中要求,处理病毒液(接种于 MDCK细胞并经5~7d培养),提取病毒RNA。
1.2.2 病毒基因片段的PCR扩增 采用INVITROGEN公司的SuperScriptⅡReverse Transcriptase试剂盒将病毒的RNA反转录为cDNA,然后采用TAKARA公司的TAKARA LA Taq PCR试剂盒扩增病毒8个基因组片段;扩增引物及方法详见Hoffman等建立的流感病毒全基因组扩增方法[3]。对扩增产物进行凝胶电泳鉴定、回收目的条带并进行凝胶DNA纯化回收,获得目的条带的PCR纯化产物。
1.2.3 序列测定与数据分析 将包含目的片段的PCR纯化产物送至南京金斯瑞生物技术公司进行测序;采用DNAStar软件中的EditSeq和MegAlign进行核苷酸序列拼接和氨基酸残基推导、比对,采用BLASTn工具搜索NCBI中同目的片段核苷酸序列相似度最高的核苷酸序列,采用MEGA4软件构建系统发生树;其他甲型H3N2流感分离株的核苷酸、氨基酸序列下载于NCBI数据库(http://www.ncbi.nlm.nih.gov/)。
2 结 果
2.1各个基因核苷酸序列的相似序列 所测3株病毒RNA片段1→8(PB2、PB1、PA、HA、NP、NA、M和NS)的核苷酸序列已上传至NCBI数据库。同季节性H3N2病毒参考毒株比对,各片段序列长度与参考株对应片段相同,不存在核苷酸插入和缺失。24个目的片段相似度最高的2010年前流感病毒株均为人甲型 H3N2流感病毒,见表1。其中Nanjing/1654的PA 片段与另一分离毒株A/California/VRDL3390/2009(H3N2)的 相 似 度 最 高(99.6%)。
2.2 进化特征 分别构建38株H3亚型流感病毒片段4和30株N2亚型流感病毒片段6核苷酸序列的进化树(图1)。整体来看,季节性H3N2病毒与猪群病毒间的进化关系更近,而与禽或马源流感片段区分显著。两个进化树显示所测病毒的HA和NA片段都位于季节性H3N2毒株组成的分支,其中Nanjing/1655和Nanjing/1663处在相同的终末 分 支 上,与 日 本 毒 株 A/Niigata/1147/2010(H3N2)相近。
构建17株季节性H3N2病毒和4株猪源H3N2病毒的PB2、PB1、PA、NP、NS和 M 6个片段核苷酸序列的进化树(图2),因部分毒株的片段不完整而未引入进化树中。丛书结构上看PB2、PB1、PA、NP、NS和M片段呈现出类似HA基因的进化特征,相比猪群毒株,所测病毒与相近年代疫苗株进化距离较近,同 A/Niigata/1147/2010(H3N2)最近。
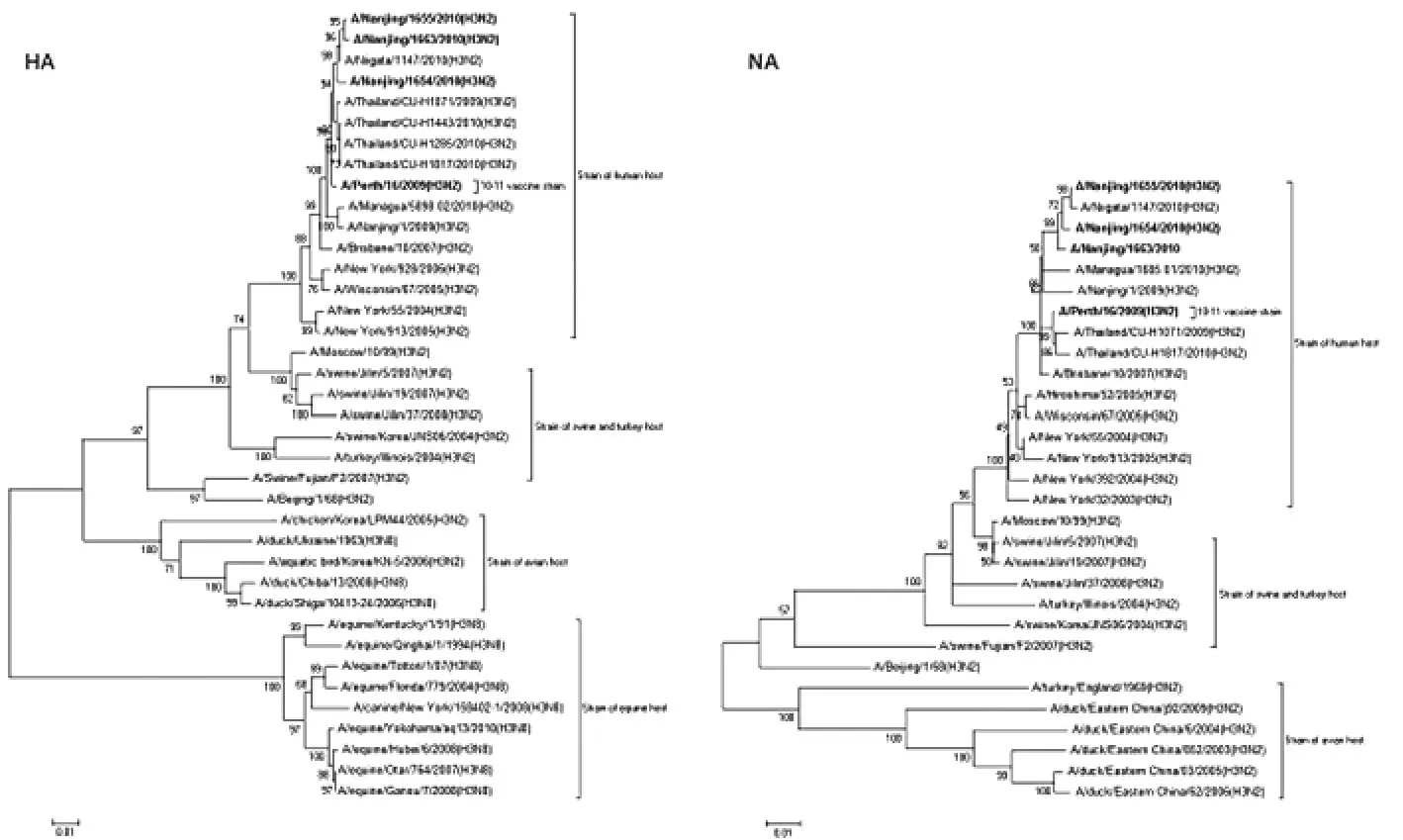
图1 基于片段4和6核苷酸序列的不同宿主来源毒株的进化树Fig.1 Phylogenetic trees based on nucleotide sequences of segment 4and 6of isolates from different kinds of host.The phylogenetic trees are generated by neighbor-joining algorithm based on 1 000replicates,H3N2isolates(Nanjing 2010)and vaccine strain(2010-2011)are marked by black bold
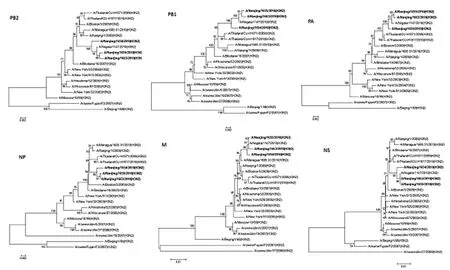
图2 基于片段1,2,3,5,7和8核苷酸序列的H3N2互型毒株的进化树Fig.2 Phylogenetic trees based on nucleotide sequences of segment(1,2,3,5,7,8)of H3N2subtype viruses
2.3 氨基酸序列的位点分析 对比A/Perth/16/2009的HA蛋白氨基酸序列,3株流感病毒共12个氨基酸位点发生变异(Table 2)。其剪切位点序列为PEKQTR↓G,含一个碱性氨基酸(R),为低致病性流感病毒特征。HA1蛋白抗原位点变异位于A、C、D和E区[4],氨基酸变异数目分别为3、7和7个,所测病毒株两两间的抗原位点变异数分别为4个(Nanjing/1654和 Nanjing/1655),4个(Nanjing/1654和 Nanjing/1663)和 2 个 (Nanjing/1655 和Nanjing/1663)。变异未发生在宿主受体结合位点(98、153、190、194、183、155、134~138和224~228位)[5]。Nanjing/1654和 A/Perth/16/2009含有10个糖基化位点(第8、22、38、63、122、126、133、165、246、285位),Nanjing/1655 和 Nanjing/1663 的第124位氨基酸为N,使的第122位的糖基化位点消失。Nanjing/1655的305R不能与281C形成二硫键,使得其二硫键数目减少一对。
对比 A/Perth/16/2009,3株病毒的 NA 蛋白共发生10个氨基酸位点变异(Table 3)。其中发生于N2亚型7个抗原决定簇[6]的变异是第342和402位,变异数目分别为1、2和1个。未见NA蛋白的酶活性中心(118R、151D、152R、224R、276E、292R、371R、406Y、119E、156R、178W、179S、198D/N、222I、227E、274H、277E、294N、425E)的耐药位点变异292(R→K)、119(E→G/A/D/V)、294(N→S)、151(D→E)、276(E→D)[7]。3株 H3N2和 A/Perth/16/2009均包含7个糖基化位点(第61、69、70、86、146、200、234和329位)。
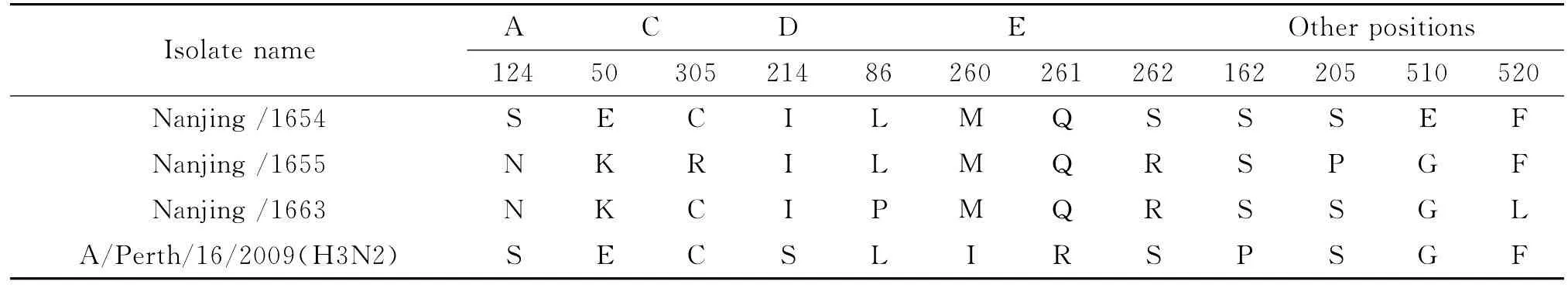
表2 HA蛋白的氨基酸变异位点Tab.2 Amino acid site variations distribution of HA protein
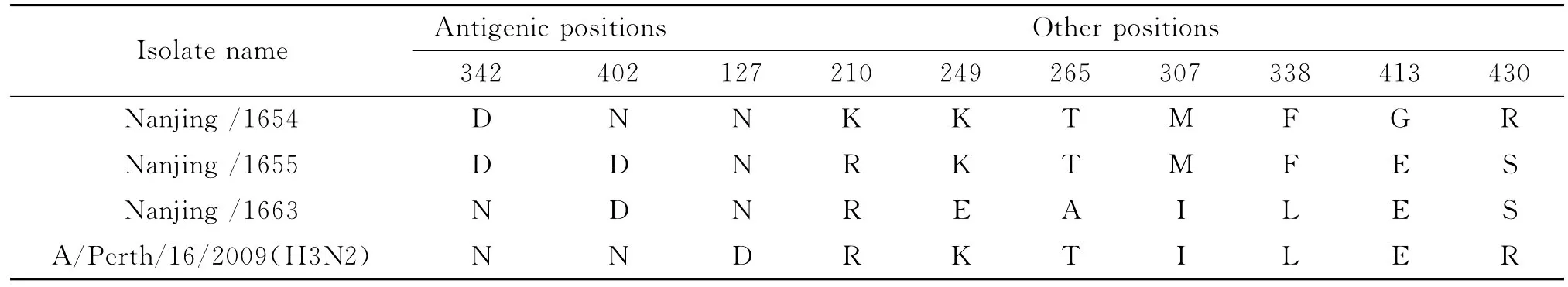
表3 HA蛋白的氨基酸变异位点Tab.3 All the amino acid site variations of NA protein
在PB2、PB1、PA 3个基因的宿主特异性保守氨基酸位点 PB2(199、475、567、627、702aa)、PB1(375aa)和 PA(55、100、382、552aa)[8]中,所测病毒PB1蛋白375位氨基酸为G,不同于A/Brisbane/10/2007、A/Nanjing/1/2009以及人群 H3N2中的S。另外,PA第510aa的突变(H→A)可能抑制病毒多聚酶复合体对RNA的核酸内切作用而降低病毒的转录活性,所测病毒PA第510aa均为组氨酸(H)。NP蛋白第16、33、100、136、283、313位氨基酸与宿主特异性有关,相比A/Brisbane/10/2007和A/Nanjing/1/2009,所测3株病毒此6个位点均未发生变异。
M1蛋白101~105位氨基酸(RKLKR)是M1蛋白的RNA结合区和核定位信号区,148~162位为一个潜在的CCHH锌指结构基序(CATCEQIADSQHRSH),所测病毒的以上位点上均未变异。M2蛋白为流感病毒的离子通道蛋白,其第37和41aa为离子通道的活性核心部位,金刚烷胺类药物与活性核心部位结合后抑制离子通道功能,所测病毒的第31位氨基酸发生耐药性突变(S→N)而引起金刚烷胺耐药。
NS1蛋白N端(核心序列19~38)为RNA结合域,C端(核心序列134~161)为效应区,两个区域相 对 保 守[8]。 相 比 A/Brisbane/10/2007,Nanjing/1654的第157(V→A)位氨基酸发生变异,Nanjing/1655和Nanjing/1663未发生变异,它们的PL基序完整,均为RSKV。
PB1-F2蛋白由PB1片段的另外一个ORF编码,完整的PB1-F2蛋白为90个氨基酸。第69~82位氨基酸被认为是线粒体靶向序列,与病毒促进宿主细 胞 凋 亡 相 关[9]。与 A/Brisbane/10/2007、A/Nanjing/1/2009以及 A/Beijing/1/1968相比,所测病毒的MTS内氨基酸未变异,但Nanjing/1655和Nanjing/1663的PB1-F2氨基酸链理论上在第26位发生了断裂,可能使得蛋白截短为25aa而失去相关的功能。
3 讨 论
江苏省CDC在2010年9月之前1年多时间里未监测到南京市H3N2亚型病毒感染的病例,所分离3株病毒的基因特征可在一定程度上解释南京地区H3N2亚型病毒的变异情况。一般认为具有代表性的甲型流感病毒新变种要存在一定的抗原性差异,并在HA1区存在4个以上的氨基酸变异,这些氨基酸的变化还必须涉及2~3个抗原决定簇[10]。参考2010-2011年H3N2疫苗株,并结合HA1基因氨基酸变异的数目和位置,我们推测,与2009年H1N1流感大流行前的H3N2流感毒株相比,新变种很可能已经形成,且毒株Nanjing/1654与另两株病毒间可能存在抗原漂移,但这还须结合病毒抗原性检测结果予以证明。另外,流感病毒血凝素蛋白糖基化的主要作用是稳定血凝素蛋白结构,防止血凝素蛋白被水解以及阻碍抗体对病毒的识别和清除,所测病毒糖基化位点的增加或减少对流感病毒的抗原性及其他生物学特性均有一定影响。大规模测序显示一定范围内的H3N2流感病毒基因特征可表现出一定的差异[11],呈现不同“亚群”混合流行,根据本研究中3株病毒HA片段的特征推测这种分化特征可能形成,这必然会增加疫苗应用的难度。另外,8个片段的进化特征表明分离株Nanjing/1655和 Nanjing/1655与日本流感毒株 A/Niigata/1147/2010在遗传进化上具有很高同源性,推测这类H3N2病毒可能已经形成了跨地区间的传播。
当前的抗流感病毒药物主要包括M2离子通道阻断剂(金刚烷胺和金刚乙胺)和神经氨酸酶抑制剂(扎那米韦和奥司他韦)。金刚烷胺和金刚乙胺通过阻断M2离子通道蛋白阻止病毒脱壳,使病毒RNA不能释放到细胞质中,病毒的早期复制被中断,从而起到抗流感病毒的作用;扎那米韦和奥司他韦特异性抑制A、B型流感病毒的NA。1994~1995年的H3N2流感毒株对 M2阻断剂耐药率约0.4%,但2003年后约61%的亚洲季节性H3N2流感毒株耐药,且耐药率还在上升[12]。本研究中H3N2病毒普遍对M2阻断剂耐药,而对神经氨酸酶抑制剂敏感,因此对当前H3N2流感的抗病毒治疗应使用神经氨酸酶抑制剂药物代替金刚烷胺和金刚乙胺,但严格管理其使用范围和剂量,以防止NA耐药毒株的快速产生。
面对宿主的免疫选择作用,病毒部分基因突变会被保存下来,成为病毒进化过程中的重要标志,发生在PB1(375位)和 PB1-F2(26位)的变异可能是病毒进化过程的重要分子标志。尤其PB1-F2蛋白于2001年被发现,完整的PB1-F2在病毒感染宿主的过程中具有诱导宿主细胞凋亡等重要功能。不同宿主、不同亚型病毒的PB1-F2呈现不同的断裂特征,H1N1亚型病毒的PB1-F2蛋白断裂较普遍,如季节性H1N1病毒在其第57位后发生断裂,古典猪H1N1病毒在其第11、25和34位后发生断裂,2009年新甲型H1N1流感病毒代表株A/California/07/2009(H1N1)在其第11、57和87aa后发生断裂,而大多数季节性H3N2病毒的PB1-F2是完整的,只有少部分地区曾报道人群H3N2病毒株PB1-F2蛋白的断裂[9],本次研究也首次发现了中国大陆地区的PB1-F2蛋白断裂。
从进化关系上讲,相比禽源流感病毒,猪群H3N2病毒同人群病毒具有相近的基因相似度。根据2005-2008年间的国内的猪群H3N2病毒和本次分离毒株间的遗传关系,此次本地区重新出现的甲型H3N2病毒很可能在人群中隐性感染而不断进化后发病;另一方面,人和禽甲型H3N2病毒可以分别与其结合而直接传染给猪,又因为NCBI数据库中暂时没有收集到中国地区2008年以后的猪流感H3N2病毒的序列信息,同时期的猪源病毒遗传信息未知,也不排除在猪群中进化后传播给人。华东地区传统的畜禽养殖模式为季节性流感病毒的进化提供了复杂的宿主结构,这也使得H3N2病毒的监测和防治工作变得更加复杂。江苏省2005年发现的“三源重配”猪H3N2流感病毒等[13]让我们更加准确地掌握了流感病毒在猪群中的进化特征,加强流感病毒在动物宿主中的监测,从生态学角度综合防治成为了本地区流感防控的新方向。
[1]Bedford T,Cobey S,Beerli P,et al.Global migration dynamics underlie evolution and persistence of human influenza A(H3N2)[J].PLoS Pathog,2010,6(5):e1000918.
[2]李亮,潘浩,鲍昌俊,等.江苏省近年来流感暴发疫情流行特征及影响因素分析[J].现代预防医学,2009,36(17):3221-3224.
[3]Hoffmann E,Stech J,Guan Y,etal.Universal primer set for the full-length amplification of all influenza A viruses[J].Arch Virol,2001,146:2275-2289.
[4]Enrique TM,Michael WD.Epitope analysis for influenza vaccine design[J].Vaccine,2005,23(9):1144-1148.
[5]王勇,薛颖,陈淑霞,等.H3N2亚型人流行性感冒病毒HA1的蛋白序列同源性比较、变异规律及结构与功能的分析[J].2002,18(4):289-296.
[6]李向忠,方芳,陈则.流感病毒神经氨酸酶不同区域的作用[J].生命科学研究,2005,9(2):56-61.
[7]Gubareva LV.Molecular mechanisms of influenza virus resistance to neuraminidase inhibitors[J].Virus Research,2004,103(1/2):199-203.
[8]祁贤,汤奋扬,李亮,等.新甲型 H1N1(2009)流感早期分子特征[J].微生物学报,2010,5(1):81-90.
[9]Krumbholz A,Philipps A,Oehring H,et al.Current knowledge on PB1-F2of influenza A viruses[J].Med Microbiol Immunol,2010,200(2):69-75.
[10]朱汝南,钱渊,王芳,等.北京市1998-2004年婴幼儿A3型流感病毒分离株HA1基因序列分析[J].中华流行病学杂志,2006,27(3):241-244.
[11]Holmes EC,Ghedin E,Miller N,et al.Whole-genome analysis of human influenza A virus reveals multiple persistent lineages and reassortment among recent H3N2viruses[J].Plos Biology,2005,3(9):1579-1589.
[12]Bright RA,Medina M,Xu X,et al.Incidence of adamantane resistance among influenza A (H3N2)viruses isolated worldwide from 1994to 2005:a cause for concern[J].Lancet,2005,366:1175-1181.
[13]Qi X,Jiao Y,Pan H,et al.Genetic analysis and rescue of a triple-reassortant H3N2influenza A virus isolated from swine in Eastern China[J].Virologica Sinica,2009,24(1):52-58.
