济泰片对人肝及Beagle犬肝中美沙酮代谢活性的影响
2012-01-16老东辉严东明马璟
老东辉,严东明,马璟
(中国医药工业研究总院上海医药工业研究院国家上海新药安全评价研究中心,上海201203)
济泰片对人肝及Beagle犬肝中美沙酮代谢活性的影响
老东辉,严东明,马璟
(中国医药工业研究总院上海医药工业研究院国家上海新药安全评价研究中心,上海201203)
目的评价济泰片对人肝中美沙酮代谢活性潜在的抑制作用及对Beagle犬肝中美沙酮代谢活性潜在的诱导作用。方法在人肝微粒体中加入济泰片1.5~150 mg·L-1,CYP3A4抑制剂酮康唑及CYP2D6抑制剂奎尼丁,再加入美沙酮进行共孵育30 min。用美沙酮的代谢产物2-亚乙基-1,5-二甲基-3,3-二苯基吡咯烷(EDDP)的生成速率反映美沙酮的代谢活性,评价济泰片对美沙酮的抑制作用。Beagle犬ig给予济泰片0.1875,0.625和1.875 g·kg-1,每天1次,共36周后制备犬肝微粒体,在制备的犬肝微粒体中加入美沙酮进行共孵育30 min,检测济泰片组美沙酮的代谢产物EDDP的生成速率。结果阳性抑制剂酮康唑、奎尼丁能显著抑制人肝微粒体中的美沙酮代谢,而济泰片未见明显抑制作用。济泰片1.875 g·kg-1组Beagle犬肝微粒体中美沙酮去甲基化反应的反应速率、代谢能力及单位体质量代谢能力均显著高于正常对照组,分别为0.86±0.17 vs(0.49±0.10)cps·min-1·mg-1蛋白,228±62 vs(115±13)cps·min-1·mg-1蛋白,10.6±0.8 vs(24.4±5.6)cps·min-1·mg-1蛋白·g-1(P<0.05)。结论济泰片对人肝中美沙酮的代谢不会产生抑制作用。济泰片对Beagle犬肝中美沙酮代谢具有一定的诱导作用。
济泰片;美沙酮;药物相互作用;细胞色素P450酶系统
济泰片是根据明清鄂东四大名医之一的杨际泰先生在清道光、同治年间独创的戒断鸦片毒瘾的秘方,又在汲取传统中医精髓的基础上,针对当代毒品特性,运用现代科学技术和工艺流程,研制而成的纯中药戒毒新品。其主要由延胡索、丹参、珍珠粉、人参和洋金花等15味纯中药制成。具有活血行气、散寒止痛、温肾健脾、清心安神和解毒制瘾之功能[1]。
美沙酮作为替代药物,最重要的特点是在使用充分剂量时可以减少或消除依赖者对阿片类药物的渴求;与同类药物间具有交叉耐受性,使得随后使用的阿片类药物的作用降低或不能发挥作用。因此,在服用美沙酮期间可防止再使用海洛因[2]。美国FDA和麻醉药品与危险药品局联合于1970年批准美沙酮维持治疗的实验性治疗。FDA于1972年正式批准美沙酮用于麻醉品依赖治疗。
济泰片在上市后对其单独用药效果观察以及中西医联合用药方面已有不少研究和报道。如李子红[3],熊建国等[4]分别报道了济泰片在联合美沙酮和洛非西定(lofexidine)用于防复吸时,可减少西药用量,疗效加强,不良反应小等特点。美沙酮维持治疗不能过早被打断。事实上,其目标就是针对持续数月或数年的药瘾[5]。两者均需长期用药,但其代谢性相互作用尚不明了,不利于临床用药安全。因此,有必要评价两者间代谢性相互作用的可能性。
1 材料与方法
1.1 试剂
盐酸美沙酮标准品,批号:1009008-1,购自中国药品生物制品检定所;济泰片粉末,批号:20090416,含量98.42%,由国家上海中药制剂工程中心提供;人肝微粒体购自XenoTech公司;酮康唑和奎尼丁购自Sigma-Aldrich公司;Pierce BCA蛋白测定试剂盒购自ThermoFisher公司;烟酰胺腺嘌呤二核苷酸磷酸(NADPH)购自TCI公司;三羟甲基氨基甲烷盐酸盐(Tris-HCl)购自Amresco公司;三羟甲基氨基甲烷(Tris)购自J.T.Baker公司;氯化钾、焦磷酸钠、乙二胺四乙酸和蔗糖购自国药集团上海化学试剂有限公司;甲醇和乙腈购自Merck公司,为色谱纯;甲酸购自Tedia公司。
1.2 仪器
液相色谱-质联用仪(HPLC-MS/MS)(包括Waters Alliance 2695高效液相色谱仪,Premier XE质谱仪和MassLynx 4.1软件)为美国Waters公司产品;ST-16R高速离心机为美国ThermoFisher公司产品;CP100MX超速离心机为美国Hitachi公司产品;匀浆机为IKA公司产品;XW-80C型涡旋混合器为上海医科大学仪器厂产品;ZHWY-100C气浴恒温振荡培养器为上海智诚分析仪器公司产品。
1.3 溶液的配制
速溶液含KCl 0.1 mol·L-1;匀浆用缓冲液含KCl 0.1 mol·L-1,Tris 0.1 mol·L-1与EDTA 1.0 mmol·L-1,pH 7.4;再次悬浮用缓冲液含焦磷酸钠0.1 mol·L-1与EDTA 1.0 mmol·L-1,pH 7.25;微粒体储备用缓冲液含蔗糖0.25 mol·L-1。终止液为含对乙酰氨基酚200 nmol·L-1的乙腈溶液。济泰片溶液中含济泰片1 g·L-1与Tris-HCl 0.1 mol·L-1。
1.4 HPLC-MS/MS测定方法的建立及美沙酮代谢稳定性考察
1.4.1 HPLC-MS/MS测定方法
孵育样品中美沙酮与其代谢产物EDDP的浓度采用HPLC-MS/MS进行分析测定。检测条件如下:色谱柱为Waters Symmetry C183.5 μm柱,柱温为40℃。流动相为0.1%甲酸∶乙腈(含0.1%甲酸),梯度洗脱(0~0.9 min:70∶30,1.0~3.5 min:20∶80,3.6~6 min:70∶30),流速为0.4 ml·min-1,进样量5 μl。离子化方式选择电喷雾电离正电子方式。毛细管电压为2.7 kV,萃取电压为2.00 V。干燥气温度为300℃,离子源温度为100℃。干燥气流速为600 L·h-1,锥孔气流为50 L·h-1。美沙酮、EDDP和内标对乙酰氨基酚的质谱分析条件见表1。

Tab.1 Parameters of mass spectrometry
1.4.2 美沙酮代谢稳定性测定
孵育体系的总体积为0.2 ml。含Tris-HCl缓冲液0.1 mol·L-1(pH 7.4),人肝微粒体0.5 g·L-1,NADPH 1 mmol·L-1,美沙酮10 μmol·L-1。37℃条件下气浴孵育30 min后加入200 μl终止液终止反应。同时进行未经孵育,正常对照(不含美沙酮)及阴性对照(不含NADPH)的样品的处理。
以EDDP峰面积与内标对乙酰氨基酚峰面积之比求得EDDP的响应值,表示美沙酮代谢的程度。
1.5 考察人肝微粒体中济泰片对美沙酮去甲基化代谢抑制作用
1.5.1 分组给药和孵育
孵育体系的总体积为0.2 ml,3份样品平行处理。含Tris-HCl缓冲液0.1 mol·L-1(pH 7.4),人肝微粒体0.5 g·L-1,NADPH 1 mmol·L-1,美沙酮10 μmol·L-1,济泰片组含济泰片1.5,5,15,50和150 mg·L-1。阳性对照组依次含CYP3A4抑制剂酮康唑0.1,0.3,1,3和10 μmol·L-1、CYP2D6抑制剂奎尼丁0.05,0.15,0.5,1.5和5 μmol·L-1以及混合抑制剂酮康唑0.1,0.3,1,3和10 μmol·L-1与奎尼丁0.05,0.15,0.5,1.5和5 μmol·L-1。最终的孵育体系中的乙腈含量为1%(V/V)。
在37℃下预孵育10 min。加入NADPH后在37℃气浴中振荡孵育30 min。在相同的条件下进行对照组(不含济泰片或NADPH)的孵育。
1.5.2 样品预处理及EDDP的测定
孵育30 min后,加入200 μl终止液终止反应。涡旋3 min,21 913×g下离心10 min,取上清5 μl进样分析EDDP含量。
1.5.3 济泰片对美沙酮代谢抑制作用的测定
人肝微粒体中美沙酮去甲基化代谢的剩余反应活性以不同浓度的抑制剂(济泰片或各阳性对照)存在条件下代谢产物EDDP的生成速率相对于对照(无济泰片)中EDDP的生成速率的百分比来表示。使用GraphPad Prism 5进行非线性拟合,并计算IC50。
1.6 考察犬体内济泰片对美沙酮去甲基化代谢诱导作用
1.6.1 动物的分组、给药及处理
Beagle犬分别ig给予济泰片0.1875,0.625及1.875 g·kg-1(分别相当于临床人每日最大用量0.245 g·kg-1的3,10和30倍),每组4只,雌雄各半。每周连续给药6 d,每天1次,共6 d,周日停药1 d,连续ig给药36周。给药容量为7 ml·kg-1。正常对照组ig给予去离子水。给药结束后处死犬,取肝。记录各组Beagle犬体质量并计算肝系数=肝质量(mg)/体质量(g)×100。
1.6.2 Beagle犬肝微粒体的制备及蛋白浓度测定
将取得的Beagle犬肝组织在碎冰上剪碎。每份肝组织在冰上加入匀浆用缓冲液匀浆后使用匀浆机制备肝匀浆。所得的肝匀浆9000×g离心25 min。收集上清液,弃去底部沉淀物。上清液,105 000×g离心70 min,弃去上清液,加入再次悬浮用缓冲液重悬浮后105 000×g离心45 min。弃去上清液获得最终沉淀物为制备得到的犬肝微粒体。加入预冷的微粒体储备用缓冲液,并用匀浆机重新悬浮微粒体,在-70℃冰箱中保存[6]。使用Pierce BCA试剂盒测定制备得的Beagle犬肝微粒体蛋白浓度[7]。
1.6.3 样品孵育及预处理
孵育体系的总体积为0.2 ml,2份样品平行处理。含Tris-HCl缓冲液0.1 mol·L-1(pH 7.4),犬肝微粒体终浓度均至0.5 g·L-1,NADPH 1 mmol·L-1和美沙酮10 μmol·L-1。最终的孵育体系中的乙腈含量为1%(V/V)。在37℃下预孵育10 min。加入NADPH后在37℃气浴中振荡孵育30 min。30 min后,加入200 μl终止液终止反应。涡旋3 min,21 913×g下离心10 min,取上清5 μl进样分析EDDP含量。
1.6.4 美沙酮去甲基化代谢能力的计算
以EDDP的生成速率,个体动物的代谢能力(代谢能力=生成速率×肝质量)及单位体质量的代谢能力(单位体质量的代谢能力=生成速率×肝质量/体质量)来评价在犬中美沙酮去甲基化代谢的反应活性。
1.7 统计学分析
2 结果
2.1 美沙酮的代谢稳定性
美沙酮代谢稳定性结果见图1。在孵育30 min后,样品中2.3 min处出现一个未知峰,而空白对照、阴性对照及孵育0 min样品在该时间均见峰。说明该峰为美沙酮的代谢产物。其离子对质荷比为278.00→248.90。与参考文献[8]报道一致,可初步推测该代谢产物为EDDP。
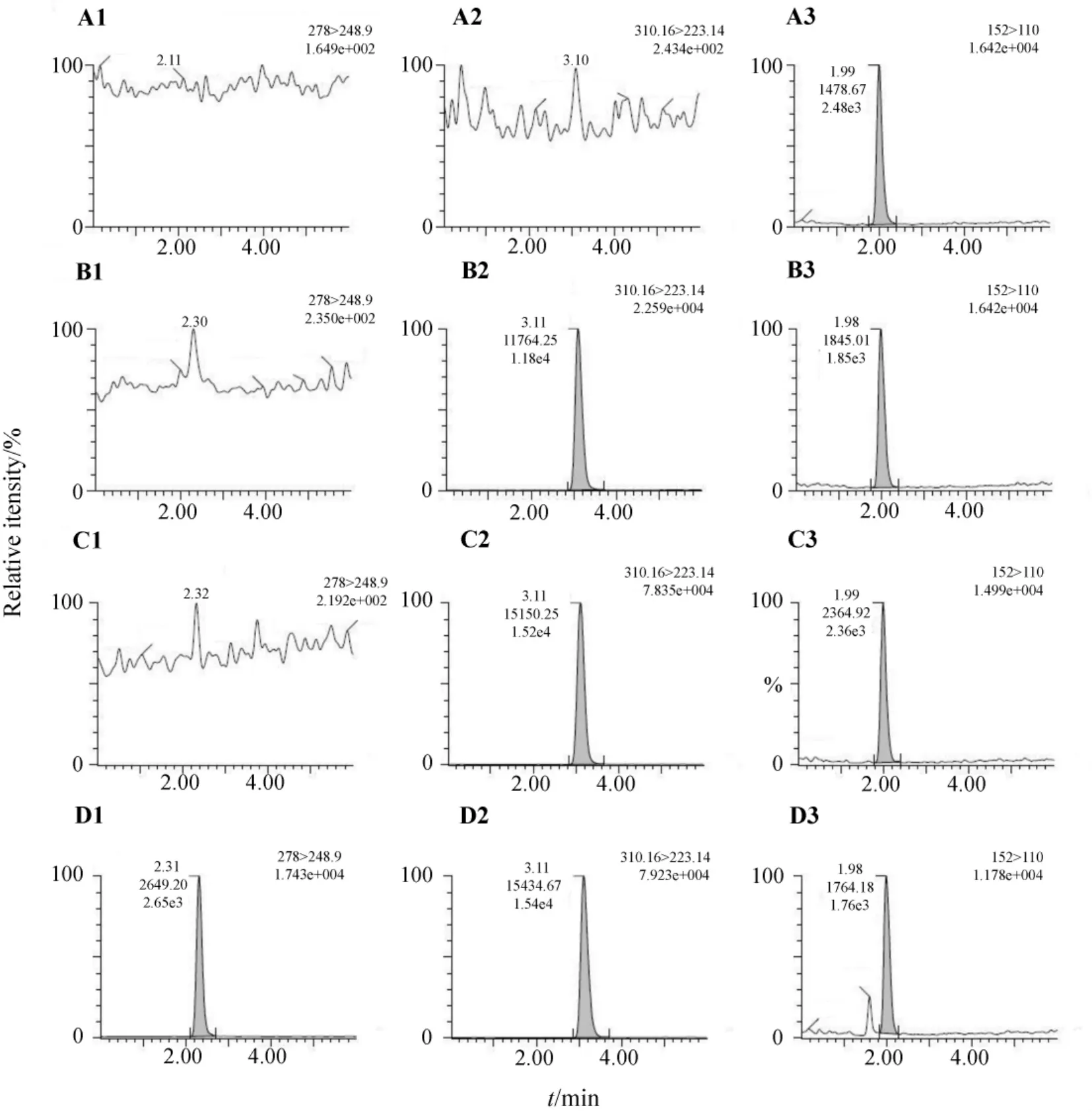
Fig.1 Metabolic stability of methadone and its metabolite EDDP.A:blank,B:negative control(without NADPH),C:sample incubated for 0 min,D:sample incubated for 30 min.1.metabolite EDDP;2.methadone;3.internal standard:acetaminophen.
2.2 济泰片对美沙酮去甲基化代谢抑制作用
加入济泰片、酮康唑、奎尼丁、酮康唑与奎尼丁后的美沙酮去甲基化反应的剩余活性见图2。济泰片组美沙酮去甲基化反应的活性未见显著抑制;而各阳性对照(酮康唑,奎尼丁,酮康唑+奎尼丁)均发生显著抑制。阳性对照中酮康唑的IC50为1.52 μmol·L-1;奎尼丁的IC50为12.41 μmol·L-1;酮康唑+奎尼丁组的IC50为0.83 μmol·L-1(以酮康唑计)与1.65 μmol·L-1(以奎尼丁计)。
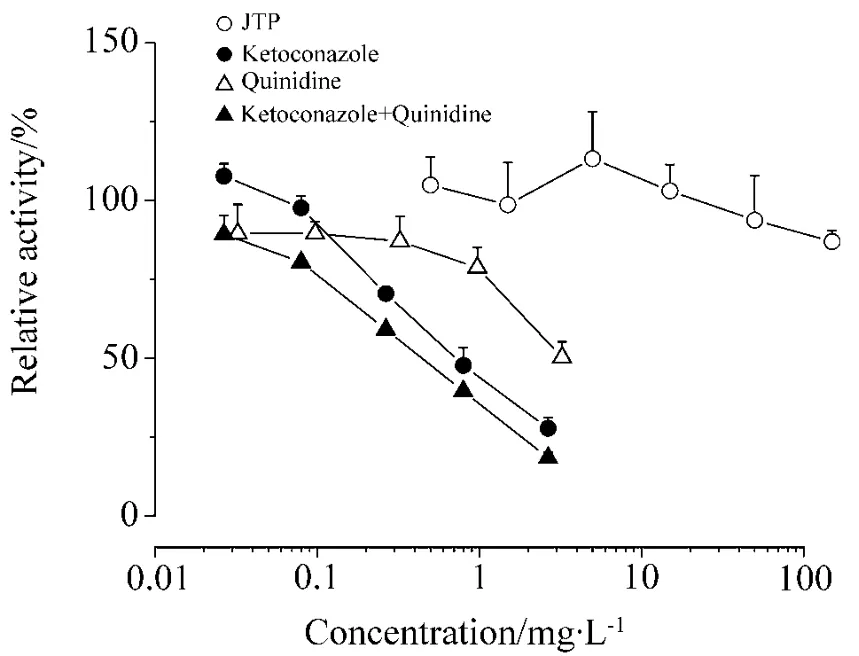
Fig.2 Inhibition of Jitai tablets(JTP),quinidine and ketoconazole on methadone demethylation.±s,n=3.
2.3 济泰片对美沙酮去甲基化代谢的诱导作用
2.3.1 Beagle犬肝微粒体的蛋白浓度
Beagle犬的肝质量、肝系数以及使用BCA法测得的Beagle犬肝微粒体蛋白浓度如表2所示。济泰片0.1875,0.625和1.875 g·kg-1组肝质量及蛋白浓度与溶媒对照组相比无显著性差异。济泰片1.875 g·kg-1组肝系数为溶媒对照组的129%,显著大于溶媒对照组(P<0.05);济泰片0.1875和0.625 g·kg-1组与溶媒对照组相比均有增大的趋势,但无统计学差异。
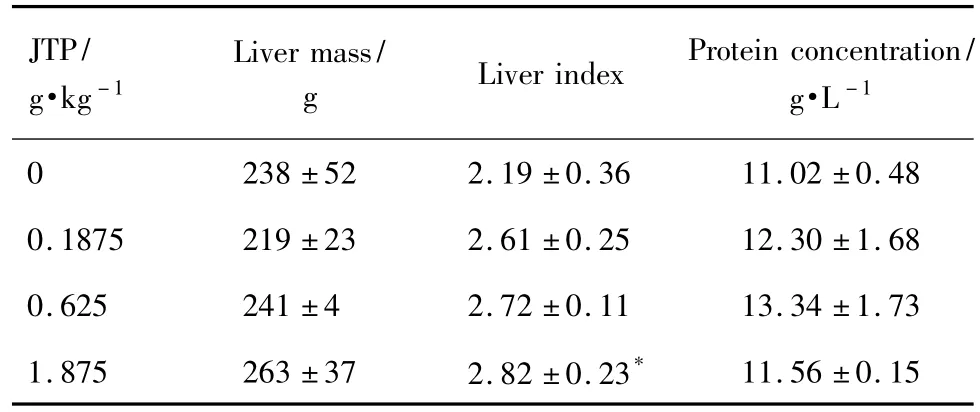
Tab.2 Effect of JTP on liver mass,liver index and protein concentration in Beagle dog liver microsome with methadone
2.3.2 济泰片对美沙酮去甲基化代谢的诱导作用
表3为济泰片0.1875,0.625和1.875 g·kg-1组Beagle犬微粒体中美沙酮代谢产物EDDP的生成速率;以及溶媒对照组、济泰片0.1875,0.625和1.875 g·kg-1组Beagle犬微粒体中美沙酮去甲基化反应的代谢速率、代谢能力及单位体质量代谢能力。与正常对照组相比,济泰片1.875 g·kg-1组的生成速率、代谢速率明显降低(P<0.05)。
JTP 0.1875和0.625 g·kg-1组中美沙酮去甲基化反应的反应速率、代谢能力与单位体质量代谢能力分别为溶媒对照组的110%和128%,102%和132%,133%和162%,与溶剂对照组相比并未见显著性差异;而JTP 1.875 g·kg-1组中美沙酮去甲基化反应的反应速率、代谢能力与单位体质量代谢能力分别为溶媒对照组的175%,198%与230%,与溶剂对照组相比均显著增大(P<0.05)。诱导作用、代谢能力与单位体质量代谢能力均表现出了一定的剂量依赖性。
济泰片体外实验中对人肝中美沙酮去甲基化代谢未观察到抑制作用,故济泰片在临床上与一线戒毒药美沙酮合用时不太可能发生基于CYP450的代谢性抑制作用。Beagle犬连续给予济泰片1.875 g·kg-1(相当于临床每日最大剂量的30倍)36周后,能够诱导其肝微粒体中的美沙酮去甲基化反应。但是否会发生具有临床意义的诱导作用有待进一步研究。
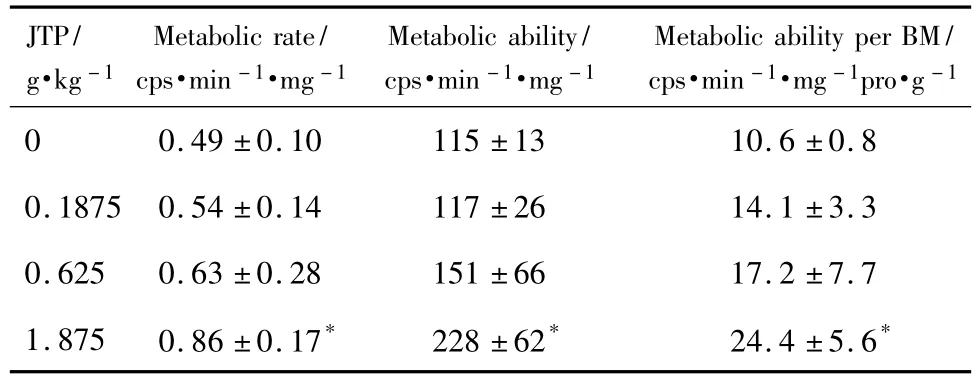
Tab.3 Effect of JTP on metabolic rate,metabolic ability and metabolic ability per body mass(BM)of methadone demethylation
3 讨论
有大量报道植物药制剂对药酶活性产生影响[9],说明中药也可能对药酶活性有影响。中药抑制性药物相互作用研究,通常采用人肝微粒体体系进行实验以确定抑制性相互作用是否会发生[10-11]。有关中药诱导性药物相互作用的报道较少,主要利用肝细胞体系进行细胞培养实验,也有通过测定mRNA的表达调控进行研究[12-13]。本研究使用HPLC-MS/MS进行检测,灵敏度高,分析速度快,易排除中药复杂组分中的干扰,适用于中药相互作用的研究。本研究中抑制作用研究采用体外人肝微粒体系统,实验操作简便快速,结果无需跨种属外推;诱导作用研究以制备长期给药后Beagle犬的肝微粒体作为实验体系,能够反映出整体水平下的酶活性改变情况。
文献报道美沙酮主要通过CYP3A4与CYP2D6催化的N-去甲基化反应代谢。CYP2C18也参与美沙酮的代谢,但并非美沙酮在人体中的主要代谢途径[14]。本研究采用CYP2D6与CYP3A4抑制剂奎尼丁与酮康唑作为阳性对照,以验证实验系统[15]。尽管美沙酮代谢途径多,但其主要代谢产物均为EDDP。故本研究中以EDDP的生成情况来评价美沙酮的代谢情况。
根据文献报道,肝微粒体所占肝质量比例为52.5 mg·g-1[16],而肝质量占体质量的比例为20 g·kg-1[17]。故按体质量计算肝微粒体应为1 g·kg-1。济泰片在肝微粒体中能达到的最高浓度为30 mg·g-1肝微粒体。济泰片200 mg·kg-1,假设其生物利用度为100%并完全分布至肝中,则济泰片在肝中所能达到的最高暴露量为30 mg·g-1肝微粒体。本研究中肝微粒体浓度为0.5 g·L-1,济泰片的浓度设为1.5~150 mg·L-1,该范围能够涵盖体内可能达到的最大浓度。一般评价抑制的研究需要有明确的指标成分及该成分在体内的吸收情况,本实验在无此类信息的前提下做出上述几个假设,能够确保抑制实验不会出现假阴性结果。美沙酮的有效阻断渴求与防治出现戒断症状的体内浓度为150~200 μg·L-1[18],故本研究中诱导研究中美沙酮的终浓度设为1 μmol·L-1(约345.9 μg·L-1),与人体内可能达到的实际浓度相当。
本研究济泰片150 mg·L-1浓度下对美沙酮在人肝微粒体中的代谢无抑制作用,故在体内也不会产生相应的抑制作用。济泰片0.1875~1.875 g·kg-1(相当于临床最大给药量的3~30倍)时,Beagle犬肝微粒体中显示对美沙酮代谢有一定的剂量依赖性的诱导作用。济泰片在Beagle犬中低剂量组中给药剂量为0.1875 g·kg-1(相当于临床最大人用剂量的3倍),给药36周后并未观察到对美沙酮去甲基化代谢反应产生诱导性相互作用。故临床按照说明书服用,不会发生美沙酮去甲基化代谢相关的药物相互作用。因此济泰片同美沙酮合用时不会引起美沙酮的不良反应,长期服用济泰片也不会降低美沙酮药效。
[1]Chen YA,Yan BY,Deng YP.Pharmacology of Jitai tablets,a traditional Chinese medicine for detoxification[J].Chin J New Drugs(中国新药杂志),2010,19(14):1229-1233.
[2]Guo S.Therapeutical protocol of methadone maintenance[J].Chin J Drug Depend(中国药物依赖性杂志),2001,10(2):91-94.
[3]Li ZH,Tang YX,Hua SZ,Wang Y.Efficacy of Jitai for protracted withdrawal symptoms in heroin dependent patients[J].Chin J Drug Depend(中国药物依赖性杂志),2007,16(4):284-287.
[4]Xiong JG,Xiao ZX,Li J,Qin DS,Min MS,Yang JH,et al.Clinical effect of Jitai tablet combined with lofexidine in the treatment of heroin dependence[J].Chin J Drug Depend(中国药物依赖性杂志),2001,10(4):290-292.
[5]Brettle RP.HIV and harm reduction for injection drug users[J].AIDS,1991,5(2):125-136.
[6]Philip,S.[5]Preparation of microsomes and submicrosomal fractions:Mammalian[M]∥Sidney PC,Nathan OK.Methods in Enzymology.Academic Press,1962:61-68.
[7]Walker JM.The bicinchoninic acid(BCA)assay for protein quantitation[J].Methods Mol Biol,1994,32:5-8.
[8]Moody DE,Lin SN,Chang Y,Lamm L,Greenwald MK,Ahmed MS.An enantiomer-selective liquid chromatography-tandem mass spectrometry method for methadone and EDDP validated for use in human plasma,urine,and liver microsomes[J].J Anal Toxicol,2008,32(3):208-219.
[9]Hafner-Blumenstiel V.Herbal drug-drug interaction and adverse drug reactions[J].Ther Umsch,2011,68(1):54-57.
[10]Xu B,Zhao G,Wei H,Qian XF,Li JX,Xu W.Effects of 20 Chinese patent medicines on the catalytic activities of five main cytochrome P450s of human liver microsome[J].J Pharm Pract(药学实践杂志),2009,27(5):353-356.
[11]Ai CH,Sun HX,Li H,Zhuang XM,Dong DL.In vitro inhibition of cytochrome P450 activities by active constituents of Chinese herbal drugs[J].Chin Pharmacol Bull(中国药理学通报),2011,27(4):519-523.
[12]Guo YJ,Zhang JJ,Si DY,Gu JK,Zhou H.Effects of the active components of Chinese herbs on CYP related genes express ion in HepG2 cells[J].Tradit Chin Drug Res Clin Pharmacol(中药新药与临床药理),2008,19(4):243-246.
[13]Wang YG,Gao Y,Chai BX,Chen P,Tan HL,Zhao YH,et al.Modulation of the activities and mRNA expression of cytochrome P450 isoenzymes in rat liver by Panax gingseng and coadministration with Veratrum nigrum[J].China J Chin Mater Med(中国中药杂志),2004,29(4):366-370.
[14]Wang JS,DeVane CL.Involvement of CYP3A4,CYP2C8,and CYP2D6 in the metabolism of(R)-and(S)-methadone in vitro[J].Drug Metab Dispos,2003,31(6):742-747.
[15]Sullivan HR,Due SL.Urinary metabolites of dl-methadone in maintenance subjects[J].J Med Chem,1973,16(8):909-913.
[16]Iwatsubo T,Hirota N,Ooie T,Suzuki H,Shimada N,Chiba K,et al.Prediction of in vivo drug metabolism in the human liver from in vitro metabolism data[J].Pharmacol Ther,1997,73(2):147-171.
[17]Boxenbaum H.Interspecies variation in liver weight,hepatic blood flow,and antipyrine intrinsic clearance:extrapolation of data to benzodiazepines and phenytoin[J].J Pharmacokinet Biopharm,1980,8(2):165-176.
[18]Sees KL,Delucchi KL,Masson C,Rosen A,Clark HW,Robillard H,et al.Methadone maintenance for opioid dependence[J].JAMA,2000,284(6):694-695.
Effect of Jitai tablets on metabolic activity of methadone in human and Beagle dog livers
LAO Dong-hui,YAN Dong-ming,MA Jing
(Naitonal Shanghai Center for Drug Safety Evaluation and Research,Shanghai Institute of Pharmaceutical Industry,Chinese Institute of Pharmacetuical Industry,Shanghai201203,China)
OBJECTIVETo evaluate metabolic inhibition potential of Jitai tablet(JTP)on methadone in human liver and induction potential in Beagle dog liver for predicting drug-drug interactions while coadministrating.METHODSJTP 1.5-150 mg·L-1,positive inhibitors of CYP3A4 ketoconazole and positive inhibitor of CYP2D6 quinidine were added into human liver microsome(HLM)incubation system with methadone for coincubation.Formation rate of EDDP(a metabolite of methadone)indicated metabolic activity on methadone for inhibition evaluation.After Beagle dogs were administered by JTP 0,0.1875,0.625 and 1.875 g·kg-1for 36 weeks,dog liver microsome(DLM)was prepared.Methadone was added in DLM incubation system.EDDP formation rate and metabolic ability in JTP groups were determined for induction evaluation of JTP on methadone.RESULTSSignificant inhibitory effect on methadone demethylation was found in ketoconazole,quinidine,and ketoconazole+quinidine groups,but there was no inhibitory effect in JTP group.The metabolic rate,metabolic ability and metabolic ability per body mass of methadone demethylation in JTP 1.875 g·kg-1group were greater than those in normal control group,and were 0.86±0.17 vs(0.49±0.10)cps·min-1·mg-1protein,228±62 vs(115±13)cps·min-1·mg-1protein,10.6±0.8 vs(24.4±5.6)cps·min-1·mg-1protein·g-1,respectively(P<0.05).CONCLUSIONJTP has no inhibitory effect on methadone metabolism in human liver.JTP shows certain inductive effect on methadone metabolism in DLM.
Jitai tablet;methadone;drug interactions;cytochrome P-450 enzyme system
The project supported by National Science and Technology Support Program(2008BAI49B05);and Major Projects Foundation of National Science and Technology of China(2012ZX09302002)
YAN Dong-ming,E-mail:dmyan@ncdser.com,Tel:50800333-305
R969.2
A
1000-3002(2012)06-0876-06
10.3867/j.issn.1000-3002.2012.06.017
国家科技支撑计划项目(2008BAI49B05);十二五国家科技重大专项(2012ZX09302002)
老东辉(1982-),男,硕士研究生,主要从事毒物代谢动力学与药物相互作用的研究;严东明(1982-),男,博士,助理研究员,主要从事药代动力学研究。
严东明,E-mail:dmyan@ncdser.com
2012-02-17接受日期:2012-06-27)
(本文编辑:付良青)
