雷公藤甲素对Wistar大鼠免疫毒性相关基因表达的影响
2012-01-16耿兴超洪敏宋莹林志张亮李波王军志
耿兴超,洪敏,宋莹,林志,张亮,李波,王军志
(1.第四军医大学药学系,陕西西安710032;2.中国食品药品检定研究院国家药物评价监测中心,北京100050;3.中山大学药学院,广东广州510006;4.博尔诚北京科技有限公司,北京100176)
雷公藤甲素对Wistar大鼠免疫毒性相关基因表达的影响
耿兴超1,2,洪敏2,宋莹3,林志2,张亮4,李波2,王军志2
(1.第四军医大学药学系,陕西西安710032;2.中国食品药品检定研究院国家药物评价监测中心,北京100050;3.中山大学药学院,广东广州510006;4.博尔诚北京科技有限公司,北京100176)
目的应用基因芯片技术研究雷公藤甲素对大鼠胸腺全基因表达谱的影响,从基因水平探讨雷公藤甲素引起免疫抑制毒性的潜在分子作用机制。方法Wistar大鼠,连续28 d ig给予雷公藤甲素0.5和1.0 mg·kg-1以及环孢素A 20 mg·kg-1(阳性对照),进行T细胞依赖抗体反应检测、免疫器官组织病理学检查和胸腺组织基因芯片实验。结果与溶媒对照组相比,雷公藤甲素0.5和1.0 mg·kg-1组和环孢素A组大鼠血清中T细胞依赖抗体应答水平均受到了显著抑制。组织病理学检查发现,雷公藤甲素1.0 mg·kg-1使胸腺皮髓质淋巴细胞数量轻度减少,环孢素A使胸腺髓质皮质化。基因芯片检测结果显示,雷公藤甲素1.0 mg·kg-1给药第7天引起422个显著差异表达基因,其基因功能主要涉及DNA依赖的细胞转录调节、核转运、微管蛋白复合体装配、核小体装配、线粒体DNA转录、氨基酸转运和线粒体DNA复制等。KEGG通路分析发现差异表达基因主要参与移植排斥和自身免疫性疾病等多个与免疫抑制相关的基因表达调控途径。结论雷公藤甲素1.0 mg·kg-1能够引起大鼠胸腺基因表达谱的显著性改变,其免疫毒性的主要机制可能是通过下调免疫毒性相关基因的表达,抑制淋巴细胞的增殖。
雷公藤内酯;胸腺;免疫;毒性作用;基因表达谱
雷公藤甲素(triptolide)是从雷公藤中分离出的环氧化二萜内酯化合物,具有免疫抑制、抗炎、抗生育及抗肿瘤等多种生物活性[1]。雷公藤甲素大剂量能引起一系列的毒性反应,包括肝、肾和免疫毒性等。其中,免疫毒性通常会引起机体免疫功能低下或发生障碍,导致多种继发性感染(如败血症、肺炎、脑膜炎等)和肿瘤性病变等。雷公藤甲素引起免疫抑制毒性可能通过抑制T淋巴细胞增殖和白细胞介素2的产生,诱导T淋巴细胞或树突状细胞的凋亡,抑制树突状细胞的抗原呈递功能等[2]。然而雷公藤甲素的免疫抑制毒性在基因水平的作用机制还未见文献报道。
近年来,已有使用基因组学技术研究免疫功能的报道[3],通过研究与淋巴细胞分化、活化、信号转导、自我和非我识别、天然和获得性免疫调控、免疫反应种属差异、自身免疫性疾病等相关基因的改变,增加对免疫过程和机制的理解。胸腺是非常敏感的靶器官[4],当暴露于免疫毒性物质时,胸腺组织形态的变化以及基因的调控与免疫毒性的评价具有特定的关联性,使用胸腺组织作为研究对象观察基因表达谱的变化,对于研究免疫毒性药物的免疫毒性产生机制具有重要作用和意义。
本研究通过观察Wistar大鼠ig给予雷公藤甲素28 d的免疫毒性,探讨大鼠胸腺基因表达谱的变化,分析免疫毒性相关的差异表达基因,同时结合其他免疫毒性评价指标,进一步验证和阐明雷公藤甲素的免疫毒性作用机制。
1 材料与方法
1.1 药品、仪器和试剂
雷公藤甲素,批号:TTL01011,购自北京美迪克斯生物技术有限公司;玉米油,批号:20090210,购自秦皇岛金海食品工业有限公司;钥孔虫戚血蓝蛋白(keyhole limpet hemocyanin,KLH),批号:019K4762,购自美国Sigma公司;RNAlater样品储存液,批号:136259743,购自德国Qiagen公司;RNA扩增与荧光标记试剂盒,批号:0006088011,杂交试剂盒,批号:0006081570,大鼠8×60 K全基因组表达谱芯片,批号:0006077112,均购自美国Agilent公司。
SPECTRAmax-PLUS型酶标仪为美国Molecular Devices公司产品;Nano Drop紫外分光光度计为美国Thermo Fisher科技公司产品;凝胶电泳仪为Elchrom公司产品;芯片杂交仪,G3微阵列芯片扫描仪为美国Agilent公司产品;Light Cycler®480实时定量PCR系统为瑞士罗氏公司产品。
1.2 动物、分组和给药
Wistar大鼠,60只,雌性,体质量170~220 g,SPF级,由北京维通利华实验动物技术有限公司提供,动物许可证号:SYXK(京)2006-0026。饲养于SPF级实验动物室,温度20~25℃,日温差≤3℃,相对湿度40%~70%,换气次数为10~20次·h-1,照明时间为12 h自动切换。大鼠按体质量随机分为溶媒对照组、环孢素A 20 mg·kg-1(阳性对照)组、雷公藤甲素0.5和1.0 mg·kg-1组,每组15只;每天1次、连续28 d ig给药,溶媒对照组ig给予溶媒玉米油。
1.3 T细胞依赖抗体的检测
假期时,很多尼姑和陈莲曲珠一样,会为信众念经祈福,或者组织信众教授藏文、宣讲一些与“构建和谐社会、维护藏区稳定”“和谐寺观教堂创建工作”等相关政策相宜的佛教教义。
1.4 组织病理学检查
雷公藤甲素组大鼠分别于第7,14和28天剖解,每次5只,分别取胸腺、脾、肠系膜淋巴结和胸骨用10%甲醛固定,修块取材,逐级乙醇脱水,石蜡包埋,滑动切片机切片,经HE染色,光镜下进行组织病理学检查。
1.5 基因芯片法检测大鼠胸腺组织相关基因表达
对第7天雷公藤甲素1.0 mg·kg-1引起的422个基因进行GO功能注释及富集度分析,如表2所示,主要差异表达基因的基因功能涉及DNA依赖的细胞转录调节、核转运、微管蛋白复合体装配、核小体装配、线粒体DNA转录、氨基酸转运和线粒体DNA复制等功能。对第7天环孢素A的228个基因进行功能注释及富集度分析,发现主要差异表达基因的基因功能则主要涉及免疫反应、免疫球蛋白分泌、T细胞增殖、B细胞增殖、细胞因子分泌和细胞周期调节等几个方面。
第7和第14天大鼠剖检后,迅速分离小部分胸腺组织,按照1∶10体积比加入RNAlater样品储存液,整个过程注意避免RNA的降解,4℃下让RNAlater样品储存液充分渗透组织24 h后,置于-80℃长期保存。
1.5.2 RNA提取、体外逆转录和表达探针的制备
每组3个样本,按照Trizol试剂按照说明书提取样品总RNA,使用紫外分光仪进行总RNA定量,保证RNA样品的纯度,使用琼脂糖甲醛变性凝胶电泳检测总RNA完整性。将质量合格的RNA按照RNA扩增与荧光标记试剂盒说明扩增得到Cy3标记的cRNA。
1.5.3 基因芯片杂交和扫描、图像采集及数据分析
最后,在新疆南路被堵截的情况下,急需在北路设立一个新疆与内地之间的中转站。“左宗棠从俄国买粮取道布伦托海,为了粮食的护运调遣西征捷勇马队三营统领补用总兵冯桂增移驻沙湾地方择要驻扎,因为沙湾地方有通布伦托海的路径。”[注]中国第一历史档案馆编:《光绪朝朱批奏折》第113辑,中华书局,1996年版,第42页。
使用上述提取的总RNA,根据SAM软件分析结果,按照统计学的基因变化显著性差异,选择显著性最大的7个基因作为代表性基因进行验证,设计相应的引物(表1),用逆转录试剂盒得到cDNA,以β肌动蛋白作为内参照进行PCR扩增,使用实时定量PCR的方法检测部分显著性差异表达基因,以验证基因芯片结果。
本文基于实践,从构建课程体系、准确定位课程、丰富研修资源、转变研修形式四个方面,梳理了“研修一体”背景下,区域教师职后教育课程的创新经验。之所以称其为创新,是因为在由“教研”和“培训”向“研修一体”转化的过程中,必须突破旧的思维定势和常规戒律,而创新的本质就是突破。这种突破的立足点是教师的专业成长,这种突破的载体是课程,这种突破的意义是探寻教师职后教育的专业化。
使用扫描仪扫描芯片上Cy3的荧光信号。芯片上每一点的信号强度代表了Cy3表达的cRNA与芯片杂交的信号强度。提取芯片数据,在2组大鼠中杂交信号值都超过800的基因判定为是有差异表达的基因,去除同一基因在不同样本中信号值的CV值在0.15以下的基因,即把恒定表达的看家基因去掉,然后进行非监督聚类分析,用软件分析两组样本之间的差异基因,其中倍数变化大于2,q<0.05作为判断基因差异表达的条件。然后使用超几何分布对差异表达基因进行功能及富集度分析,并使用数据库对差异表达基因进行通路分析。
1.5.4 定量逆转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)检测差异表达基因
用Agilent杂交试剂盒与Agilent大鼠8×60 K表达谱芯片在Agilent杂交炉中65℃杂交17 h,然后洗涤芯片。
另取大鼠12只,分组同1.2,ig给予相应药物,每天1次,连续2周后,于左后足跖部注射KLH 300 μg进行免疫,注射体积为每只0.1 ml。继续ig给药至28 d后采血,将血清梯度稀释,用ELISA方法检测血清中抗KLH特异性IgG抗体,抗体水平用抗体终点滴度表示。

Tab.1 Primers for 7 differentially expressed genes by triptolide
1.6 统计学分析
8.“现代农业+电子商务”上行创新。深入开展电子商务进农村综合示范工程,在渝东17个区县(自治县)推进国家级电子商务进农村综合示范工程,在渝西12个涉农区推进市级电子商务进农村综合示范工程。积极培育多元化农村电子商务市场主体,鼓励引导电商企业与合作社、种植养殖大户等建立直采直供关系,推动农产品线下流通与线上营销融合发展,着力打造重庆地域特色的农产品知名电商品牌,探索重庆特色的农产品线下“上行”网销模式。
2 结果
2.1 雷公藤甲素对T细胞依赖抗体反应的影响
图1 T细胞依赖抗体反应检测结果显示,KLH免疫14 d后,与溶媒对照组相比,雷公藤甲素0.5和1.0 mg·kg-1组和环孢素A组大鼠血清中抗KLH特异性IgG抗体应答水平均受到显著抑制(P<0.01),其中雷公藤甲素1.0 mg·kg-1对IgG抗体应答水平明显高于雷公藤甲素0.5 mg·kg-1(P<0.01)。
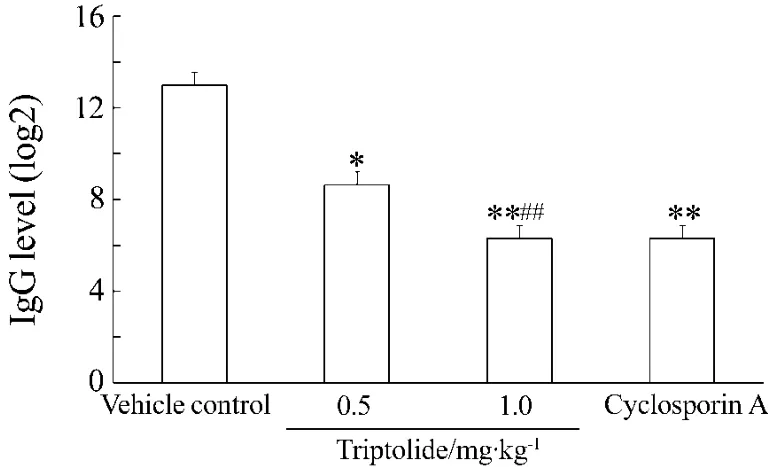
Fig.1 Effect of triptolide on anti-keyhole limpet hemocyarin(KLH)IgG level in rat serum.Rats were ig given triptolide 0.5 and 1.0 mg·kg-1and cyclosporin A 20 mg·kg-1,once daily,for 28 d.On the 14th day,KLH 300 μg was injected at left foot of rats.After 28 d,blood was collected and IgG level were detected by ELISA.±s,n=3.*P<0.05,**P<0.01,compared with vehicle control group.##P<0.01,compared with triptolide 0.5 mg·kg-1group.
2.2 雷公藤甲素对组织病理学的影响
对各种在制品解吸湿过程数据进行拟合分析,结果见表1和表2。从表1和表2可以看出,对烟草在制品解吸湿过程平衡含水率建立二次多项式拟合模型,相对湿度和平衡含水率相关性表现为极显著。对于每种烟草在制品,在40%~80%的相对范围之内,可求出任意与之对应的平衡含水率。反之,设定每种烟草在制品需要的平衡含水率,可确定与之对应的环境相对湿度。
给药28 d后,正常对照组和雷公藤甲素0.5 mg·kg-1组大鼠多种组织器官均未见明显组织病理学改变(图2A);而雷公藤甲素1.0 mg·kg-1组大鼠的组织病理学检查主要表现为胸腺皮髓质淋巴细胞数量轻度减少(图2B),胸骨骨髓细胞数量轻度减少,脾出现代偿性红髓髓外造血;环孢素A组大鼠的组织病理学改变主要表现为胸腺髓质皮质化(图2C)。
2.3 芯片检测基因表达谱变化
Trizol试剂提取总RNA样本,经Nano Drop紫外分光仪检测A260nm/A280nm均在1.9~2.0;甲醛变性凝胶电泳定性分析,结果可见清晰的28S和18S的RNA条带,表明RNA没有降解,纯度较高,符合芯片实验要求。
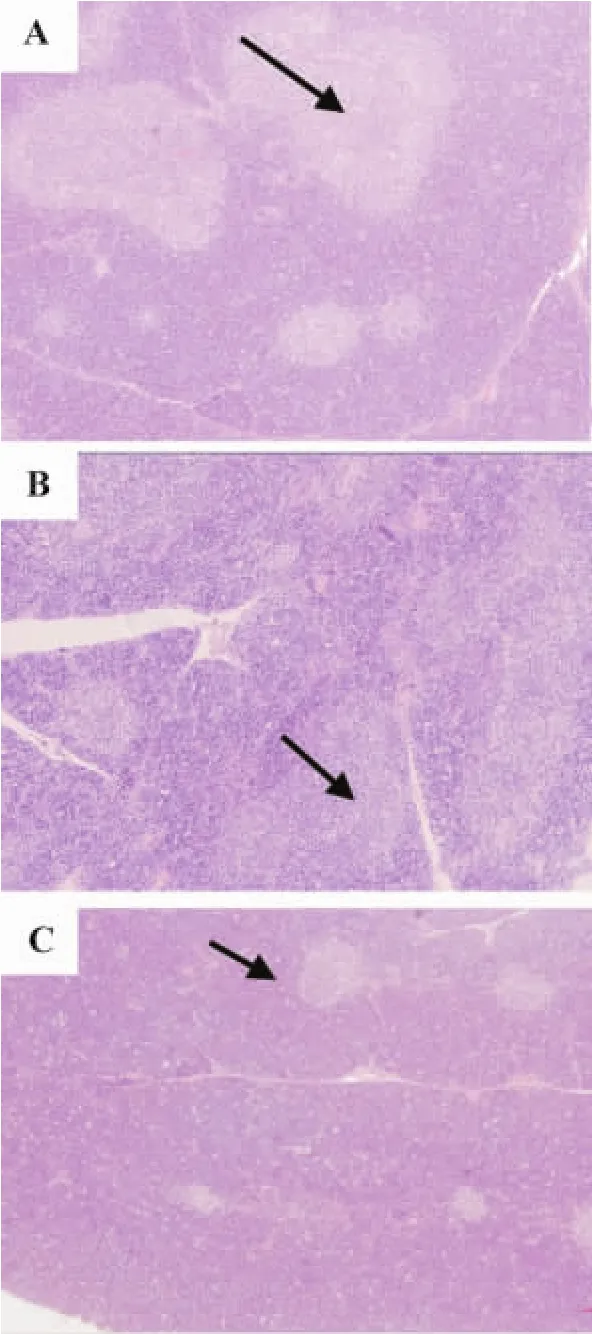
Fig.2 Effect of triptolide on histopathological changes in thymus of Wistar rats(HE×100).See Fig.1 for rat treatment except KLH administration.A:vehicle control group;B:triptolide 1.0 mg·kg-1group;C:cyclosporin A 20 mg·kg-1group.The area of thymus medulla was moderately reduced.
将环孢素A和雷公藤甲素组与对照组样本的基因表达谱进行比较分析,共筛选到11 862个基因。然后对这些基因进行非监督聚类分析,结果可见聚类的差异表达基因与时间具有较好的相关性,第7天和第14天的大鼠分别聚类在一起。使用差异基因分析软件分析发现,与对照组相比,在第7天雷公藤甲素0.5 mg·kg-1共引起14个基因表达下调,雷公藤甲素1.0 mg·kg-1则引起422个基因表达下调(表2),在第14天雷公藤甲素1.0 mg·kg-1仅引起23个差异表达基因。环孢素A 20 mg·kg-1在第7天共引起228个显著性差异表达基因(其中表达下调基因219个,上调基因9个),在第14天引起111个差异表达基因(其中表达下调基因108个,上调基因3个)。
2.4 差异表达基因功能及通路分析
1.5.1 芯片组织样本制备
她在回家的出租车上哭了。她有些莫名奇妙自己的眼泪。她的第一次,和一个男人,他们没有任何的恋爱程序而是直接上了床。这让她觉得有些微的耻辱,但也有些兴奋。她喜欢他,之前很朦胧,现在很确定。

Tab.2 Significant enrichment analysis of GO terms of the differentially expressed genes using the R language package software in triptolide 1.0 mg·kg-1group after 7 d treatment
此外,使用京都基因和基因组百科全书(kyoto encycloedia of genes and genomes,KEGG)数据库对雷公藤甲素1.0 mg·kg-1差异表达基因进行通路分析,结果发现,这些差异表达基因主要参与了移植排斥和自身免疫性疾病等一系列与免疫反应密切相关的信号通路。
对于使用过程中进行焊补、有表面裂纹觉得有必要进行埋藏性缺陷检测的部位,以及使用中出现焊接接头泄露的部位,需要采用超声、衍射时差法或射线等探伤方式进行埋藏性缺陷检测。
2.5 qRT-PCR验证相关基因的表达
qRT-PCR的结果显示,从雷公藤甲素1.0 mg·kg-1引起的7个代表性差异表达基因,其中Ghrh,Pcyox1l,V1ra14,Ryr2,Lass4和Inhbb 6个基因的表达差异趋势和芯片显示的结果基本一致(图3)。个别基因如Ghrh的变化倍数在两种检测方法中略有差异,可能是由于基因芯片和RT-PCR检测方法的灵敏度差异所致。
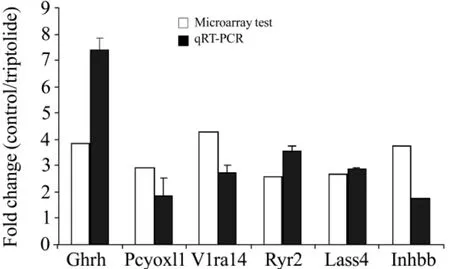
Fig.3 Effects of triptolide on gene expression of Ghrh,Pcyox11,V1ra14,Ryr2,Lass4 and Inhbb were validated by microarray test and qRT-PCR.Fold changes in gene expression levels between triptolide 1.0 mg·kg-1group and control group were compared between qRT-PCR and microarray.±s,n=3(qRT-PCR).Array data were calculated by SAM software.
3 讨论
本研究发现,雷公藤甲素能够引起大鼠产生明显的免疫抑制毒性,并引起胸腺基因表达谱发生改变,给药第7天的差异表达基因数量以及与免疫毒性的相关性明显高于第14天,提示免疫毒性相关基因的调控主要发生在药物毒性的早期阶段,这与国外文献[5-6]报道结果相一致。
将图1中6个水文站作为分析对象,计算在不同保证率P(20%,50%,75%,90%,95%)情况下降水量XP[2]。
此外,雷公藤甲素1.0 mg·kg-1免疫毒性差异基因表达的数量明显高于雷公藤甲素0.5 mg·kg-1,结合T细胞依赖抗体反应实验和组织病理学检查结果,也发现大鼠连续28 d ip给予雷公藤甲素1.0 mg·kg-1后出现较为明显的免疫抑制毒性反应,机体对外源性物质的免疫应答水平明显下降,胸腺皮髓质淋巴细胞数量轻度减少,而雷公藤甲素0.5 mg·kg-1抗体应答水平虽有一定的降低但并未出现组织病理学的改变。这表明雷公藤甲素引起的免疫毒性差异基因表达与剂量具有一定的相关性,和组织病理学检查结果也具有较好的一致性。欧盟框架计划6曾指出,毒理基因组学与组织病理学相结合是毒性分子机制研究的最有效工具[7],结合本研究结果,也证实了使用基因组学技术与组织病理学结合评价免疫毒性切实可行。
雷公藤甲素引起胸腺基因表达谱变化的绝大部分基因为下调基因,这些差异表达基因主要涉及细胞增殖、免疫反应、代谢调节和激素分泌等几个方面。其中细胞生长增殖相关基因变化最为显著,这些下调基因主要表现为抑制DNA转录、翻译、核小体装配、跨膜转运和干扰细胞周期等方面。结合近年来文献报道,有多项研究表明雷公藤甲素对多种淋巴细胞都有明显的抑制增殖的作用,如抑制植物血凝素等对淋巴细胞的非特异性刺激,抑制混合淋巴细胞反应中特异性抗原相关的淋巴细胞的增殖,阻止淋巴细胞由G1期进入S期,抑制T细胞的增殖等[8]。而雷公藤甲素1.0 mg·kg-1免疫毒性的组织病理学变化主要表现为胸腺皮髓质淋巴细胞数量轻度减少,基本与上述差异基因表达调控的结果一致,这表明抑制淋巴细胞的增殖可能是雷公藤甲素产生免疫毒性的主要机制。本研究发现,环孢素A引起的差异表达基因主要涉及免疫反应、免疫球蛋白分泌、T细胞增殖、B细胞增殖、细胞因子分泌和细胞周期调节等几个方面,基因的改变与文献报道的作用机制基本一致,这也在一定程度上证明本研究芯片结果的可靠性。此外,结合KEGG信号通路分析发现,本研究获得的差异表达基因主要在免疫相关反应过程如移植排斥和自身免疫性疾病发挥抑制作用,表明本研究获得的差异表达基因与雷公藤甲素的免疫系统毒性具有较好的相关性,这也与文献[9-10]的报道结果相一致。
综上所述,使用基因芯片技术研究雷公藤甲素的免疫毒性,结果显示基因表达谱的变化与T细胞依赖抗体反应检测和组织病理学检查结果具有较好的一致性,说明基因芯片技术在评价免疫毒性方面切实可行,同时也为阐明雷公藤甲素免疫毒性机制提供了基因水平上的数据支持。还需要对相关基因从核酸表达和蛋白表达水平上进一步验证,对现有基因进一步分析,同时使用更多的免疫毒性化合物研究免疫毒性相关基因表达谱的变化,阐释免疫毒性差异表达基因和免疫功能改变之间的相关性。
[1]Guo YH,Tan K.The review of triptolide's toxicity[J].J Chin Med Mater(中药材),2007,30(1):112-117.
[2]Zhu KJ,Shen QY,Cheng H,Mao XH,Lao LM,Hao GL.Triptolide affects the differentiation,maturation and function of human dendritic cells[J].Int Immunopharmacol,2005,5(9):1415-1426.
[3]Zhao M,Chen F,Wang C,Zhang Q,Gan J,Liu W.Integrative assessment of enantioselectivity in endocrine disruption and immunotoxicity of synthetic pyrethroids[J].Environ Pollut,2010,158(5):1968-1973.
[4]Lin Z,Li SS,Zhang D,Li B,Yang YW.Role and sig-nificance of thymus in pathological evaluation of immunotoxicity[J].Chin J New Drugs(中国新药杂志),2009,18(24):2309-2312.
[5]Baken KA,Pennings JL,de Vries A,Breit TM,van Steeg H,van Loveren H.Gene expression profiling of bis(tri-n-butyltin)oxide(TBTO)-induced immunotoxicity in mice and rats[J].J Immunotoxicol,2006,3(4):227-244.
[6]Ao K,Suzuki T,Murai H,Matsumoto M,Nagai H,Miyamoto Y,et al.Comparison of immunotoxicity among tetrachloro-,pentachloro-,tetrabromo-and pentabromo-dibenzo-p-dioxins in mice[J].Toxicology,2009,256(1-2):25-31.
[7]Suter L,Schroeder S,Meyer K,Gautier JC,Amberg A,Wendt M,et al.EU framework 6 project:predictive toxicology(PredTox)-overview and outcome[J].Toxicol Appl Pharmacol,2011,252(2):73-84.
[8]Luo YW,Shi C,Yuan Y,Zhang M,Liao MY.The research development of triptolide in toxiciolgy[J].J Toxicol(毒理学杂志),2009,23(1):74-77.
[9]Hochstenbach K,van Leeuwen DM,Gmuender H,Stølevik SB,Nygaard UC,Løvik M,Granum B,et al.Transcriptomic profile indicative of immunotoxic exposure:in vitro studies in peripheral blood mononuclear cells[J].Toxicol Sci,2010,118(1):19-30.
[10]Baken KA,Ezendam J,Gremmer ER,de Klerk A,Pennings JL,Matthee B,et al.Evaluation of immunomodulation by Lactobacillus casei Shirota:immune function,autoimmunity and gene expression[J].Int J Food Microbiol,2006,112(1):8-18.
Effect of triptolide on immunotoxicity-related gene expression in rats with microarray
GENG Xing-chao1,2,HONG Min2,SONG Ying3,LIN Zhi2,ZHANG Liang4,LI Bo2,WANG Jun-zhi2
(1.School of Pharmacy,the Fourth Military Medical University,Xi'an710032,China;2.National Center for Safety Evaluation of Drugs,National Institute for Food and Drug Control,Beijing100050,China;3.School of Pharmaceutical Science,Sun Yat-sen University,Guangzhou510006,China;4.BioChain Beijing Science-Technology Inc.,Beijing100176,China)
OBJECTIVETo explore the effect of triptolide on the gene expression profiles in rat thymus with microarray and to further investigate the molecular mechanism of its immnuosupression toxicity.METHODSWistar rats were ig given triptolide 0.5 and 1.0 mg·kg-1and cyclosporin A 20 mg·kg-1(positive control),once daily,for 28 d.T-cell-dependent antibody response assay,histopathology examination of immune organs and microarray test of thymus were performed respectively.RESULTSCompared with vehicle control group,T cell dependent anti-keyhole limpet hemocyanin(KLH)specific antibody response level significantly decreased in triptolide 0.5 and 1.0 mg·kg-1groups and ciclosporin A group.Histopathology examination showed that the number of lymphocytes in thymus cortex and medulla was slightly reduced in triptolide 1.0 mg·kg-1group and the area of thymus medulla was moderately reduced in cyclosporin A group.In microarray test,about 442 down-regulated genes were remarkably altered in triptolide 1.0 mg·kg-1group.The functions of these differentially expressed genes were associated with regulation of transcription,nuclear transport,tubulin complex assembly,nucleosome assembly,transcription from mitochondrial promoter,translation,amino acid transport,and mitochondrial DNA replication.KEGG pathway analysis results showed that these differentially expressed genes were mainly involved in transplant rejection and autoimmune disease.CONCLUSIONTriptolide 1.0 mg·kg-1can cause significant change in gene expression profiles in rat thymus,and its mechanism of immunotoxicity might be inhibition of the lymphocytes proliferation by down-regulating the expression of immunotoxicityrelated genes.
triptolide;thymus gland;immunity;toxic actions;gene expression profiling
The project supported by National Science and Technology Major Projects for″Major New Drugs Innovation and Development″(2008ZX09305-2);and Beijing Nova Program(2010B070)
WANG Jun-zhi,E-mail:wangjz@nicpbp.org.cn,Tel:(010)67095782
R992
A
1000-3002(2012)06-0870-06
10.3867/j.issn.1000-3002.2012.06.016
2011-10-18接受日期:2012-05-21)
(本文编辑:付良青)
