苦参碱体外诱导人结肠腺癌SW480细胞凋亡的实验研究
2011-09-12唐学敏焦河玲
唐学敏,焦河玲,朱 艳
(南阳理工学院张仲景国医学院,河南 南阳 473000)
苦参碱(MT)是中药苦参的主要有效成分,属于四环的喹诺里西啶类(quinolizidine),分子式为C15H24N2。大量的药理和临床研究发现,MT具有抗炎、抗病毒、抗纤维化、免疫调节等多种药理作用,并且其抗肿瘤的作用越来越得到重视。本文针对人结肠腺癌细胞SW480增殖及细胞凋亡方面的影响,探讨其对结直肠癌可能的作用机制。
1 材料与方法
1.1 药物、试剂及仪器
苦参碱(宁夏盐池制药厂,批号071101),注射用环磷酰胺(CTX,江苏恒瑞医药股份有限公司,批号09031521),小牛血清(杭州四季青生物工程材料有限公司),Hoechst-33258染色试剂盒,Annexin VFITC细胞凋亡检测试剂盒(碧云天生物技术研究所),TRIzol(Invitrogen 公司)、SYBR PrimeScript Real TimeRT-PCR kit(大连 TaKaRa生物工程公司),其他试剂均为国产分析纯。450型酶标仪、日本RICOH公司,倒置相差显微镜、日本 OLYMUPS公司,FACSCalibur流式细胞仪(美国 Becton Dickinson公司)。
1.2 细胞培养
人结肠腺癌细胞株SW480由中山大学细胞中心提供,使用含有体积分数为10%的胎牛血清的RPM I-1640培养液,在37℃和5%CO2实验条件下常规培养,于指数生长期用不同浓度的药物处理相应时间后进行检测。
1.3 MTT法检测 MT对SW480细胞增殖影响
取指数生长期的细胞加入96孔板中,每孔6000个细胞 180μl。细胞贴壁后加入不同浓度的 MT 20μl,使其终浓度分别为 0.01、0.05、0.10、0.20、0.40、0.80和1.6 0mg/ml,每个浓度设3个平行孔,同时设置空白对照组、溶剂对照组和调零孔。分别培养24 h、48 h,用 MTT法测490nm波长处吸光度(OD)值,并按下列公式计算细胞增殖抑制率:生长抑制率(%)=(1-用药组 OD值/对照组 OD值)×100%。按Bliss法求出半数抑制浓度(IC50值)。
1.4 光镜观察
将SW480细胞培养于玻片上,加入终浓度为0.35,0.70mg/mlMT以及不含药物的等体积 RPM I-1640培养液(对照组),分别培养24h和48h后光镜观察并拍照。
1.5 染色观察
以PBS洗上述各组细胞2次,70%乙醇4C固定 5min,PBS冲洗,Hoechst-33258染色 10min荧光显微镜观察并拍照。
1.6 流式细胞仪测定SW480细胞凋亡率
以 0.7mg·mL-1药物作用细胞 24h、48h 后,以0.25%胰蛋白酶消化细胞制成单个细胞悬液后调制细胞浓度至2×106·mL-1细胞,分别进行流式细胞仪检测凋亡率。
1.7 荧光实时定量PCR法检测 Caspase 3、Bcl-2的转录表达水平
表 1显示,以 0.7mg·mL-1药物作用细胞 24h、48h后,Trizol法提取各组的 Total RNA,按照反转录试剂盒(PrimeScriptTM RT reagent Kit,Takara)的操作说明书,将 mRNA逆转录为 cDNA。按照 QPCR试剂盒(SYBR Premix EX TaqTM,Takara)的操作说明书,QPCR检测 Caspase 3及 Bcl-2 mRNA的转录表达水平。看家基因β-actin作为内参,用相对定量方法(ΔΔCT)来计算分析各组 Caspase 3、Bcl-2的转录表达水平。
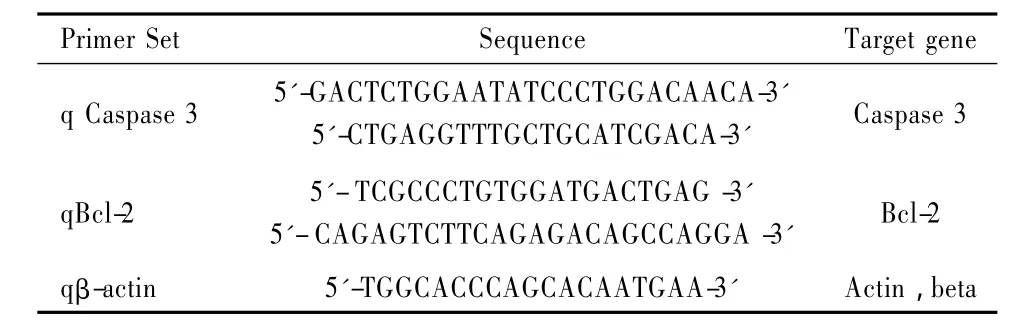
Table 1 Primer set used for real-time PCR
1.8 统计学处理
所有数据采用SPSS 13.0统计软件进行处理,实验数据用 珋x±s表示,多组间均数比较采用单因素方差分析,组间两两比较采用 LSD法,方差不齐的采用Tamhanes T2法。
2 结果
2.1 MTT法测定MT对SW480细胞增殖的影响
图1显示,MTT法检测不同浓度的苦参碱作用于人结肠腺癌SW480细胞不同时间,对细胞增殖的抑制作用如图1。结果表明,MT能显著抑制 SW480细胞的增殖,并有明显的剂量效应及时间效应关系。
2.2 光镜观察结果
图2显示,经0.35mg/mlMT作用48h后 SW480细胞细胞逐渐变为圆形,体积缩小,培养液中出现少量漂浮细胞,0.70mg/ml作用后上述改变更为明显,正常对照组细胞则未见明显改变。
2.3 MT对 SW480细胞凋亡的影响
图3显示,经 0.35,0.7mg/mlMT作用 48 h后凋亡细胞Hoechst-33258荧光染色较未凋亡细胞增强并出现核固缩。图4显示,经0.7 mg/mlMT作用后,24h组及48 h组第4象限即早期凋亡细胞数增多,凋亡率分别达22.08%和34.48%,并出现了晚期凋亡现象,空白对照组第1象限细胞数量则较多,细胞凋亡率低于6.0%。
2.4 MT对 SW480细胞 Caspase 3、Caspase 9及 Bcl-2表达的影响
图5A显示,SW480细胞经0.7mg/ml MT作用后,其 24h组及 48 h组 Caspase 3、Caspase 9 mRNA表达升高。图5B显示,Bcl-2表达则降低相对于对照组降低达41.08%,差异有统计学意义(P<0.05)。
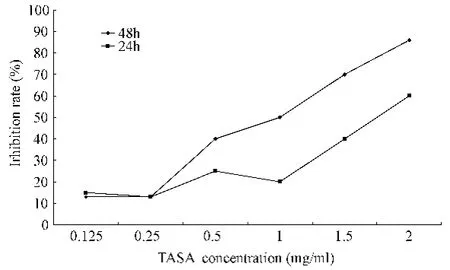
图1 对细胞增殖的抑制作用
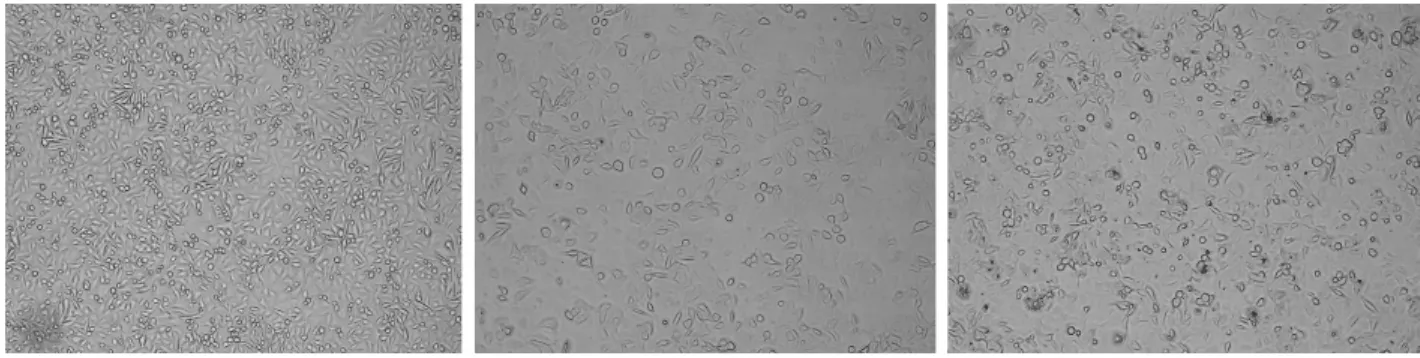
图2 光镜下各组SW480细胞A.Control group;B.MT group 24h;C.MT group 48h

图3 Hoechst-33258染色下各组SW480细胞A.MT group 48h;B.MT group 24h;C.Control group

图4 各组SW480细胞AnnexinⅤ-FITC检测结果A:Control group;B:MT group 24h;C:MT group 48h
4 讨论
大肠癌是全球发病率居第三位的常见肿瘤,其发病率一直呈上升趋势。目前,针对大肠癌的化疗方案主要是以5-Fu为主的综合化疗,其毒副反应大。中药以其独特的抗肿瘤疗效、不良反应少等特点,已引起世界各国科研工作者的关注。体外实验表明,苦参碱对多种肿瘤细胞有抑制或杀伤作用,对HepG2、K562、HL260有明显的抑制作用,并能诱导分化和凋亡[1]。Hua Jiang 等[2]人的研究表明,苦参碱可诱发细胞色素 C释放,激活 caspase-3和caspase-9,从而通过线粒体途径诱导 K562细胞凋亡。体内试验也表明[3],苦参碱不仅抑制人胃癌细胞株裸鼠移植瘤的生长,还能增强5-FU的抑瘤能力。苦参碱对SW620结肠腺癌细胞具有明显的诱导凋亡作用,是很有潜力的抗癌药物[4]。
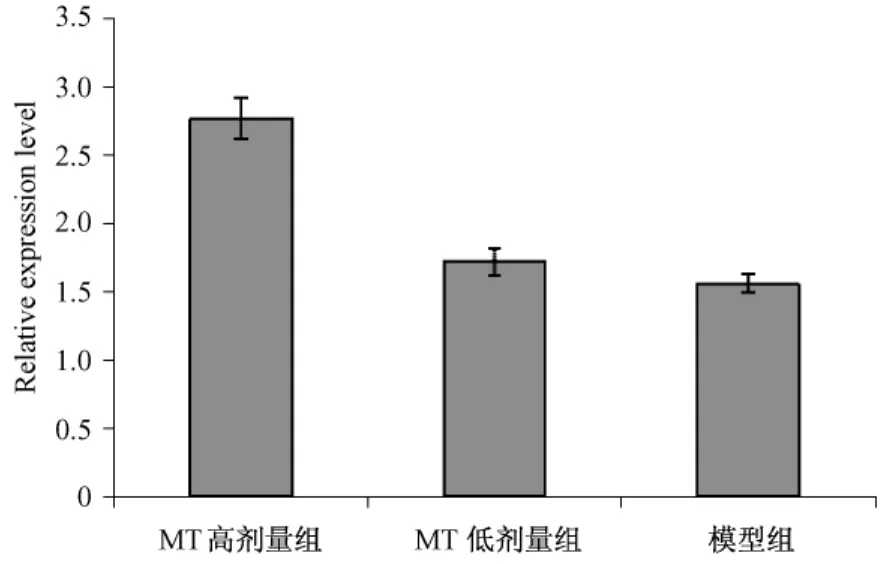
图5A Caspase 3mRNA荧光定量PCR相对定量,与对照组相比 P<0.05
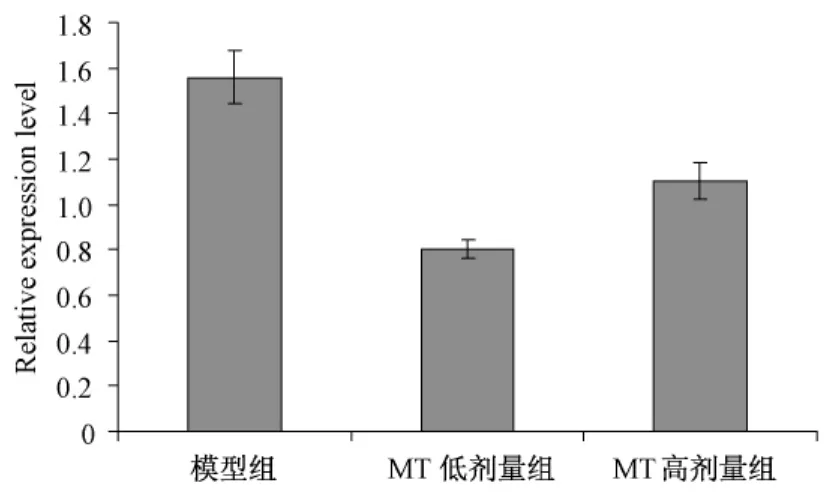
图5B Bcl-2 mRNA荧光定量PCR相对定量,与对照组相比 P<0.05图5 MT作用SW480后Caspase 3、Bcl-2 mRNA荧光定量PCR相对定量
本实验以MTT法测定MT对人结肠腺癌SW480细胞株的增殖抑制作用,确认其48 h增殖抑制活性IC50为0.7 mg/ml。众所周知,肿瘤细胞在增殖过程中受到多种因素影响,而诱导肿瘤细胞凋亡在肿瘤发生、发展及其治疗中起重要作用。人们在检测细胞凋亡的多种方法中,主要是根据凋亡细胞的形态特征、生化代谢及生物水平上发生的改变来进行分析。一般认为,形态学变化是判断凋亡的基础[5]。我们采用光学显微镜观察 MT对 SW480的影响,可见细胞核固缩、核碎裂、细胞膜起泡等形态。Hoechst-33258染色及流式细胞仪分析结果证明,MT可诱导SW480细胞凋亡,其凋亡现象显示时间依赖性增加。
国内外许多学者对肿瘤发生机制进行了深入的研究,发现许多凋亡基因的相关性,其中以 Caspase-3家族和 Bcl-2家族最为关注[6、7]。Caspase为半胱氨酸天门冬氨酸蛋白酶(cysteinyl aspartate specific proteinase)的简称,是一组具有相似氨基酸序列的半胱氨酸蛋白酶,它除了参与细胞因子成熟,细胞生长和分化之外,还与细胞凋亡紧密联系[8]。Caspase级联反应在凋亡通路中处于重要地位,尤其是Caspase-3是其中的中心环节,也是细胞凋亡的主要参与成分[9~11]。Bcl-2是一种新型的原癌基因,Bcl-2蛋白对不同因素引起的细胞凋亡均有抑制作用,在各种正常细胞的发育过程中表达,而在成熟或走向凋亡的细胞中不表达或低表达[12]。本实验结果显示,经0.7 mg/m MT作用 24、48h后 SW480细胞的Caspase-3 mRNA水平增高,Bcl-2 mRNA水平下降,说明 MT可通过影响凋亡基因 Bcl-2和 Caspase-3的表达使 SW480细胞凋亡,发挥其抗肿瘤作用。这可能是诱导细胞凋亡的重要机制之一。
大量实验研究证明,包括很多中药提取物在内的多种抗癌药物的抗癌作用涉及到多种基因及通路的相互影响,最终通过受表达的蛋白来实现[13]。我们将在今后更深入地探讨MT诱导结肠肿瘤细胞凋亡的分子机制,并进一步进行动物体内实验证实疗效,为开发和利用苦豆子资源提供实验依据。
[1]王铁军,李绍平,简家荣,等.苦参碱抗肿瘤作用研究进展[J].中国实验方剂学杂志,2004,10(4):52-5.
[2]Hua J,Chun HH,Shu BZ,et al. Matrine upregulates the cell cycle protein E2F-1 and triggers apoptosis via the mitochondrial pathway in K562 cells[J]. Eur J Pharmacol,2007,559:98-108.
[3]胡梅洁,曾 晖,章永平,等.苦参碱联合5-FU抑制人胃癌裸鼠移植瘤的生长作用及机制[J].广州中医药大学报,2006,23(2):164-7.
[4]王晓燕,梁 磊,邓虹珠,等.苦参碱体外诱导人结肠腺癌SW620细胞凋亡的实验研究[J].南方医科大学学报 ,2008,28(3):432-5.
[5]王嘉宁,郭 宁.细胞凋亡的检测技术与方法[J].中国药理学与毒理学杂志,2005,19(6):466-70.
[6]Giamarellos-Bourboulis EJ,Koussoulas V,Panagou C,et al.Experimentalsep sis using Pseudomonas aeruginosa:the significance of multi2drug resistance[J]. Int J Antimicrob Agents,2004,24(4):357-61.
[7]Lo MY,Kim HT.Chondrocyte apoptosis induced by hydrogen peroxiderequires caspase activation but not mitochondrial pore transition[J]. JOrthop Res,2004,22(5):1120-5.
[8]李雪松,荆国杰.亚低温对大鼠脑创伤后海马区凋亡相关蛋白表达的影响[J].中华神经外科疾病研究杂志,2005,4(1):31-33.
[9]Ohba H,Moriwaki S,Bakalova R,et al.Plant-derived abrin-ain duces apoptosis in cultured leukemic cell lines by different mechanismis[J]. Toxicol App l Pharmacol,2004,195(2):182-93.
[10]Way TD,Kao MC,Lina JK. Degradation of HER2/neu by apigenin induces apoptosis through cytochromecrelease and caspase-3 activation in HER2 /neu-over exp ressssing breast cancer cells[J]. FEBS Lett,2005,579(1):145-52.
[11]Woo DH,Han IS,Jung G.Mefenamic acid-induced apoptosis in human liver cancer cell-lines through Caspase pathway[J]. Life Sci,2004,75(20):2439-49.
[12]Petit A,Mwale F,Zukor D J,et al. Effect of cobalt and chromium ions on bcl-2, bax, caspase-3, and caspase-8 expression in human U937 macraophages[J]. Biomarials,2004,25(11):2013-8.
[13]Deng R,Zhu X F,Zhou JM,et al. Apoptosis induced by Excisanin A in human colon cancerSW620 cellsand its mechanisms[J].Chin Pharmacol Bull,2006,22(3):273-7.
