荧光光谱法研究左氧氟沙星与酪蛋白的相互作用Δ
2011-08-07张青徐群为黄长高都述虎南京医科大学药学院南京市210029
张青,徐群为,黄长高,都述虎(南京医科大学药学院,南京市210029)
左氧氟沙星(LOFL)为氧氟沙星的左旋活性异构体,属第3代氟喹诺酮类广谱抗菌药物,通过抑制细菌DNA回旋酶,对大多数革兰阳性菌和革兰阴性菌均有显著的杀菌作用,对非典型病原体也有较好的抗菌作用[1]。目前,LOFL递药系统主要有普通注射剂、滴眼剂、片剂和胶囊剂,但这些剂型的缺陷是药物进入体内后消除较快,而缓释制剂比普通制剂能更长时间维持LOFL的有效浓度,所以很多学者在研究LOFL的缓释剂型[2,3]。
酪蛋白(Cas)是主要从牛奶中提取的一种混合蛋白质,根据编码基因不同,分为αs1、αs2、β、κ 4种组分[4],其质量比为4∶1∶4∶1,平均等电点为4.8,已经广泛地应用于食品、化妆品的处方中[5],具有高乳化性、稳定性、胶凝性及生物相容性[6]。因为Cas具有亲水和亲脂的氨基酸残基,所以在溶液中能自发组装成胶束[7],并且其可以与戊二醛发生交联,形成生物可降解的、具有缓控释能力的微球[8]。以Cas为载体材料制备的药物传输系统,不仅具有生物可降解性,而且具有药物缓控释能力,有良好的研究前景[8,9]。
本文通过荧光光谱技术,研究LOFL与Cas的相互作用,推断其作用机制,计算得到结合常数和相关热力学参数。本研究可为制备以Cas为载体材料的LOFL递药系统提供缓释机制、药物载体比例、稳定性等方面的理论基础。
1 仪器与试药
1.1 仪器
F4600型荧光光度计(日本Hitachi公司);Delta 320-S pH计(瑞士Mettler-Toledo公司);AY220型电子天平(日本Shimadzu公司);DK-S24型电热恒温水浴锅(上海精宏实验设备有限公司);PURELABTMCLASSIC超纯水机(德国Pall公司)。
1.2 试药
LOFL(乳酸盐,上海三维制药有限公司,批号:200510124,纯度:99%);Cas(酪蛋白酸钠,百灵威科技有限公司,批号:C0594,纯度:90%);所有样品溶液均用氯化钠溶液调节离子强度为0.1 mol·L-1;试剂均为分析纯,试验用水为超纯水。
2 方法
2.1 荧光光谱的研究
为了考察研究对象的荧光发射光谱是否相互干扰,记录了各单一组分的荧光发射光谱。在缓冲液(三羟甲基氨基甲烷-盐酸,Tris-HCl)中160 W功率下超声10 min,溶解Cas,制备成2 g·L-1的贮备液;LOFL在缓冲液中制备成1.0×10-4mol·L-1的贮备液,均置于冰箱中1~4℃保存。取Cas贮备液1 mL和LOFL贮备液0.5 mL,分别置于10 mL容量瓶中,用缓冲液定容,摇匀,扫描荧光光谱。预试验测得LOFL和Cas的激发/发射波长分别为285/461 nm和278/340 nm。设定激发波长为285 nm,扫描发射波长范围295~700 nm,扫描速度为1200 nm·min-1,激发和发射光狭缝宽度分别为10 nm和5 nm,光电倍增管(PMT)电压为400 V,记录0.2 g·L-1的Cas溶液、5×10-5mol·L-1的LOFL溶液和缓冲液的荧光光谱。
2.2 荧光猝灭试验
荧光猝灭试验可以推断分子间相互作用的机制,计算相互作用的热力学参数以及分子结合位点数[10~12]。在编号为0~8号的10 mL的容量瓶中,均加入1.0 mL的Cas贮备液,然后分别加入0、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL的LOFL贮备液,用pH7.4的缓冲液稀释至刻度,混合均匀,于恒温水浴锅中保温1 h,得到0~8号样品。其中Cas浓度均为0.2 g·L-1,LOFL浓度分别为0、0.2×10-5、0.3×10-5、0.4×10-5、0.5×10-5、0.6×10-5、0.7×10-5、0.8×10-5、0.9×10-5mol·L-1。分别在25℃和30℃2种温度下记录各样品的荧光光谱。从荧光光谱中可以得到在不含或含不同浓度的LOFL情况下,Cas在最大发射波长处的荧光强度。
荧光猝灭的机制分为动态猝灭和静态猝灭。动态猝灭是荧光分子在扩散中遭遇猝灭剂而发生的碰撞猝灭;静态猝灭是荧光分子与猝灭剂之间形成了基态复合物引起的荧光猝灭[12]。如果猝灭机制是动态猝灭,荧光猝灭过程遵循Stern-Volmer方程[13],见方程(1):

式中,F0和F分别代表不存在和存在猝灭剂时最大发射波长处的荧光强度;kq为生物分子猝灭速率常数;τ0是无猝灭剂存在时荧光体的荧光寿命,对于生物大分子而言,τ0=10-8s;[Q]为猝灭剂浓度;Ksv是Stern-Volmer猝灭常数。
对于静态猝灭,可用Lineweaver-Burk双倒数函数关系式拟合:

式中,KLB是静态猝灭结合常数[13]。
对于静态猝灭,荧光强度与猝灭剂浓度间存在方程(3)所描述的关系,可以用来确定结合位点数和结合常数[10]。

式中,Kb为结合常数,n为结合位点数。
3 结果与分析
3.1 荧光光谱
分别对0.2 g·L-1的Cas溶液、0.5×10-5mol·L-1的LOFL溶液、缓冲液在285 nm波长处激发,记录发射光谱。结果发现,Cas的最大发射波长在340 nm处;LOFL的最大发射波长为461 nm;而缓冲液和LOFL溶液在340 nm波长处几乎未见发射荧光峰,所以不会对Cas溶液产生的荧光造成干扰,见图1。
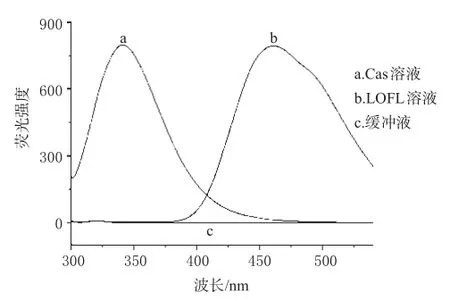
图1 3种溶液的荧光光谱Fig 1Fluorescence spectra of 3 kinds of solutions
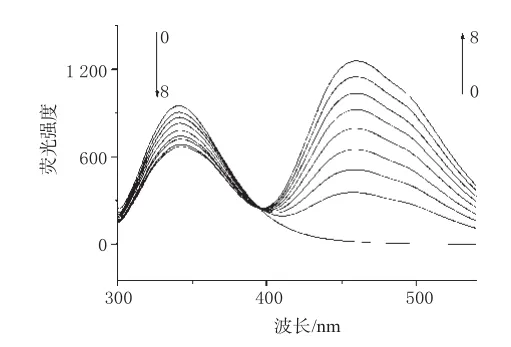
图2 LOFL对Cas的荧光猝灭光谱Fig 2Effect of LOFL on fluorescence spectra of Cas
3.2 LOFL对Cas的荧光猝灭作用
蛋白质是荧光体,内源性荧光主要来自于色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)等氨基酸残基,在280 nm波长附近激发,其荧光峰分别位于348、303、282 nm波长处,强度比为Trp∶Tyr∶Phe=100∶9∶0.5[10,11]。Cas的最大发射波长在340 nm处,所以可以判断Cas的荧光主要来自于Trp残基。与荧光物质相互作用导致荧光强度下降或者能使荧光量子产率降低的物质称为荧光猝灭剂,LOFL对Cas的荧光猝灭光谱详见图2(图中0→8指依次为0~8号样品)。
由图2可以发现,LOFL是Cas的荧光猝灭剂。固定Cas浓度,不断提高混合溶液中LOFL的浓度,结果Cas的荧光有规律地猝灭。对于LOFL,随着其浓度升高,在461 nm波长处的荧光强度逐渐增强,在394.8 nm波长处出现了1个等强度发射点,提示药物与蛋白之间形成了稳定的复合物。
3.3 猝灭机制的推断和相关热力学参数的计算
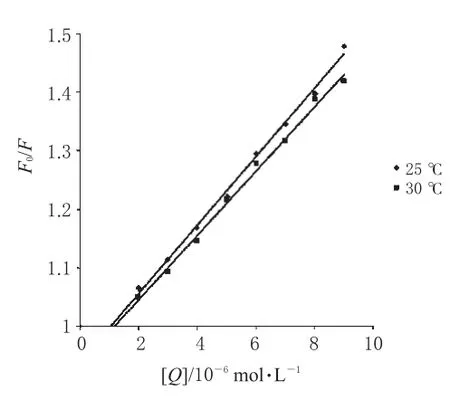
图3 2种温度下LOFL与Cas相互作用的Stern-Volmer曲线Fig 3Stern-Volmer plots for the interaction between LOFL and Cas at 2 kinds of temperatures
对于动态猝灭而言,由于猝灭剂对生物大分子的最大扩散控制的碰撞猝灭速率常数为2.0×1010L·mol-1·s-1,如果计算出的kq值小于2.0×1010L·mol-1·s-1,表明该猝灭过程是分子扩散和碰撞引起的动态猝灭。如果计算出的kq值远大于2.0×1010L·mol-1·s-1,则表明该猝灭过程是分子之间形成了基态复合物引起的静态猝灭。另外,温度对Ksv值的影响也可以帮助区分动态和静态猝灭。动态猝灭过程中,当温度升高,分子间碰撞加剧,Ksv值变大;静态猝灭过程中,温度升高,基态复合物稳定性下降,Ksv值变小[12]。为了推测荧光猝灭机制,分别在25℃和30℃2个温度下测定荧光猝灭情况,从荧光光谱中可以得到F0和F值,以F0/F对[Q]作图,得到图3。根据图3中的曲线,应用Stern-Volmer方程拟合的参数见表1。
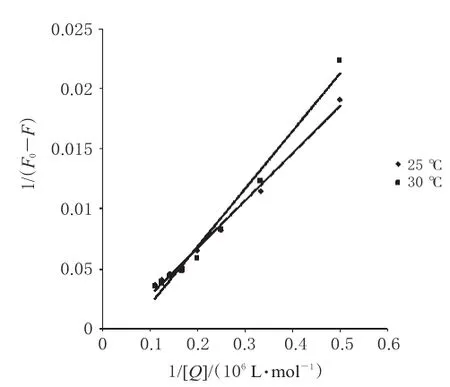
图4 2种温度下LOFL与Cas相互作用的Lineweaver-Burk曲线Fig 4Lineweaver-Burk quenching plots for the interaction between LOFL and Cas at 2 kinds of temperatures

表1 LOFL与Cas相互作用的Stern-Volmer常数和曲线拟合方程Tab 1Stern-Volmer quenching constants and curves fitted equation of interaction between LOFLand Cas
从表1中发现,计算得到的kq值远大于2.0×10-10L·mol-1·s-1,所以可推断猝灭过程是静态猝灭;进一步发现随着温度升高,Ksv值变小,这一结果也证明了猝灭过程是静态猝灭而不是动态猝灭过程。
所以采用静态猝灭模型对数据进行拟合。根据方程(2)对25℃和30℃2种温度下的荧光猝灭数据进行分析,拟合曲线见图4。
从图4中发现曲线的线性关系良好,从斜率可以计算得到相应温度下的KLB值,KLB近似于热力学结合常数K[13]。结合KLB值与相关热力学公式(4)、(5),可以计算得到相关热力学参数,见表2。

式中,ΔG为自由能,ΔH为标准焓,ΔS为标准熵,R为气体常数,T为绝对温度。

表2 LOFL与Cas相互作用的Lineweaver-Burk猝灭常数、曲线拟合方程和相关热力学参数Tab 2Lineweaver-Burk quenching constant KLB,curves fitted equation and the relative thermodynamic parameters of the interaction between LOFLand Cas
从表2中可以发现,KLB值随着温度的升高而变小,与KSV值随温度的变化是一致的,说明温度升高后降低了LOFL与Cas之间的相互作用。蛋白质与小分子之间的非共价键相互作用包括4种类型,分别是范德华力、氢键、疏水作用和静电作用[14]。ΔG、ΔH和ΔS能够反映相互作用模式。当温度变化较小时,ΔH可以看作是常数,ΔH是负值显示反应是放热过程;ΔG为负值表示反应是自发过程。对于典型的疏水作用,ΔH和ΔS都是正值;当焓变和熵变都是负值表示主要存在范德华力以及形成了氢键[15]。测得LOFL与Cas结合的ΔH和ΔS分别为-39.85 kJ·mol-1和-48.54 J·mol-1·K-1,所以推断LOFL与Cas之间的相互作用主要是范德华力和氢键。
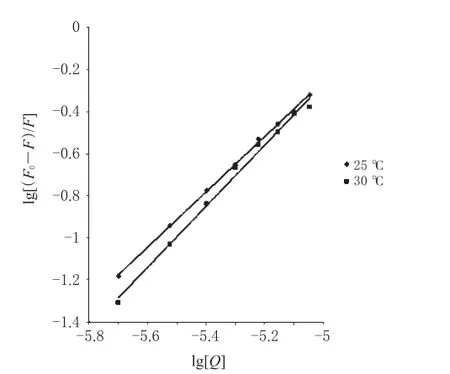
图5 2种温度下lg[(F0-F)/F]-lg[Q]关系曲线Fig 5Plots of the interaction between lg[(F0-F)/F]and lg[Q]at 2 kinds of temperatures
3.4 结合位点数确定
将25℃和30℃2种温度下测定的荧光猝灭数据用公式(3)拟合,得到图5。
从图5中直线的斜率可以得到结合位点数。计算得到平均结合位点数n=1.38,即LOFL与Cas分子以接近1∶1的比例发生相互作用。
4 讨论
对LOFL与Cas存在相互作用的研究,对制备药物传输系统有一定帮助。例如载体和药物的作用位点数,可以指导确定药物和载体的比例,以优化载药量和包封率。载体和药物存在相互作用,可以提高药物的稳定性,而且大幅提高药物的缓释性能[16,17];另外相互作用类型可以为设计刺激敏感型药物传输系统提供理论指导[18]。
本文利用荧光光谱研究了LOFL与Cas之间的相互作用。发现LOFL对Cas的内源性荧光具有猝灭作用。根据荧光猝灭数据推断猝灭机制属于静态猝灭而不是动态猝灭。计算了不同温度下的静态荧光猝灭结合常数,结合热力学方程,计算得到相关热力学参数。结果提示二者的相互作用是以氢键和范德华力为主,二者以接近1∶1的比例发生相互作用。
[1]孙曼春,方世平,王智勇,等.盐酸左氧氟沙星在健康人体内的药代动力学研究[J].中国药业,2010,13(3):5.
[2]裴志强,尹莉芳,周建平.中心复合设计法优化盐酸左氧氟沙星缓释片处方[J].药学进展,2007,31(11):508.
[3]刘金虹,关宗.左氧氟沙星剂型的研制[J].天津药学,2006,18(3):57.
[4]Wal JM.Structure and function of milk allergens[J].Allergy,2001,56(Suppl 67):35.
[5]Yan L,Rong G.Interaction between casein and sodium dodecyl sulfate[J].J Colloid Interface Sci,2007,315(2):685.
[6]梁琪.酪蛋白酸钠功能性的研究[J].食品科学,2002,23(3):30.
[7]Narambuena CF,Ausar FS,Bianco ID,et al.Aggregation of casein micelles by interactions with chitosans:a study by Monte Carlo simulations[J].J Agric Food Chem,2005,53(2):459.
[8]Latha MS,Lal AV,Kumary TV,et al.Progesterone release from glutaraldehyde cross-linked casein microspheres:in vitro studies and in vivo response in rabbits[J].Contraception,2000,61(5):329.
[9]Shapira A,Markman G,Assaraf YG,et al.Beta-caseinbased nanovehicles for oral delivery of chemotherapeutic drugs:drug-protein interactions and mitoxantrone loading capacity[J].Nanomedicine,2010,6(4):547.
[10]王公轲,闫长领,卢秀敏,等.盐酸环丙沙星与胰蛋白酶相互作用的光谱和分子模拟研究[J].化学学报,2009,67(17):1967.
[11]尹燕霞,向本琼,佟丽.荧光光谱法在蛋白质研究中的应用[J].实验技术与管理,2010,27(2):33.
[12]Teng W,Bingren X,Ying W,et al.Spectroscopic investigation on the binding of bioactive pyridazinone derivative to human serum albumin and molecular modeling[J].Colloids Surf B Biointerfaces,2008,65(1):113.
[13]颜承农,童金强,熊丹,等.荧光光谱法研究培氟沙星与牛血清白蛋白结合反应特征[J].分析化学,2006,34(6):796.
[14]Leckband D.Measuring the forces that control protein interactions[J].Annu Rev Biophys Biomol Struct,2000,29:1.
[15]Ross PD,Subramanian S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096.
[16]夏盛杰,倪哲明,于尚琴,等.卡托普利插层锌铝水滑石的超分子结构、热稳定性及缓释性能研究[J].无机化学学报,2007,23(10):1747.
[17]曹根庭,邢方方,王平,等.药物-无机复合材料姜黄素嵌入镁铝水滑石的合成、表征及缓释性能的研究[J].无机化学学报,2008,24(6):956.
[18]Chunyan W,Alireza J,Mehdi G,et al.A pH-sensitive molecularly imprinted nanospheres/hydrogel composite as a coating for implantable biosensors[J].Biomaterials,2010,31(18):4944.
