类风湿关节炎大鼠模型的相关细胞因子研究
2011-03-12刘英娜覃仕化杨俊生冷冬妮杜秀銮
李 颖,刘英娜,覃仕化,杨俊生,冷冬妮,王 珺,杜秀銮,汪 悦
类风湿性关节炎(rheumatic arthritis,RA)是一种临床常见的疾病,是一种不明原因的慢性炎性多系统性自身免疫性疾病,RA 患者的关节囊和关节周围韧带组织的挛缩、变形是影响RA 患者关节置换后功能康复的重要原因[1]。本研究通过牛Ⅱ型胶原(CⅡ)诱导的大鼠关节炎模型的韧带及关节囊组织的病理观察和相关细胞因子的研究,探讨大鼠类风湿性关节炎动物模型(CIA)中的韧带组织的浸润机制及不同时期的肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素-2(interleukin-2,IL-2)的变化趋势。
1 材料与方法
1.1 材料 Wister 大鼠90 只(上海斯莱克公司提供),体重180 ~220 g,8 周龄左右,雌雄各半,常规条件饲养。随机分成三组:正常组、CIA 组、加强CIA 组各30 只。
1.2 配置CⅡ乳剂 用0.1 ml/L 的冰醋酸先溶解CⅡ,浓度为4 mg/ml,放置4℃冰箱过夜,与弗氏完全佐剂(上海sigma 医学试剂有限公司)等体积混合,震荡乳化制成CⅡ乳剂,置于4℃冰箱保存。
1.3 造模 将配置好的CⅡ乳剂以0.1 ml/只的剂量注射于大鼠的左足底,加强CIA 组于1 周后原部位再次注射同样剂量CⅡ乳剂。
1.4 取材 分别于最后一次注射后的第10 天、20天、30 天,分三次处死大鼠,取踝关节的韧带和关节囊组织,将所取组织分成两份,分别行组织匀浆和病理检查。
1.5 组织匀浆的方法 取新鲜组织洗净擦拭干净后立即放入-70℃冰箱中冷冻保存,以备匀浆。匀浆方法如下:称取一定量的组织,以生理盐水(生理盐水的体积总量为组织块重量的9 倍)混合,倒入匀浆管中充分研碎,使组织匀浆化后,于4℃,3000 r/min 离心10 ~15 min,吸取上清液装入EP 管,放入-70℃冰箱冷冻保存,待检。
1.6 病理检查 取组织标本,以4%中性甲醛固定,常规检查。
1.7 检测 对于1.5 步骤所取组织匀浆液,分别用ELISA(上海韵涵生物科技有限公司)试剂盒检测IL-2 和TNF-α 水平。
1.8 统计学处理 检测数据采用SPSS 13.0 软件分析处理,计量资料采用均数±标准差)表示,组间比较采用成组t 检验,P <0.05 为差异有统计学意义。
2 结 果
2.1 光镜下观察 CIA 模型大鼠的韧带组织病理切片中可见大片炎性渗出及坏死、肉芽组织形成、周围血管扩张、充血、大量淋巴细胞、中性粒细胞及浆细胞浸润。加强组的血管扩张及淋巴细胞浸润程度较未加强组高,可见淋巴滤泡与纤维素渗出、胶原纤维沉着及纤维素样坏死。见图1 ~3。
2.2 大鼠踝关节组织匀浆IL-2 与TNFL-α 检测结果 CIA 组与加强CIA 组的同期IL-2 及TNF-α 浓度均显著高于正常组,差异具有统计学意义(P <0.05),其中尤以加强CIA 组的表达最高。CIA 组与加强CIA 组中期的IL-2 与TNF-α 的浓度也显著分别高于同组的早、晚期,差异也均有统计学意义(P<0.05)。见表1。

图1 CIA 组:关节滑膜组织较多淋巴细胞、浆细胞浸润(HE ×40)

图2 加强CIA 组:较多淋巴细胞浸润并见淋巴滤泡形成(HE ×40)
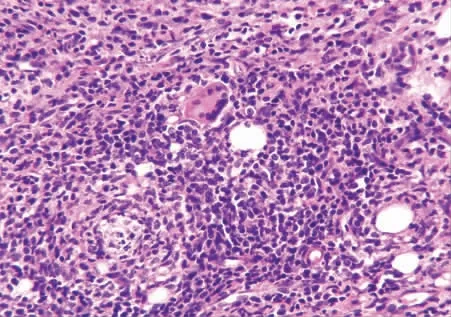
图3 加强CIA 组:肉芽组织形成伴组织细胞增生、多核巨细胞反应(HE ×40)
表1 大鼠踝关节组织匀浆IL-2 与TNF-α 浓度检测结果(ng/L,n=10)

表1 大鼠踝关节组织匀浆IL-2 与TNF-α 浓度检测结果(ng/L,n=10)
注:与正常组同期比较,*P <0.05;与本组早、晚期比较,△P <0.05
IL-2TNF-α时间正常组 CIA 组 加强CIA组 正常组 CIA 组 加强CIA组早期 646.2±50.7 772.0±45.9* 961.6±50.2* 115.02±3.49 159.69±7.09 195.32±5.73*中期 584.8±25.8 890.8±53.2*△ 1110.8±56.2*△ 123.44±3.52 210.47±1.33△ 216.10±2.62*△晚期 644.0±24.8 802.2±71.8* 1015.8±54.7* 126.48±1.52 173.98±4.95 200.40±2.64*
3 讨 论
RA 是一种不明原因的慢性炎性多系统性自身免疫性疾病,病变的特征是持续性进行性的滑膜炎,通常累及对称的周围关节[2]。滑膜炎能引起软骨破坏,继而引起关节畸形而成为该病的标志[3]。RA患者的关节囊和关节周围韧带组织的挛缩、变形是RA 患者关节畸形、功能障碍的重要原因之一[4]。现代关节外科的技术日渐成熟,RA 对于滑膜和骨组织的破坏,使用外科技术可以获得满意的纠治,但是韧带和关节囊组织的挛缩变形仍是影响关节置换术后的患者功能康复的重要因素之一[5]。RA 患者的自然病情迁延较长,很难观察到完整的关节囊及韧带组织病变的过程。研究证实[6],RA 患者血清及滑膜液中存在抗胶原抗体,这种对胶原组织的自身免疫反应,可以解释其具有的系统性和慢性持续性发展的特点。CIA 的病理改变表现为关节滑膜的T 细胞、B 细胞的增生、浸润,能够较好的反映RA 的韧带及关节囊的浸润机制,是研究治疗RA 的较理想的模型。
研究表明:RA 患者病理切片亦证实了其韧带与关节囊的浸润过程与血管扩张后的慢性炎性浸润相关。TNF-α 作为一个公认的炎性因子[7],广泛的作用于炎性浸润的各个过程,在炎性反应的局部组织中有较高的表达,在RA 患者滑膜液中其表达也较高。TNF-α 在RA 病变中的主要作用[8]:①为强有力的骨吸收刺激剂,其作用是PG 依赖性的,并可抑制骨胶原合成。②刺激成纤维细胞增殖,刺激成纤维细胞和软骨细胞产生PGE2和胶原酶,刺激软骨细胞分泌金属蛋白酶,促进软骨破坏。③升高纤维蛋白溶酶激活剂的浓度。④增加滑膜内皮细胞合成纤维细胞生长因子的释放,促进新血管的形成,这是血管翳增生的一个重要的早期特征。⑤调节其他细胞因子如IL-1、IL-6、IL-8、GM-CSF(粒细胞-巨噬细胞集落刺激因子)的产生。IL-2 作为T 淋巴细胞活性的标志性因子,反映了T 淋巴细胞的功能水平,具有免疫增强和免疫调节作用,在RA 发病急性期IL-2 水平增高,促进炎症发展。
本研究重点关注RA 的韧带及关节囊组织的病变过程,CIA 模型大鼠的韧带及关节组织的病理变化反映了这种变化趋势,组织匀浆中的TNF-α 和IL-2 的水平变化也验证以上结论。实验中发现CIA组与加强CIA 组在20 d 左右的细胞因子水平最高,随后则显现出CIA 模型大鼠炎性过程的自限性趋势。有文献指出TNF-α 和IL-2 的表达水平波动幅度较大,我们考虑这可能与实验方法的不同、免疫剂量的不同、注射及加强方法的差异、组织取材的时间以及检测试剂盒选择不同有关。CIA 造模的标准实验方法,有待在大样本量的实验基础上统一。CIA大鼠的病理切片主要的形态特点是炎性细胞的弥漫性浸润,与人的病理切片显示炎细胞浸润主要是以血管扩张,围绕血管为中心的炎性浸润方式有一定的区别,这种区别主要因发病机制不同而异,对于炎性转归有无影响有待进一步的研究。
[1] 曾 伟,魏艳珍,高 曦,等.软组织平衡在膝外翻畸形全膝关节置换中的意义[J].中华损伤与修复杂志,2009,4(2):212-215.
[2] 胥少汀,葛宝丰,徐印坎.实用骨科学[M].3 版.北京:人民军医出版社,2008:1309.
[3] 成 锋,王昌兴,王伟东.类风湿性关节炎滑膜新生血管形成及抑制机制[J].医学综述,2009,15(15):2291-2294.
[4] 王维军,牛东生.重症类风湿性关节炎膝关节屈曲挛缩畸形全膝关节置换术的软组织平衡[J].中国修复重建外科杂志,2008,22(10):1173-1176.
[5] 骆宇春,刘云鹏,张 焱,等.258 例人工全膝关节置换术临床疗效分析[J].东南国防医药,2010,12(6):493-496.
[6] 缪 怡,徐雪亮,黄秋愉,等.类风湿性关节炎患者抗胶原蛋白Ⅱ抗体及其自身反应性T 淋巴细胞的检测[J].诊断学理论与实践,2010,9(4):316-319.
[7] 李巧霞,丛 斌,单保恩.T 细胞与类风湿性关节炎[J].国际免疫学杂志,2011,34(1):1-4.
[8] 汤其岭.类风湿性关节炎患者血清NO、NOS、TNF-α 水平的变化及意义[J].放射免疫学杂志,2008,21(2):113-114.
