饲料中添加枯草芽孢杆菌(CGMCC No.3755)对凡纳滨对虾生长性能和非特异性免疫力的影响
2011-03-09王玲张春晓孙鸣温俊
王玲 张春晓 孙鸣 温俊
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,是我国养殖量最大,产业化程度最高的养殖对虾品种。然而在集约化养殖过程中,由于密度高、水质交换差以及环境因素不稳定导致对虾生长慢且病害频发。为提高生长速度、防治病害,各种化学药物广泛应用,由此引发社会对养殖对虾食品安全的忧虑,因此亟需研发能替代化学药品且绿色安全的添加剂。
益生菌在水产养殖上的应用已越来越受到广大水产养殖业者的关注。已有研究报道,益生菌可显著增强水产动物消化道消化酶活力,提高对饲料的表观消化率,同时还可降低养殖环境中的氨氮、亚硝酸盐和硫化氢等有害物质,从而优化养殖生态环境,提高了养殖生物的成活率、生长速率和抗病能力[1]。并且益生菌具备对水产动物无毒害、对食品安全无威胁、对环境无污染等特点,是一类高效的绿色饲料添加剂。
目前,水产养殖业中常用的饲用益生菌主要有光合细菌、芽孢杆菌(枯草芽孢杆菌和地衣芽孢杆菌)[2-3]、酵母菌[4](Surawicz等,1989)和乳酸菌(嗜酸乳酸菌和双歧杆菌)[5-6]。其中,枯草芽孢杆菌可以以内孢子的形式存在,对高温、高压、氧化等不良环境的抵抗力很强,能够耐受水产饲料的加工条件,并且可耐受胃中的强酸性环境,其在肠道繁殖时分泌的大量蛋白酶及其他酶类能降解营养物质,有助于宿主对营养物质的吸收利用[7-8]。丁贤等(2004)研究发现,向饲料中添加芽孢杆菌可以显著提高凡纳滨对虾消化道蛋白酶和淀粉酶活力,并可提高对虾的生长性能[1]。Lin等(2004)发现,芽孢杆菌可以提高凡纳滨对虾对饲料的消化率[9]。Rengpipat等(2000)研究发现,斑节对虾摄食含芽孢杆菌(S11)的饲料后,其免疫力和抗病力显著提高[10]。本试验的目的是通过向高鱼粉和低鱼粉饲料中添加不同水平的枯草芽孢杆菌(B.S.3755)以评估其对凡纳滨对虾生长性能和非特异性免疫力的影响,为枯草芽孢杆菌(B.S.3755)在凡纳滨对虾饲料中的应用提供参考依据。
1 材料和方法
1.1 实验饲料
以鱼粉、豆粕和菜籽粕为主要蛋白源,鱼油和豆油为脂肪源,小麦面粉为主要糖源,并补充无机盐、维生素等配制出基础饲料。向基础饲料中分别添加0、600和1200 mg/kg的枯草芽孢杆菌(B.S.3755;该菌种由北京都润科技有限公司提供,枯草芽孢杆菌含菌量为2.0×109cfu/g),另外,以植物蛋白替代基础饲料中3.5%的鱼粉蛋白配制低鱼粉饲料,并向饲料中分别添加600和1200 mg/kg的B.S.3755,共配制成5种等氮、等能的实验饲料(见表1),进行摄食生长实验。
各种实验饲料原料经粉碎,过80目筛网,按配比称量后混合均匀,然后加入适量的水揉匀,经双螺杆制粒机(CD4×1TS多功能催化剂成型机)加工成1.5×2.0 mm的颗粒状饲料,并于80℃烘干至饲料水分含量为10%左右,于-20℃冰箱保存,备用。
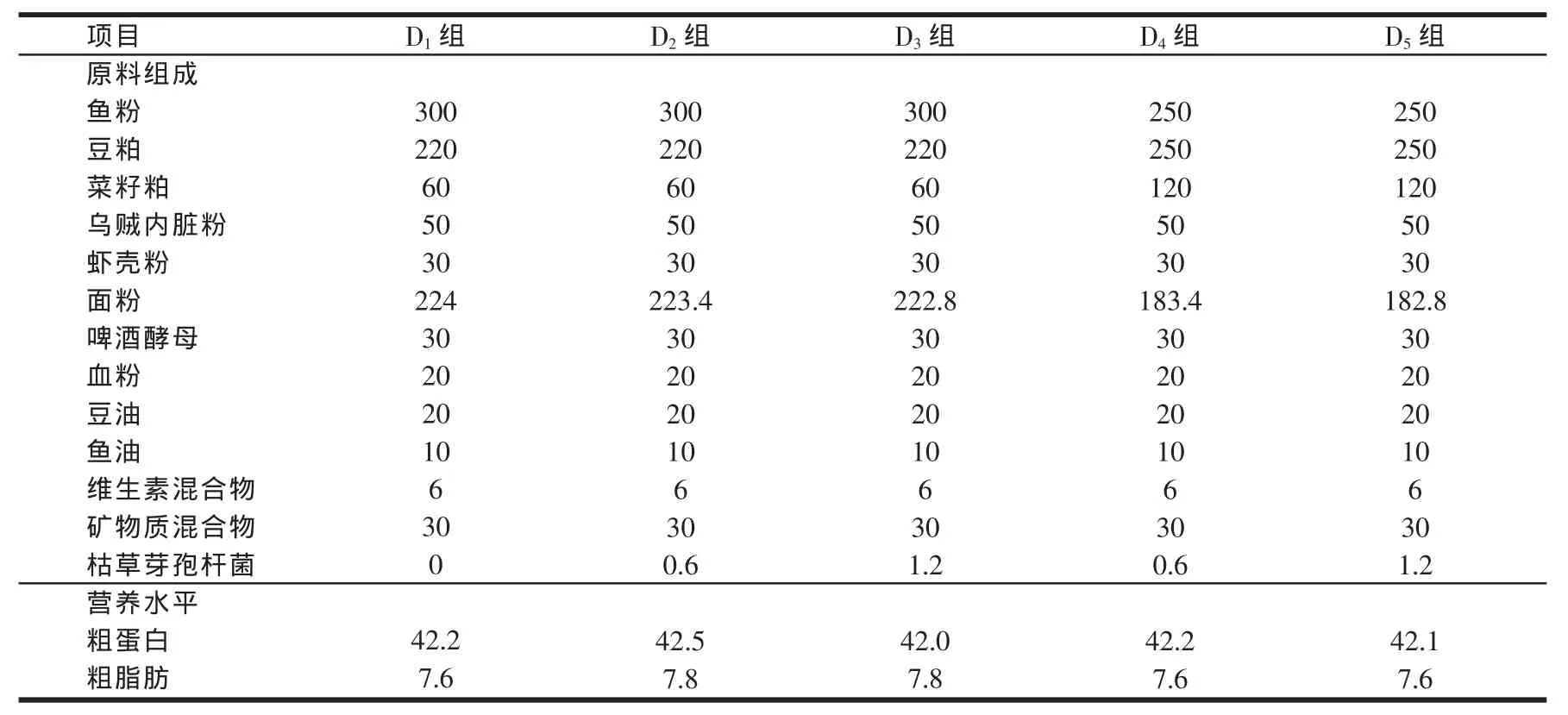
表1 实验饲料配方及营养水平(%)
1.2 实验过程
养殖实验在集美大学水产养殖实验场中进行。正式实验前,凡纳滨对虾暂养于两个1000 L的水族箱中,以实验基础饲料投喂2周,待其适应实验饲料后,对实验虾禁食24 h,然后选择健康、体重相似的幼虾(2.03±0.01)g,随机放入20个实验水族箱(约120 L水体)中,每箱放养30尾虾,每种饲料随机投喂4组实验虾。每天投喂 2 次(8:00,17:00),达饱足。实验为期8周。实验期间,每天清除残饵和粪便并记录摄食量和虾健康状况。实验用水为经砂滤后的天然海水,盐度27~30‰左右,养殖全过程不间断充气。实验期间水温25~28℃,pH值为7.9~8.2,溶解氧约为6 mg/l。每天投喂前排污一次,每次换水占总水量的20%左右,每天观察对虾的摄食、游动、蜕壳及死亡情况。
实验结束时,将实验虾禁食24 h,以丁香油(1:10000)麻醉,然后计数,称重。分别从每网箱随机抽取10尾麻醉的实验虾,以1 ml无菌注射器自头胸甲后缘的围心窦内取血。以1.5 ml离心管封存,放入4℃冰箱中,待其凝血后4℃离心分离血清,用于血清酸性磷酸酶、过氧化物酶、超氧化物歧化酶和酚氧化物酶活力的测定。
1.3 样品分析测定方法
1.3.1 常规分析
采用凯氏定氮法测定饲料粗蛋白含量;采用索氏抽提法,以乙醚为抽提剂测定粗脂肪含量;将样品在电炉上炭化后,在马福炉中灼烧(550℃)8 h后测得样品灰分含量[11]。
1.3.2 酶活力测定
1.3.2.1 酸性磷酸酶(ACP)活力测定
采用南京建成生物工程研究所提供的酸性磷酸酶测试盒,方法参照其说明书。ACP活力定义:100 ml血清在37℃与基质作用30 min产生1 mg酚为1个活力单位(U/100 ml)。
1.3.2.2 超氧化物歧化酶(SOD)活力测定
采用南京建成生物工程研究所提供的超氧化物歧化酶测试盒,方法参照其说明书。SOD总活力定义:每毫升反应液中SOD抑制率达50%时所对应的SOD的量为1个亚硝酸盐单位(NU/ml)。
1.3.2.3 过氧化物酶(POD)活力测定
采用南京建成生物工程研究所提供的过氧化物酶测试盒,方法参照其说明书。POD活力定义:在37℃条件下,每毫升血清每分钟催化产生1 μg的底物酶量定义为一个酶活力单位(U/ml)。
1.3.2.4 酚氧化酶(PO)活力测定
以 L-dopa 为底物,采用改进的 Ashida(1971)[12]方法,按以下步骤进行测定:于96孔酶标板中,将300 μl的 0.1 mol/l、pH值 6.0的磷酸钾盐缓冲液与 10 μl 0.01 mol/l的 L-dopa 及 10 μl血清于室温下混匀,之后置于酶标仪中,固定吸收波长490 nm,按照每4 min测量1次,连续测量5次,测其血清酶动力学OD值。以OD490对反应时间作图,以实验条件下每分钟OD值增加0.001定义为1个酶活力单位(U)。
1.4 数据统计和计算方法
成活率(%)=成活尾数/总尾数×100;
增重率(%)=[终末平均体重(g)-初始平均体重(g)]/初始平均体重(g)×100;
饲料系数=摄食饲料量(g)/[终末体重(g)-初始体重(g)]。
采用SPSS 11.5 for Windows对所得数据进行方差分析,若差异达显著,则进行Tukey多重比较,显著性水平为 P<0.05。
2 实验结果
2.1 饲料中添加B.S.3755对凡纳滨对虾生长性能的影响(见表 2)
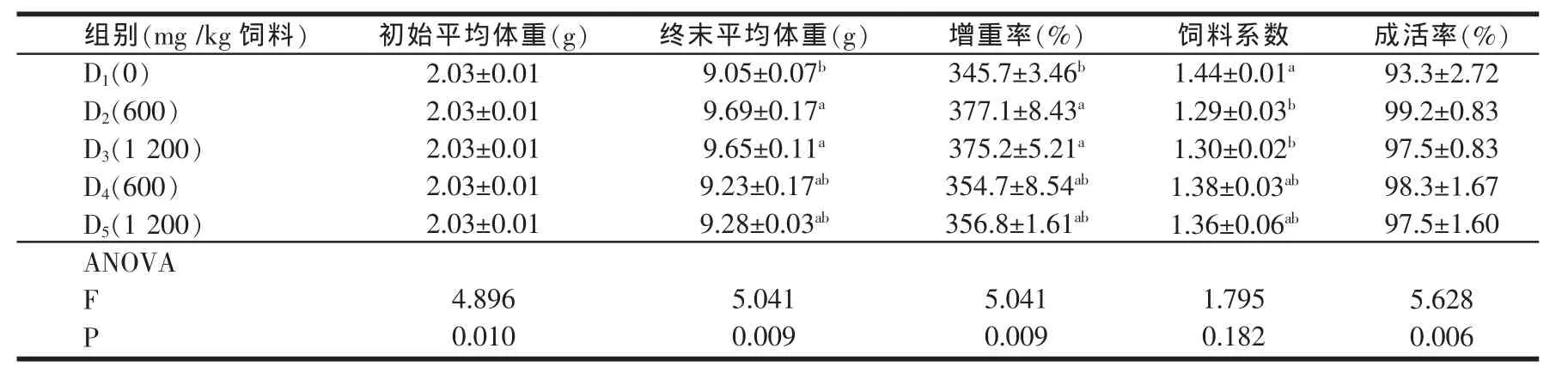
表2 饲料中添加枯草芽孢杆菌(B.S.3755)对凡纳滨对虾生长性能的影响
实验结果表明,各添加B.S.3755饲料组对虾的成活率都高于基础饲料组(D1组),但实验各组间成活率没有显著差异(P>0.05)。添加600和1200 mg/kg B.S.3755的高鱼粉饲料组(D2和D3组)对虾的增重率显著高于D1组(P<0.05),且两个高鱼粉组间增重率差异不显著(P>0.05)。添加 600和 1200 mg/kg B.S.3755的低鱼粉饲料组(D4和D5组)对虾的增重率高于D1组,低于 D2和 D3组,但其差异未达显著水平(P>0.05),且D4和D5组间的增重率也无显著差异(P>0.05)。饲料系数的变化规律与增重率相似,D2和D3组对虾的饲料系数分别显著低于D1组(P<0.05),而D2和D3组间对虾的饲料系数差异不显著(P>0.05)。D4和D5组对虾饲料系数低于D1组,高于D2和D3组,但差异未达显著水平(P>0.05),且D4和D5组间的饲料系数也无显著差异(P>0.05)。
2.2 饲料中添加B.S.3755对凡纳滨对虾血清ACP、SOD、POD、PO 活力的影响(见表3)
添加B.S.3755的实验组凡纳滨对虾血清ACP活力均高于D1组。其中D2组对虾血清ACP活力显著高于D1组(P<0.05),而D3组对虾血清ACP活力高于D1组但低于 D2组(P>0.05),D4和D5组也出现相似的规律,即D4组显著高于D1组,而D5组高于D1组而低于D4组,但差异未达显著水平(P>0.05)。并且添加B.S.3755的各组间 (D2、D3、D4和 D5)ACP 活力无显著性差异(P>0.05)。
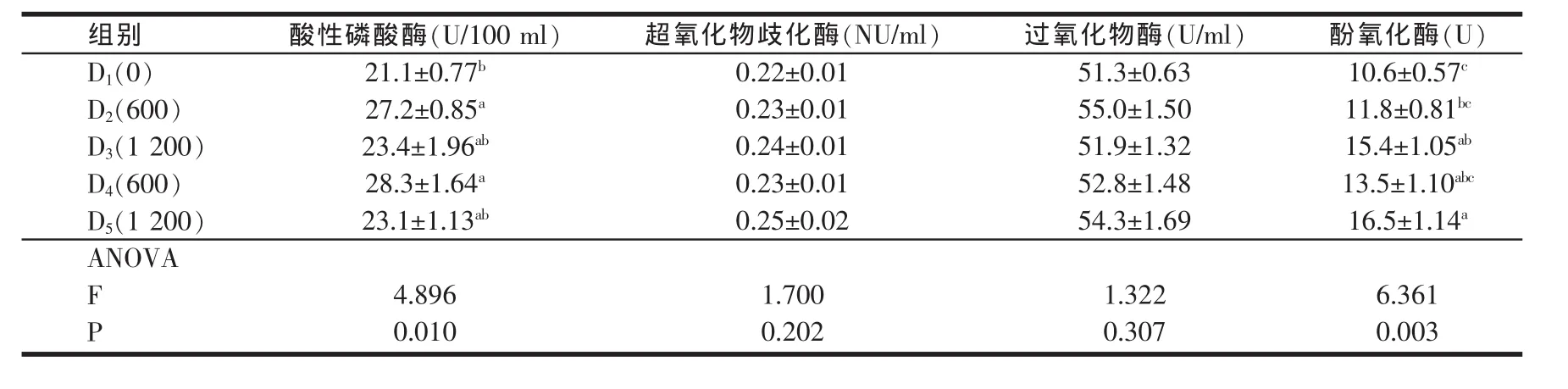
表3 饲料中添加枯草芽孢杆菌(B.S.3755)对凡纳滨对虾体液免疫因子的影响
随着饲料中B.S.3755添加量的增加,对虾血清SOD活力逐渐增加,最大值出现在D5组,其次是D3组,但实验各组间SOD活力差异未达显著水平(P>0.05)。
添加B.S.3755的实验组凡纳滨对虾血清POD活力均高于D1组,但各组间差异不显著(P>0.05)。
添加B.S.3755的实验组凡纳滨对虾血清PO活力均高于D1组。其中D2组对虾血清PO活力高于D1组而低于D3组,但D1和D2组两组之间差异不显著(P>0.05),而D1和D3组之间的差异达到显著水平(P<0.05)。D5组 PO 活力显著高于 D1和 D2组(P<0.05),但D5、D4和 D3组之间差异不显著(P>0.05),即高剂量 B.S.3755添加组(1200 mg/kg)(D3、D5组)的 PO 活力皆显著高于 D1组(P<0.05),而低剂量 B.S.3755添加组(600 mg/kg)(D2、D4组) 的 PO 活力与 D1组差异不显著(P>0.05)。
3 讨论
3.1 饲料中添加B.S.3755对凡纳滨对虾生长性能的影响
已有研究表明,益生菌可显著提高凡纳滨对虾[13]和草鱼[14]等水产动物的成活率。本试验中,实验各组凡纳滨对虾成活率没有显著差异。这可能是因为凡纳滨对虾能很好地适应实验环境,在实验过程没有发生病害,因而成活率较高(在90%以上),其抗病性能没有得到充分体现。
在本试验中,添加B.S.3755的高鱼粉饲料组(D3组),对虾的增重率显著高于基础饲料组(D1组),饲料系数显著低于基础饲料组(D1组)。这说明添加B.S.3755可提高动物对饲料营养物质的利用率。丁贤等(2004)研究发现,向饲料中添加芽孢杆菌可以显著提高凡纳滨对虾的生长性能,并可提高其消化道蛋白酶和淀粉酶活力[1],相似的结果也在刘小刚等(2002)对异育银鲫的研究中发现[15]。王福强等(2005)研究认为,益生菌能够拮抗牙鲆肠道弧菌的生长,增加消化道消化酶的活力,促进肠道有益菌的生长繁殖,并能够提高牙鲆的生长率[16]。而Lin等(2004)通过实验证实了芽孢杆菌可以提高凡纳滨对虾对饲料的消化率。这说明益生菌可提高水产动物消化道消化酶活力,而酶活力的提高有助于动物对营养物质的消化[9]。温俊(2009)发现,草鱼饲料中添加枯草芽孢杆菌可显著降低草鱼肠道弧菌总数,提高有益枯草芽孢杆菌总数,并且可提高草鱼的生长性能[14],说明枯草芽孢杆菌可以很好地在草鱼肠道活化而起到益生作用。以上结果说明,芽孢杆菌进入动物肠道后萌发成具有新陈代谢作用的营养型细菌,并可增强动物肠道的蛋白酶、脂肪酶、淀粉酶的活性,而酶活力的提高有助于饲料的消化,从而提高动物的生长性能和对饲料的利用率。本实验中,D4组凡纳滨对虾的增重率与D1组相比没有显著差异(P>0.05),表明在饲料中添加B.S.3755的条件下,可以以植物蛋白有效替代凡纳滨对虾饲料中3.5%的鱼粉蛋白,说明添加B.S.3755可提高凡纳滨对虾对植物蛋白的消化和利用率,这可为凡纳滨对虾饲料中鱼粉的有效替代提供新的途径。
3.2 饲料中添加B.S.3755对凡纳滨对虾非特异性免疫力的影响
酸性磷酸酶(ACP)是动物体内巨噬细胞溶酶体的标志酶[17],在体内直接参与磷酸基团的转移和代谢,具有降解酶的作用,同时它还可以反映巨噬细胞被激活的程度[18],因此,血清酸性磷酸酶常作为非特异性免疫力的标识。已有研究表明,饲料中添加肽聚糖和β-葡聚糖等免疫刺激物可显著增强凡纳滨对虾血清的ACP活力[19-20]。本实验中,饲料中添加B.S.3755组凡纳滨对虾的ACP活力高于对照组,其中D2和D4组凡纳滨对虾血清ACP活力显著高于D1组。朱学芝等(2007)研究发现,在凡纳滨对虾饲料中添加芽孢杆菌可显著提高对虾血清的ACP活力[21],且降低了溶藻弧菌攻毒后的死亡率[13],在文国等(2009)对凡纳滨对虾的研究报道中[22]也有相似结果,这与本试验的结果一致,说明饲料中添加芽孢杆菌可能通过提高ACP活力而提高凡纳滨对虾的非特异性免疫力和抗病力。
超氧化物歧化酶(SOD)和过氧化物酶(POD)同属于抗氧化酶系,许多研究表明,过氧化物酶同工酶能够反映生物体生长发育、体内代谢状态以及外界环境胁迫的变化[23]。王秀华等(2004)研究发现,饲料中添加肽聚糖不影响凡纳滨对虾血清的SOD活力[19],文国等(2009)也发现,饲料中添加芽孢杆菌和中草药制剂对凡纳滨对虾血清SOD活力没有显著影响[22],然而,饲料中添加β-葡聚糖则可显著提高对虾血清的SOD活力[20]。在本实验中,饲料中添加600~1200 mg/kg B.S.3755对凡纳滨对虾血清SOD和POD活力没有显著影响。其原因一方面可能是实验环境对实验对虾的胁迫较小或实验虾体内的氧化压力不大,导致SOD变化不显著;另一方面可能是不同免疫刺激物对对虾非特异性免疫力的激活途径存在差异。
研究已确认,甲壳类对异物识别等免疫反应起关键作用的是甲壳类动物血细胞内的酚氧化物酶原系统,该系统的成分被激活后可以促进血细胞的吞噬、介导凝集和凝固,产生杀菌物质等[24-26]。本实验结果表明,饲料中添加1200 mg/kg B.S.3755可显著提高凡纳滨对虾血清PO活力。王秀华等(2004)报道,饲料中添加肽聚糖可以提高凡纳滨对虾血清的PO活力[19],其他研究者也报道一些免疫刺激物如β-葡聚糖、中草药、芽孢杆菌等可提高凡纳滨对虾PO活力[13,20,27]。说明对虾血清PO活力对免疫刺激很敏感,适合作为对虾机体免疫状态的评价指标。
根据本实验的结果,饲料中添加600 mg/kg B.S.3755可提高凡纳滨对虾生长率和非特异性免疫力,降低饲料系数,并可在不影响生长性能和非特异性免疫力的情况下,以植物蛋白替代对虾饲料中3.5%的鱼粉蛋白。
[1]丁贤,李卓佳,陈永青,等.芽孢杆菌对凡纳对虾生长和消化酶活性的影响[J].中国水产科学,2004,11(6):581-584.
[2]Ogle R B,Inborr J.Alternatives to low dose antibiotics in piglet feeds in Sweden[M].38th Meeting of the European Association for Animal Production,Portugal,Commission on Pig Production,Session,1987,4:1-6.
[3]Spriet S M,Decuypere J A,Hendericky H K.Effect of Bacillus toyoi(Toyocerin)on the digestibility of the nutrient and the small intestinal mean retention time in pig [J].Med Fac Landbouw Rijksuriv Gent.,1987,52:1673-1683.
[4]Surawicz C M,Elmer G W,Speelman P.Prevention of antibiotic associated diarrhea by Saccharomyces boulardii:a prospective study[J].Gastroenterology,1989,84:1285-1287.
[5]Pollman D S,Danielson D M,Peo E R Jr.Effect of microbial feed additive on performance of starter and growing-finishing pigs[J].J.Anim.,1980,51:577-581.
[6]Jonsson E.Persistence of Lactobacillus strain in the gut of sucking piglets and its influence on performance and health [J].Swed.J.Agric.Res.,1986,16:43-60.
[7]Rengpipat S,Phianphak W,Piyatiratitivorakul S,et al.Effects of a probiotic bacterium on black tiger shrimp Penaeus monodon survival and growth[J].Aquaculture,1998,167:301-313.
[8]潘康成,张钧利,杨金龙,等.枯草芽孢杆菌制剂对肉鸡生长性能的影响研究[J].饲料广角,2004,21(2):33-35.
[9]Lin H Z,Guo Z X,Yang Y Y,et al.Effect of dietary probiotics on apparent digestibility coefficients of nutrients of white shrimp Litopenaeus vannamei,Boone [J].Aquac.Res.,2004,35(15):1441-1447.
[10]Rengpipat S,Rukpratanporn S,Piyatiratitivorakul S,et al.Immunity enhancement in black tiger shrimp (Penaeus monodon)by a probiont bacterium (Bacillus S11)[J].Aquaculture,2000,191:271-288.
[11]Association of Official Analytical Chemists (AOAC).Official Methods of Analysis of Official Analytical Chemists International,16th edn [M].Association of Official Analytical Chemists.Arlington,VA.,1995.
[12]Ashida M.Purification and characterization of prophenoloxidase from hemolymph of the silkworm Bombyx mori[J].Arch Biochem Biophy.,1971,144:749-762.
[13]朱学芝,郑石轩,潘庆军,等.微生态制剂对凡纳滨对虾生长及水质的影响[J].中山大学学报(自然科学版),2008,47:58-62.
[14]温俊.合生素对草鱼肠道菌群及生长性能的影响[J].饲料研究,2009(4):62-63.
[15]刘小刚,周洪琪,华雪铭,等.微生态制剂对异育银鲫消化酶活性的影响[J].水产学报,2002,26(5):448-452.
[16]王福强,李坤,邵占涛,等.产蛋白酶益生菌Y2-2和Y1-13对牙鲆幼鱼生长促进作用的研究[J].海洋科学,2005,29:29-33.
[17]Thompson I,Ghoubert C,Houlihan D F,et al.The effect of dietary Vitamin A and astaxanthin on the immunocompetence of rainbow trout[J].Aqua.,1995,133:91-133.
[18]Stephensen C B,Moldoveanu Z,Gangopadhyay N N.Vitamin A deficiency diminishes the salivary immunoglobulin A response and enhances the serum immunoglobulin G response to influenza Avirus infection in BALB/c mice[J].J.Nutr.,1996,126(1):94-102.
[19]王秀华,宋晓玲.肽聚糖制剂对南美白对虾体液免疫因子的影响[J].中国水产科学,2004,1:26-30.
[20]杨福刚,周洪琪,黄旭雄.不同β-葡聚糖对凡纳滨对虾稚虾生长及非特异免疫功能的影响 [J].上海水产大学学报,2005,9:263-269.
[21]朱学芝,郑石轩,潘庆军,等.芽孢杆菌对凡纳滨对虾免疫和生化指标的影响[J].饲料研究,2007(4):56-59.
[22]文国,于明超,李卓佳,等.饲料中添加芽孢杆菌和中草药制剂对凡纳滨对虾免疫功能的影响 [J].上海海洋大学学报,2009,18(2):181-186.
[23]Holmblad T,Söderhäll K.Cell adhesion molecules and antioxidative enzymes in a crustacean,possible role in immunity[J].Aquaculture,1999,172:111-123.
[24]Fisher C W,Brady U E.Activation properties and collection of hemolymph phenoloxidase of the American cockroach,Periplaneia americana[J].Comp.Biochem.Physiol.,1983,75A:111-114.
[25]SöderhällK.The prophenoloxidase activating system and melanization-a recognition mechanism of arthropods,A review[J].Dev.Comp.Immune.,1982,6:601-611.
[26]Söderhäll K,Hall L.Lipopolysaccharide-induced activation of prophenoloxidase activating system in crayfish Haemocyte lysate[J].Biochim.Biophys.Acta.,1984,797:99-104.
[27]董晓慧,李明,叶继丹.复方中草药对凡纳滨对虾生长性能和血清非特异免疫因子的影响[J].大连水产学院学报,2009,24(2):162-165.
