一种光合细菌复合制剂对草鱼的生长及非特异性免疫功能的影响
2011-03-09劳惠燕王蔚淼李小梅李续娥
劳惠燕 王蔚淼 李小梅 李续娥
草鱼养殖中一直面临病害多、死亡量大的问题,而采用抗生素和化学药物防治又会造成耐药性和药物残留超标。因此,研发天然无公害、能有效提高草鱼抗病力的免疫增强剂具有广阔的前景。光合细菌是一大类在厌氧条件下进行不放氧光合作用的细菌总称,在水产养殖上有净化水质、促进生长、防病治病等作用。已有研究发现,光合细菌含有的细胞壁多糖和辅酶Q能明显提高水产动物的免疫功能[1-3]。鱼类主要依靠非特异免疫系统抵抗病原入侵,而关于光合细菌对草鱼免疫机能的研究鲜有报道。本研究拟以一种光合细菌复合制剂为饲料添加剂饲喂草鱼,探讨其对草鱼生长及非特异性免疫功能的影响,为开发防治鱼病的益生菌制剂类药物提供参考依据。
1 材料与方法
1.1 实验材料及分组
光合细菌复合制剂(菌数4×109CFU/ml)和基础饲料均由广东海大集团股份有限公司畜牧水产研究中心提供。实验草鱼(Ctenopharyngodon idellus)180余尾,初始平均体重为(32.82±0.02)g,购回后置于水族箱中暂养22 d,之后随机平分为2组:①对照组,只饲喂基础饲料;②处理组,将光合细菌制剂按1%比例喷洒于基础饲料上拌匀饲喂。每组各设3个平行,每个平行30尾鱼。草鱼饲喂过程中每日定时定量饲喂2次,并记录摄食量,其它养殖管理按常规方式进行。
1.2 测定方法
1.2.1 生长性能指标的测定
分别对饲喂30 d和60 d的实验草鱼称重、测体长,计算生长性能指标:
增重率(%)=[(试验末均重-试验初均重)/试验初均重]×100;
体长增长率(%)=(试验末体均长-试验初体均长)/试验初体均长×100;
特定生长率(%/d)=(ln试验末均重-ln试验初均重)/试验天数×100;
饲料系数=均摄食量/(试验末均重-试验初均重);
蛋白质效率=[(试验末总体重-试验初总体重)/(饲料中的蛋白质含量×摄取饲料总重量)]。
1.2.2 非特异性免疫指标的测定
对饲喂30 d和60 d的实验草鱼称重、测体长后,取血样和肝脏(取样前1 d停止投喂)。血样采用穿刺尾动脉取血法取血,每组取15尾鱼,采集的血样部分以2 g/l的肝素钠抗凝,其余分离血清。血清和肝脏均保存于-20℃冰箱中备用。
1.2.2.1 白细胞吞噬活性的测定
将金黄色葡萄球菌(Stapylococcus aureus,购于广东省微生物菌种保藏中心)接种在LB培养基上,37℃下培养24 h后,3000 r/min离心5 min,集菌。然后在菌悬液中加入终浓度为1%的福尔马林,37℃下灭活24 h(经过平皿法证实此菌已被彻底灭活),用灭菌生理盐水(0.65%)清洗2次,并调成为浓度为10%的菌悬液,即为福尔马林灭活的菌体,置4℃冰箱中保存备用,作为检测白细胞吞噬活性的吞噬原。
将0.2 ml抗凝血加入0.1 ml金黄色葡萄球菌悬液,充分混匀后置于28℃下水浴,孵育1 h。水浴期间每隔10 min摇匀1次。静置,吸取红细胞与上层血浆之间的白细胞层,每个血样涂5片。自然晾干后,滴加甲醇固定,Wright's-Giemsa染色10 min,蒸馏水冲洗,风筒吹干后油镜观察。计数并计算白细胞的吞噬百分比(PP)与吞噬指数(PI)。
PP(%)=(100个吞噬细胞中参与吞噬的细胞数/100)×100;
PI=吞噬细胞内的细菌总数/参与吞噬的吞噬细胞数。
1.2.2.2 血清抗菌活力的测定
用0.1 mol/l pH值6.4的磷酸盐缓冲液从固体培养基上将荧光假单胞菌(Pseudomonas fluorescens,购于广东省微生物菌种保藏中心)洗下作为底物并配成OD570=0.3~0.5的菌悬液。取3 ml该悬液与50 μl待测血清于试管中混匀,测570 nm处的光密度值(A0)。然后在37℃温水浴中30 min,取出后放入冰箱(4℃)10 min终止反应,测定570 nm处的光密度(A),抗菌活力(Ua)按公式计算:Ua=(A0-A)/A0。
1.2.2.3 SOD、MDA、GSH-Px的测定
均采用南京建成生物工程研究所生产的试剂盒测定(批号为20100712),具体测定步骤按说明书进行。
1.3 数据处理
实验数据采用Microsoft Excel进行t检验分析差异性。
2 结果
2.1 光合细菌复合制剂对草鱼生长性能的影响
用添加光合细菌复合制剂的饲料饲喂草鱼60 d时,草鱼的生长性能指标变化如表1所示。从表1可知,处理组草鱼增重率、特定生长率和蛋白质效率较对照组分别提高了2.68%、2.03%、4.72%,饲料系数降低了4.78%,体长增长率降低了4.63%。虽然这种差异不具有显著性意义(P>0.05),但添加光合细菌复合制剂对草鱼增重率、特定生长率、蛋白质效率增加及饲料系数降低的趋势对草鱼的养殖却是十分有意义的。此外,处理组草鱼增重率增加与体长增长率降低,提示添加光合细菌复合制剂有可能促进草鱼的体形增肥。
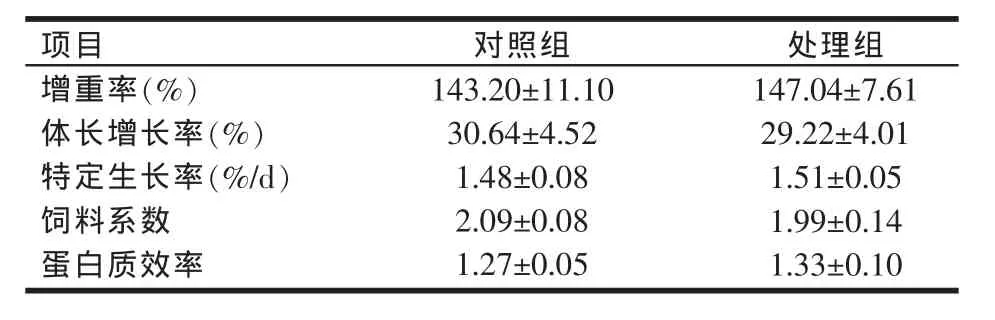
表1 光合细菌复合制剂对草鱼生长的影响
2.2 光合细菌复合制剂对草鱼非特异性免疫的影响(见表2)
光合细菌复合制剂作为饲料添加剂对草鱼PP,PI,血清抗菌活力,血清及肝脏总SOD活力、MDA含量、GSH-Px活力共9个非特异性免疫指标的影响情况如表2所示。由表2可知,饲喂30 d时,处理组较对照组提高草鱼白细胞吞噬百分比29.6%,具有极显著差异(P<0.01),到饲喂60 d时,处理组与对照组白细胞吞噬百分比则无显著性差异(P>0.05);饲喂30 d或60 d时,处理组与对照组的吞噬指数均无显著性差异(P>0.05)。处理组与对照组的血清抗菌活力在饲喂30 d时无显著性差异(P>0.05),但在饲喂60 d时,处理组极显著升高(P<0.01)。
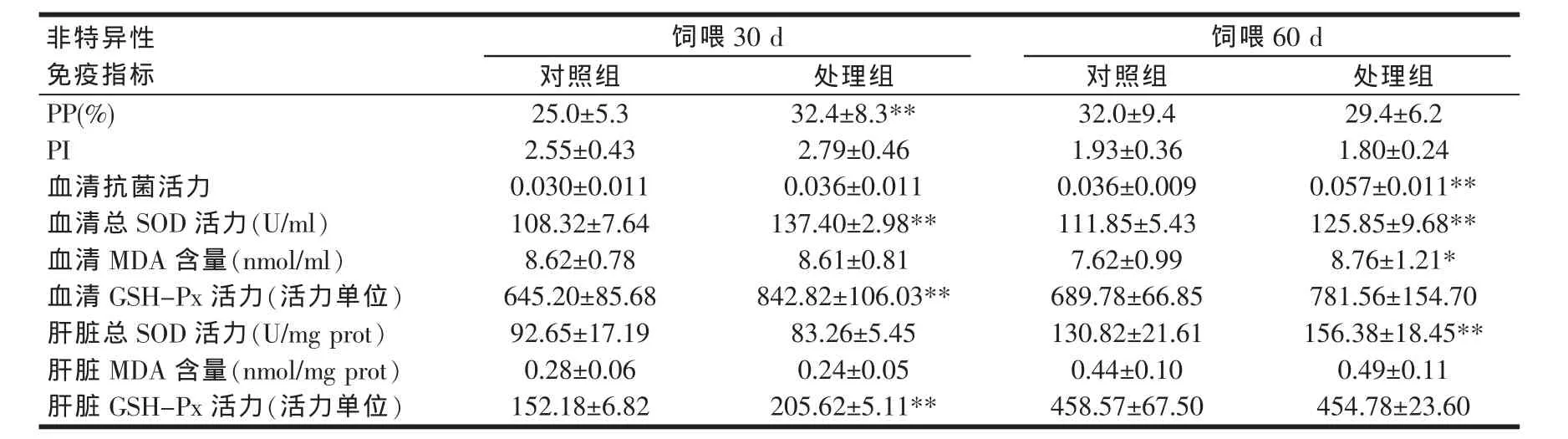
表2 光合细菌复合制剂对草鱼非特异性免疫的影响
饲喂30 d或60 d时,与对照组相比,处理组草鱼血清总SOD活力均极显著升高(P<0.01),但肝脏总SOD活力仅在饲喂60时有极显著升高(P<0.01);饲喂30 d时,处理组血清及肝脏GSH-Px活力均极显著升高(P<0.01),饲喂60 d时,处理组与对照组的该指标则不具显著性差异(P>0.05)。饲喂60 d时,处理组草鱼血清MDA含量较对照组显著升高(P<0.05),但肝脏MDA含量没有显著性变化(P>0.05)。
3 讨论
3.1 光合细菌复合制剂对草鱼生长性能的影响
光合细菌能有效利用水中过剩的有机物作为自身繁殖的营养源,迅速分解水中有害物质,增加溶氧,稳定水质,为水生生物创造良好的生态环境;其菌体的营养成分十分丰富,蛋白质含量高达65.45%,维生素含量丰富、齐全[4],有很好的促生长作用。沈锦玉等[5]在饲料中添加1%或5%的光合细菌饲喂鲫鱼、罗非鱼48 d,得出鱼的生长速度高于对照组的结论;Wang Yanbo等[6]的研究结果表明,饲料中添加0.1%光合细菌冻干粉饲养鲤鱼60 d能显著提高其日增重、相对增重率和降低饲料系数。本试验饲料中添加1%的光合细菌复合制剂饲养草鱼60 d对其生长没有显著影响,这可能与光合细菌的种类及添加剂量、鱼的食性以及养殖环境有关。
3.2 光合细菌复合制剂对草鱼非特异性免疫的影响
饲料中的微生态制剂通过刺激机体的细胞和体液免疫功能提高水产动物的抗病力,如白细胞吞噬活性、抗菌活力、溶菌酶活力、补体活性、过氧化物酶活力等。
鱼类白细胞的主要作用是吞噬病菌和自身的老化与坏死细胞,保护机体抵御病害的侵袭。王有基等[7]每7 d给鲤鱼投放不同浓度的光合细菌菌液,在第1、7、14、21、28 d检测鲤鱼白细胞吞噬活性等指标,测得处理组白细胞吞噬百分比和吞噬指数明显高于对照组(P<0.05),且随着时间的增加而增强;赵卫红等[8]的研究结果也表明,在水体中添加光合细菌饲养异育银鲫49 d能提高其白细胞的免疫性能,作用效果随着添加量的增加而增加。本研究发现,光合细菌复合制剂饲喂草鱼30 d时提高草鱼白细胞吞噬百分比29.6%,而60 d时处理组与对照组没有显著差异,可能是因为光合细菌对鱼类白细胞吞噬活性的刺激作用主要在投放的早期、持续时间较短的缘故。
SOD对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基(O2-),保护细胞免受损伤。本研究表明,饲喂草鱼30 d时,处理组血清SOD活力提高了26.8%,60 d时血清SOD活力提高12.5%,肝脏SOD活力提高19.5%,血清抗菌活力提高58.3%,刘慧玲等[9]的研究结果也表明,光合细菌能显著提高罗非鱼组织SOD活力和抗菌活力,与本研究的结果一致。GSH-Px是机体内广泛存在的一种重要的催化过氧化氢分解的酶,起到保护细胞膜结构和功能完整的作用。关于光合细菌对鱼类GSH-Px活力的影响,目前尚未发现报道,而其它微生态制剂对水产动物GSH-Px活力的影响则有相关报道。Deng-Yu Tseng等[10]测定枯草芽孢杆菌对白对虾的免疫参数的影响,GSH-Px活力是指标之一,但各处理组之间没有显著差异。本试验结果显示,光合细菌复合制剂在饲喂草鱼30 d时极显著提高草鱼血清和肝脏GSH-Px活力,60 d时与对照组没有显著差异,推测其对GSH-Px活力的刺激作用可能也在早期。
MDA是脂质过氧化反应的终产物,它的含量高低间接反应了机体细胞受自由基攻击的严重程度。在正常生物体内,氧自由基的产生与清除可维持低水平的,有利无害的平衡[11]。本研究中饲喂草鱼60 d时,血清处理组MDA含量反而比对照组显著升高了,说明受自由基攻击的程度高,这可能是机体要与血清中极显著升高的清除自由基的SOD平衡的缘故。菌种来源、类型、剂量和使用时间等各种因素会显著影响微生态制剂的免疫调节活力。由于微生态制剂在水产养殖中存在最适宜剂量,且最适宜剂量会因免疫对象和免疫指标的类型而不同,不同组织或器官的特定免疫反应的作用也会随着使用剂量而变化。免疫刺激剂的用量与免疫刺激作用并不存在正相关,高剂量或者是长时间的投喂反而会抑制免疫反应[12-13]。因此,光合细菌复合制剂对草鱼的最佳免疫时间和使用剂量还有待进一步研究。
[1]敖礼林.光合细菌在水产养殖上的高效应用及注意事项[J].江西水产科技,2009(4):38-39.
[2]宁宕.新一代饲料添加剂——光合细菌[J].兽药与饲料添加剂,2003(2):47.
[3]Qi Zizhong,Zhang Xiaohua,Boon N,et al.Probiotics in aquaculture of China-Current state,problems and prospect[J].Aquaculture,2009,290(1/2):15-21.
[4]徐良梅,滕小华.光合细菌的基本特性及在水产养殖上的应用[J].东北农业大学学报,2005,36(2):230-234.
[5]沈锦玉,尹文林,刘问,等.光合细菌HZPSB对水产养殖水质的改良和对鱼类促生长作用[J].科技通报,2004,20(6):481-484.
[6]Wang Yanbo,Xu Zirong.Effect of probiotics for common carp(Cyprinus carpio)based on growth performance and digestive enzyme activities[J].Animal Feed Science and Technology,2006,127(3/4):283-292.
[7]王有基,胡梦红,朱焕青,等.光合细菌对鲤鱼非特异性免疫功能的影响[J].水利渔业,2005,25(6):38-39.
[8]赵卫红,陈立侨,刘晓利,等.地衣芽孢杆菌和荚膜红假单胞菌对异育银鲫鱼种非特异性免疫机能的影响[J].上海水产大学学报,2008,17(6):757-760.
[9]刘慧玲,张战锋,李长玲,等.光合细菌对罗非鱼鱼苗养殖水质及抗病力的影响[J].渔业现代化,2009,36(2):47-51.
[10]Tseng D Y,Ho P L,Huang S Y.Enhancement of immunity and disease resistance in the white shrimp,Litopenaeus vannamei,by the probiotic,Bacillus subtilis E20 [J].Fish & Shellfish Immunology,2009,26(2):339-344.
[11]张燕,李桂芳,任秀敏,等.鼻息肉组织和血清中MDA含量及ADA、SOD活性的测定及其意义[J].山东大学耳鼻喉眼学报,2010,24(6):24-26.
[12]Nayak S K.Probiotics and immunity.A fish perspective[J].Fish&Shellfish Immunology,2010,29(1):2-14.
[13]Hai N V,Fotedar R.Comparison of the effects of the prebioticsβ-1,3-D-glucan)and the customised probotics(Pseudomonas synxantha and P.aeruginosa)on the culture of juvenile western king prawns (Penaeus latisulcatus Kishinouye,1896)[J].Aquaculture,2009,289(3/4):310-316.
