运动性损伤后大鼠骨骼肌转化生长因子-β1变化的研究
2011-03-06于新凯石鹏超
于新凯,石鹏超,左 群
骨骼肌损伤修复是一个极其复杂的过程,多年来一直将骨骼肌细胞视为终末分化细胞,但是,卫星细胞的发现推动了骨骼肌再生研究的飞速发展。卫星细胞是位于肌膜与基底膜之间的一组细胞群,是肌肉损伤后修复的惟一来源,其修复伴随着复杂的生物学调节机制,与大量的生长因子相关,生长因子是一类影响细胞生长活性的多肽因子,其对刺激卫星细胞增殖和分化,促进组织或器官修复和再生具有重要作用[16]。转化生长因子-β(Transforming Grow th Factor-β,TGF-β)是一种多功能的细胞生长因子,分布于各类型的细胞和组织中,它不仅影响胚胎发育、骨的形成、血管再生、炎症反应和组织修复,而且,对细胞的生长、分化、凋亡和免疫功能也有重要的调节作用[8]。哺乳动物体内TGF-β共有3种亚型:TGF-β1、TGF-β2、TGF-β3,其中,TGF-β1所占比例最高(>90%),活性最强[2]。目前研究认为,TGF-β可以影响骨骼肌损伤修复的生长因子,在卫星细胞增殖和分化过程中起负性调节作用[13,18,20]。
但已有的研究大多集中于观察离体细胞培养过程中TGF-β的作用和变化,在体研究较少。本研究拟通过建立运动性骨骼肌损伤实验动物模型,观察损伤后不同时刻肌肉内 TGF-β1的变化,研究骨骼肌损伤修复过程中 TGF-β1的变化特征,从而进一步探究骨骼肌损伤后的修复过程,丰富运动性骨骼肌损伤修复理论。
1 材料与方法
1.1 实验动物及分组
8周龄雄性SD大鼠72只,购于上海西普尔—必凯实验动物有限公司,体重264.44±11.94 g,分笼饲养,室温20℃±2℃,相对湿度50%~55%,光照时间12 h,国家标准啮齿类动物固体干燥饲料喂养,自由饮食。大鼠经过跑台适应训练后按体重随机分为对照组(C组)、运动后即刻组、6 h组、12 h组、24 h组、48 h组、72 h组、1周组、2周组。
1.2 运动损伤模型和实验取材
除C组外,其余各组大鼠进行一次90 min持续跑台训练,速度为16 m/min,坡度为-16°,分别在运动后0 h、6 h、12 h、24 h、48 h、72 h、1周、2周等不同时刻处死、取材。
大鼠采用10%水合氯醛浅麻后,迅速取双侧腓肠肌,左侧腓肠肌液氮速冻后置于-80℃低温冰箱保存待用,用于RT-PCR分析;右侧腓肠肌置于4%多聚甲醛固定液中固定,制作石蜡切片,进行 HE和免疫组织化学染色。
1.3 TGF-β1m RNA的RT-PCR测定
取冻存左侧腓肠肌置于玻璃匀浆器中,加1 m l Trizol,充分匀浆,静至5 min后,取上清移至1.5 m l Eppendo rf管,室温放置 10 min,加 200μl氯仿,充分混匀, 15 000 rpm离心5~7 min,取上清至1.5 m l Eppendorf管加600μl氯仿混匀,15 000 rpm离心5 min;取上清至1.5 m l Eppendo rf管加500μl异丙醇混匀,15 000 rpm离心10 min,弃上清,用75%乙醇1 m l冲洗,高速离心5 min,弃上清,RNA沉淀于空气中干燥(2~3 min);将干燥后的RNA溶解于DEPC处理水中,将总RNA作适当稀释后,分光光度计测OD 260/OD 280比值,并定量。定量公式:RNA浓度(μg/m l)=OD 260值×40×稀释倍数(400倍)。
按下列顺序在1.5 m l离心管中加入下列反应物(体积为12.5μl):DEPC水6μl、RNA酶抑制剂(50 U/μl) 0.5μl、随机引物(50 pM/μl)2μl、RNA(2μg),在65℃水浴处理5 min后室温放置10 min,高速离心5 s,按下列顺序加在1.5 m l离心管加入下列反应物(总体积为20 μl):RNA酶抑制剂(50U/μl)0.5μl、5×buffer(Promega) 4μl、dN TP M IX(10mM/each)2μl、DTT2μl、M-MLV (200 U/μl)1μl,水浴37℃下反应1 h,90℃处理 5~10 min后冰浴5 min,高速离心5 s。
PCR反应体系(50μl):H2O:34.5μl,MgCl2(TaKa-Ra)5μl,10×buffer(TaKaRa)、dNTP(10mM/each)、Primer(up50 pM/ul)、Primer(dow n50 pM/μl)各 1μl, Temp late(反转录产物,即cDNA)2μl,Taq(5U/μl)0.6 μl(3 U)。反应条件:95℃2 min,94℃30s、60℃45s、72℃1 min,共38个循环,72℃6 min。内参选用 GAPDH。
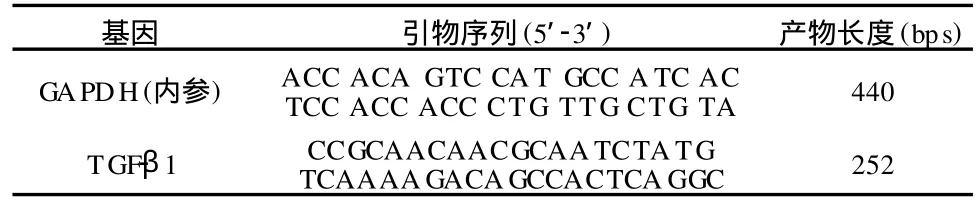
表1 引物序列、产物长度一览表
产物电泳和分析:TBE缓冲液,1.2%的琼脂糖电泳,电压为160 V,55 min,利用系列数码凝胶图象处理系统GIS-2008和图象分析软件分析。
1.4 腓肠肌 HE染色
将右侧腓肠肌后固定24 h以上后,常规脱水、透明、浸蜡、包埋,制作石蜡切片,切片厚度为5μm。
将切片脱蜡至水,浸入苏木素中染色5 min,自来水冲洗3 min,1%稀盐酸酒精分化2~3 s,自来水冲洗3 min,伊红染色3 min,流水冲洗3 min,脱水、透明、中性树胶封片,显微镜下观察腓肠肌细胞形态结构,拍照并采集图像。
1.5 TGF-β1免疫组化染色和图像采集
切片常规脱蜡至水,3%H2O2室温孵育20 min,PBS (p H 7.4)洗3次,每次2 min;PBS(p H 7.0)抗原热修复, PBS(p H 7.4)洗1次5 min;滴加5%山羊血清封闭液,室温孵育20 min;滴加一抗,4℃湿盒孵育过夜,PBS(p H 7.4)洗3次,每次5 min;滴加二抗,37℃湿盒孵育20 min,PBS (p H 7.4)洗4次,每次5 min;滴加 SABC,37℃湿盒孵育20 min;DAB显色;苏木精轻度复染,镜检,拍照并采集图像。
随机抽取每组大鼠腓肠肌 TGF-β1免疫组织化学反应染色切片,每组5张。采用光学显微镜Olympus DX70和Image-Pro Plus 4.1图像分析软件进行图像采集和分析处理。每张切片随机各取5个视野,每组共测25个视野,在同一放大倍数下测定免疫阳性表达面积和积分光密度(Integrated Optical Density,IOD)。
1.6 数据统计
2 研究结果
2.1 各组大鼠腓肠肌TGF-β1mRNA RT-PCR结果
表2显示,一次下坡跑后大鼠腓肠肌 TGF-β1mRNA除72 h组外,其余各组均低于对照组,其中24 h和2周组显著性低于对照组(P<0.05),其余均与对照组无显著性差异(P>0.05)。

表2 各组大鼠腓肠肌TGF-β1m RNA表达水平一览表
2.2 各组大鼠腓肠肌 HE染色结果
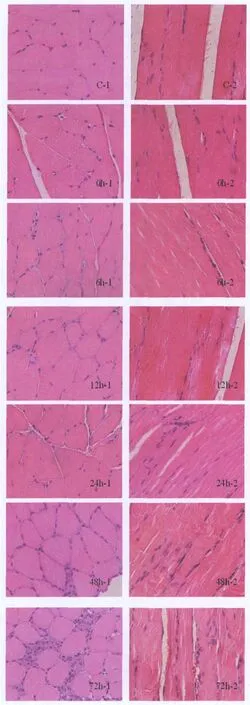
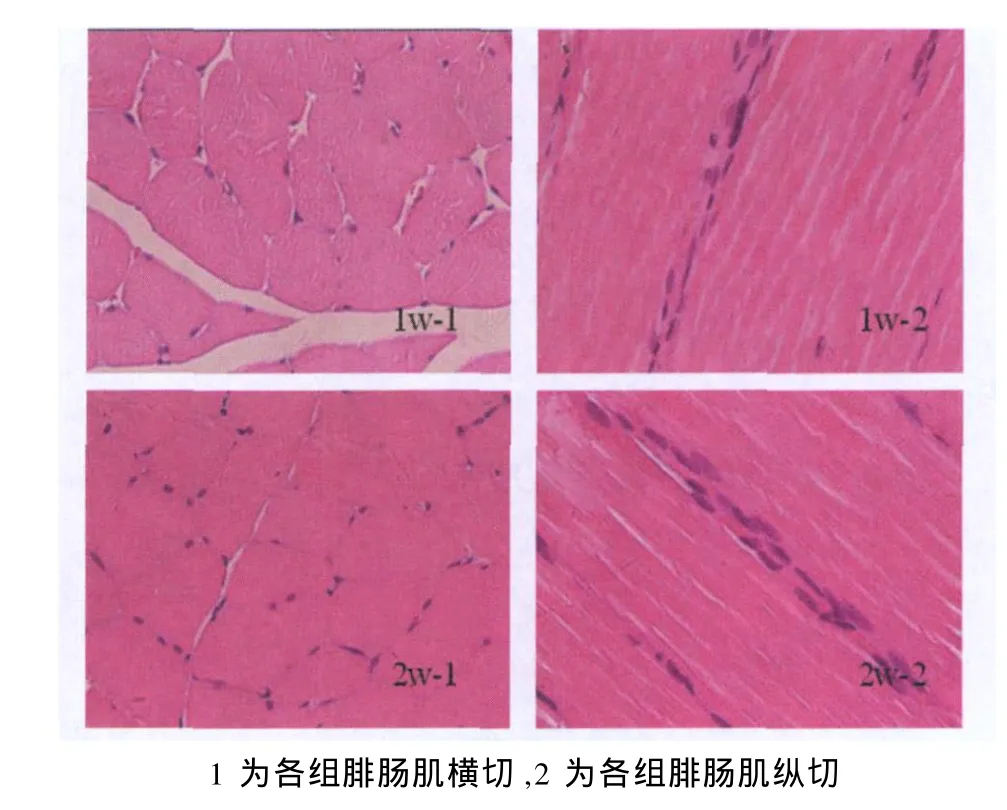
图1 各组大鼠腓肠肌HE染色结果图 ×400
HE染色可见,C组肌膜完整、清晰,肌纤维结构正常; 0 h组肌纤维略肿胀,肌纤维形态无明显变化;6 h组肌纤维肿胀明显,部分肌纤维呈圆形;12 h组肌纤维持续肿胀,部分肌纤维溶解,肌膜模糊,不连续;24 h组肌纤维部分断裂,有少量炎症细胞浸润;48 h组炎症细胞明显增多;72 h组大量炎症细胞浸润;1周组偶见炎症细胞浸润,肌纤维无明显肿胀;2周组肌纤维形态结构基本正常,肌膜完整性良好(图1)。
2.3 各组大鼠腓肠肌 TGF-β1免疫组织化学结果
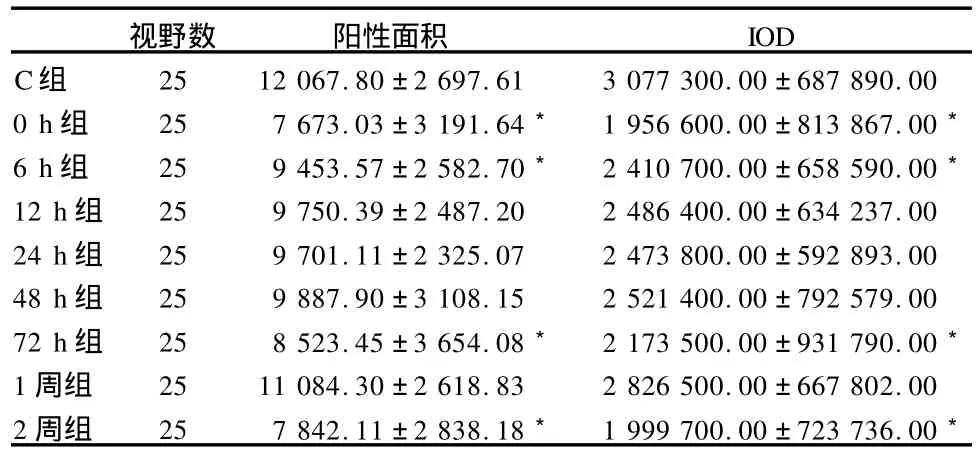
表3 各组大鼠腓肠肌TGF-β1免疫组化图像采集分析结果一览表
免疫组化染色结果可见,对照组和实验组大鼠腓肠肌TGF-β1染色均为阳性,棕褐色或棕黄色的颗粒主要分布在细胞质。经苏木精复染后,细胞核被染成淡蓝色,细胞质和其他部位不着色,用PBS代替一抗的相邻阴性对照切片细胞质内无阳性表达结果(图2)。
表3、图2的免疫组化结果显示,与C组相比,0 h组、6 h组、72 h组、2周组 TGF-β1免疫阳性染色面积减少,积分光密度值降低,差异具有显著性(P<0.05);12 h组、24 h组、48 h组、1周组的阳性染色面积减少,积分光密度值降低,差异不具有显著性(P>0.05)。
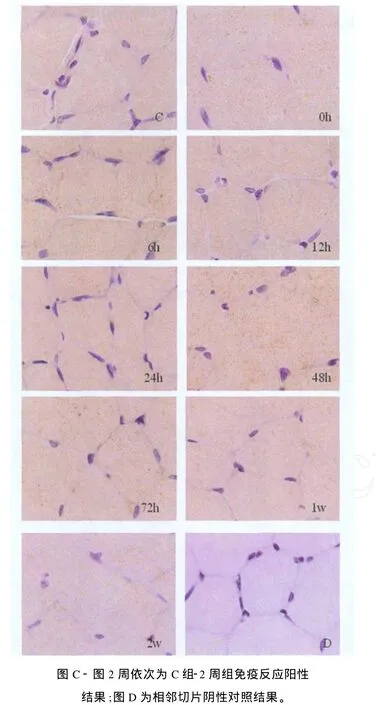
图2 各组大鼠腓肠肌 TGF-β1免疫组织化学结果图 ×1 000
3 讨论
运动性骨骼肌损伤是一种高强度和/或长时间运动后发生的骨骼肌损伤。研究表明,人体在经历一次剧烈且不习惯的运动后肌肉会出现肌力下降、运动范围减小、肌肉酸痛等一系列现象,并且这些现象在第一次离心运动后表现更加明显。本研究的首要目的是准确建立运动性损伤的动物模型,基于此我们采用了经典的A rmstrong下坡跑运动模型,在运动时间和动物分组方面做了一定的调整。
通过 HE染色结果发现,运动后即刻大鼠腓肠肌肌纤维出现肿胀趋势;6 h组肌纤维发生明显肿胀现象,部分肌细胞呈圆形,面积增加,且局部可见细胞核增多,这表明骨骼肌损伤已经发生;12 h~72 h时间段内肌纤维持续肿胀,肌纤维细胞核增多,局部肌纤维横纹模糊,肌纤维边缘不清,大量炎症细胞浸润,偶见小片状肌纤维溶解等现象;损伤发生1周后肌纤维形态结构趋于正常;2周后,可见肌纤维形态基本恢复正常。形态学观察可看出,本实验动物模型基本上反映了运动性骨骼肌损伤修复的全过程。
一般认为,骨骼肌损伤后,卫星细胞即被激活,开始肌肉再生过程。卫星细胞的增殖和分化受到正性和负性两类生长因子的调控,骨骼肌损伤发生后,各类生长因子通过整体协同效应调节骨骼肌再生修复。
胰岛素样生长因子(IGF),生肌决定因子(M yoD),碱性成纤维细胞生长因子(bFGF),肝细胞生长因子(HGF)等是典型的正性调节因子。动物实验也表明骨骼肌损伤后,影响卫星细胞增殖和分化的正性调节因子有很高的表达:李宏云等[1]在骨骼肌钝挫伤后发现 IGF-ImRNA表达明显升高;肖卫华等[4]报道,小鼠腓肠肌钝挫伤后,1~7天内MGFmRNA表达水平持续升高,第11天时仍明显高于对照组;向峥等[3]发现,bFGFmRNA在运动性骨骼肌损伤中明显升高;Tatsumi[22]发现骨骼肌损伤后,卫星细胞很快被激活,HGF表达明显增加。
TGF-β则是影响卫星细胞增殖和分化的负性调节因子,Ronald E Allen[20]对成熟大鼠骨骼肌卫星细胞体外培养实验中发现,TGF-β可以同时抑制卫星细胞的增殖和分化,而卫星细胞的分化受 TGF-β浓度影响较其增殖更为敏感,表现为较低浓度的 TGF-β即可对卫星细胞的分化产生明显抑制效应。Marcia R Hathaway等[18]研究也发现,0.05~0.3 ng/ml的 TGF-β1可以对猪和牛的卫星细胞增殖产生明显的抑制效应。此外也有研究发现,TGF-β1的生物学效应受到其他生长因子的影响。Douglas R Cook[13]在研究中观察到,TGF-β1单独使用可以抑制猪卫星细胞的增殖,而 TGF-β1和FGF,IGF-I联合使用则可以促进猪卫星细胞的增殖;国内学者黎炜英等[2]也发现,bFGF和 TGF2β联合作用对体外培养骨骼肌卫星细胞的增殖起了重要作用。在骨骼肌疾病和损伤中,TGF-β对结缔组织增殖和纤维化起决定性作用,以往对 TGF-β的研究以体外细胞培养,TGF-β与器官的纤维化等为主,而对 TGF-β在运动性骨骼肌损伤中作用和变化的研究较少。
本研究对骨骼肌损伤修复过程中 TGF-β1转录水平和翻译水平的表达进行了综合研究和分析。RT-PCR结果显示,在运动后各组中除72h组外其余各组TGF-β1mRNA表达水平均低于对照组;免疫组化染色结果显示,TGF-β1阳性为棕褐色或棕黄色颗粒,主要分布在细胞质内,与前人研究结果[9]是一致的,与对照组相比,运动后各组蛋白表达量均下降。结果提示,尽管 TGF-β1在转录和翻译水平的表达变化不完全一致,但整体都较对照组呈下降趋势,说明 TGF-β1的表达在骨骼肌损伤修复过程中受到明显抑制。对照组中TGF-β1mRNA和蛋白均有一定的基础表达,这说明 TGF-β1在维持机体正常功能和形态方面可能是不可缺少的。
正常生理状态下卫星细胞处于静息状态,肌肉损伤时被激活进入分裂期,不断增殖,融合为肌管,最后分化为成熟的肌纤维[7]。一般认为,卫星细胞在损伤后2~3天内广泛增殖,在损伤发生3天以后卫星细胞退出细胞周期,或自我更新,或开始分化形成具有中央细胞核的肌管[14,17,19,21]。
本研究中一次下坡跑后0~72 h免疫组化结果显示, TGF-β1表达水平较对照组呈下降趋势,该时间段内骨骼肌卫星细胞主要处于活跃的增殖期,运动后即刻 TGF-β1蛋白的表达迅速下降超过1/3,反映了在运动性骨骼肌损伤后TGF-β1的表达是受到明显抑制的,TGF-β1mRNA的表达情况类似:各组的表达大多降低,其低值出现在运动后24 h,表达量不足对照组的一半,TGF-β1的低水平表达,可能与 TGF-β1受到其他正性调节因子的抑制效应有关,本课题组的另外研究发现,在该时间段内调节卫星细胞增殖的正性调节因子水平较对照组明显升高。此外, TGF-β1蛋白表达的迅速下降也可能与运动损伤引起TGF-β1外漏有关。作为一种小分子的蛋白多肽,TGF-β1在肌纤维损伤后,由于细胞膜通透性增强很容易外漏进入其他组织和血液中。Czarkow ska-Paczek B采用酶联免疫法检测血清内的 TGF-β1,研究发现一次急性运动后人体血清内 TGF-β1表达水平上升[12]。与此相似,Hering S等[15]研究也发现,4周的运动训练过程中,2周内血清内的TGF-β1水平明显升高,3~4周 TGF-β1水平持续下降。
骨骼肌损伤72 h后即炎症反应后期,此时卫星细胞开始分化。本研究中骨骼肌损伤1周后,肌纤维形态结构趋于正常,2周后形态基本恢复正常,骨骼肌再生修复应进入后期。但此时TGF-β1mRNA表达水平和蛋白表达水平均明显低于对照组(P<0.05),据此推测此时卫星细胞可能仍处于分化融合阶段,损伤修复尚未完全完成,仍在进行中,TGF-β1依然受到抑制,其具体机制仍有待于进一步研究。
TGF-β在骨骼肌再生修复过程中的高表达可能会影响修复的进行并造成纤维化[10]。研究人类马方综合症(MFS)疾病小鼠动物模型实验中,缺少原纤维蛋白Ⅰ的小鼠体内TGF-β的活性明显增强,TGF-β活性增强抑制了骨骼肌再生[10]。另有报道称[6、23],在杜氏肌营养不良的病人肌肉内,TGF-β1有很高的表达,并且 TGF-β1与纤维化的形成密切相关。该作者认为,肌营养不良发生后,肌肉开始变性,紧接着是肌肉逐渐坏死,炎症反应发生在坏死的区域,局部病灶释放 TGF-β1,并通过激活细胞外基质和结缔组织的增生,从而引起纤维化。Amemiya K[5]和Confalonieri P[11]在皮肤炎病人的肌肉活检标本中,观察到了过量的TGF-β1,他们认为过量的 TGF-β1导致慢性炎症,纤维化和细胞外基质的累积。
上述研究的共同特征是骨骼肌损伤或变性较严重,肌肉坏死和炎症反应明显,在肌肉损伤后数天非常活跃,肌肉再生发生在损伤后7~10天内,再生过程在2周内达到高峰,在肌肉损伤后3~4周开始减慢,疤痕组织即纤维化的形成在损伤后2~3周内发生[16]。
骨骼肌再生所需的时间以及修复情况与损伤的严重程度有关,如果损伤较轻,肌纤维膜完整,则损伤在1~2周内可以愈合,如果损伤严重,则损伤后3周才可以愈合,并伴有疤痕组织形成。可见由于损伤程度的不同造成两种不同的修复结果:完全再生和瘢痕(或部分瘢痕)修复。本实验通过形态学观察可见:2周组腓肠肌肌膜完整性良好,肌纤维形态结构基本恢复正常,未见纤维化和瘢痕组织形成,这表明本实验骨骼肌损伤后可以实现完全再生,该损伤仍应属于“微损伤”的范畴,不同于以上研究。
4 小结
1.一次下坡跑运动能够明显引起运动性骨骼肌损伤,骨骼肌损伤发生2周后基本恢复正常,且未见纤维化形成。
2.骨骼肌损伤修复过程中 TGF-β1的表达整体呈下降趋势,生物活性受到明显抑制。
[1]李宏云,陈世益,陈疾忤,等.注射携人IGF-1基因的成肌细胞对小鼠损伤骨骼肌内源性m IGF-1表达的影响[J].中国运动医学杂志,2008,27(5):584-587.
[2]黎炜英,朱卫雄,刘丹.bFGF、TGF2β联合使用对大鼠骨骼肌卫星细胞增殖能力的影响.[J].武汉大学学报(医学版),2007,28 (6):733-736.
[3]向峥,孙林辉,余斌.碱性成纤维细胞生长因子mRNA在运动性肌损伤骨骼肌中的表达[J].华南国防医学杂志,2007,21(3): 28-30.
[4]肖卫华,陆耀飞.骨骼肌损伤后修复过程中机械生长因子作用研究[J].体育科学,2008,28(6):34-38.
[5]AMEM IYA K,SEM INO-MORA C,GRANGER RP,etal. Dow nregulation of TGF-beta 1 mRNA and p rotein in the muscles of patients w ith inflammato ry myopathies after treatment with high-dose intravenous immunoglobulin[J].Clin Immunol 2000,94:99-104.
[6]BERNASCON IP,TORCH IANA E,CONFALON IERIP,etal. Exp ression of transforming grow th factor-beta 1 in dystrophic patient muscles correlates withflbrosis.Pathogenetic role of aflbrogenic cytokine[J].J Clin Invest,1995,96:1137-1144.
[7]BRUNO P,M ICHAEL R,YVAN T,etal.Stem and p rogenitor cells in skeletal muscle development,maintenance,and therapy [J].Mol Ther,2007,15(5):867-77.
[8]BYRON J FALER,ROBYN A,DAHL IA PLUMM ER,etal. Transforming grow th factor-βand wound healing[J].Perspect Vascular Surgery Endovascular Therapy,2006,18:55-62.
[9]CHERYL A S,FRANCIOSE S,CHRISTOPHER W,etal. Transforming grow th factor-βfollowing skeletal muscle strain injury in rats[J].J App l Physiol,2007,102:755-761.
[10]COHN R D,VAN C E,HABASHIJ P,etal.Angiotensin II type 1 recep tor blockade attenuates TGF-beta-induced failure of muscle regeneration in multiple myopathic states[J].Nat Med,2007,13:204-210.
[11]CONFALON IERI P,BERNASCON I P,CORNEL IO F,etal. Transforming grow th factor-beta 1 in polymyositis and dermatomyositis correlates w ith fibrosis but not with mononuclear cell infiltrate[J].JNeuropathol Exp Neurol,1997,56:479-484. [12]CZARKOWSKA-PACZEK B,BARTLOM IEJCZYK I,PRZYBYLSKIJ.The serum levels of grow th factors:PDGF,TGF-beta and VEGF are increased after strenuous physical exercise [J].J Physiol Pharmacol,2006,57:189-197.
[13]DOUGLAS R COOK,MA TTEW E DOUM IT,ROBERT A MERKEL.Transforming grow th factor-beta,basic fibroblast grow th factor,and platelet-derived grow th factor-BB interact to affect p roliferation of clonally derived porcine satellite cells [J].J Cellular Physiol,1993,157:307-312.
[14]GREGORY R A.Satellite cell p roliferation and skeletalmuscle hypertrophy[J].Appl Physiol Nut Metab,2006,31:782-790.
[15]HERING S,JOST C,SCHULZ H,etal.Circulating transfo rming grow th facto rβ1(TGFβ1)is elevated by extensive exercise[J].Eur J App l Physiol,2002,86:406-410.
[16]JOHNN Y HUARD,YONG L I,FREDD IE H F U.M uscle injuries and repair current trends in research[J].J Bone Joint Surg Am,2002,84:822-832.
[17]JUDY E A,ASHLEY C W.Satellite cell activation on fibers: modeling events in vivo-an invited review[J].Can J Physiol Pharmacol,2004,82:300-310.
[18]MARCIA R H,JR HEMBREE,MARY S PAMPUSCH,etal. Effect of transforming grow th factor beta-1 on ovine satellite cell p roliferation and fusion[J].J Cellular Physiology,1990, 146:435-444.
[19]N ICOLAS F,MALGORZA TA D,CHRISTOPHE M,etal. M uscle stem cells and model system s fo r their investigation [J].Developmental Dynamics,2007,236:3332-3342.
[20]RONALD E.A IIEN,L INDA K.BOXHORN.Inhibition of skeletal muscle satellite cell differentiation by transforming grow th factor-beta[J].J Cellular Physiol,1987,133:567-572.
[21]SH IX Z,DANM IEL J G.Muscle stem cells in development,regeneration,and disease[J].Genes Dev,2006,20:1692-1708.
[22]TA TSUM IR,ANDERSON J E,NEVORET C J,etal.HGF/ SF is p resent in normal adult skeletal muscle and is capable of activating satellite cells[J].Dev Biol,1998,(194):114-128.
[23]YAMAZA KIM,M INOTA S,SAKURA I H,etal.Exp ression of transforming grow th factor-beta 1 and its relation to endomysial fibrosis in p rogressive muscular dystrophy[J].Am J Pathol,1994,14:221-226.
