水生实验动物剑尾鱼的DNA指纹图谱构建
2011-02-01全迎春刘宇飞白俊杰
全迎春,刘宇飞,2,白俊杰
(1.中国水产科学研究院珠江水产研究所,广州 510380;2.上海靖丽信息科技有限公司,上海 200235)
剑尾鱼(Xiphophorus hellerii)又名青剑、剑鱼,属花鳉科(Opecilidae),是小型热带淡水鱼。具有食性杂、繁殖周期短、适应性强,容易饲养等优点[1,2]。研究调查结果显示剑尾鱼对多种农药、重金属等毒物较敏感,还对某些鱼类病原体敏感性强,以及存在盲眼、畸形等诸多突变性状,适合作为动物模型[1-3]。1987年,珠江水产研究所开始了剑尾鱼实验动物化研究,通过定向培育和系统研究,育成RRB(红眼红体)、RW-H(红眼白体)、BY-F(黑眼橘红体)三个品系[1,3]。其中代表品系RR-B系剑尾鱼近交达30代,通过了全国水产原种和良种审定委员会审定,农业部第348号公告公布:剑尾鱼RR-B系是适用于水环境监测[4]、水产药物安全性评价[5]、化学品毒性检测[6]、动物疾病检验模型[7]及遗传生物学研究[8]等领域的水生实验动物。
传统的品种鉴定方法存在很多不足,且易受环境影响、不能鉴定基因混杂程度等,而DNA指纹图谱直接反映品种之间以及个体之间基因组序列的差异,具有多位点性、高变异性、简单而稳定的遗传性,近年来引起人们的重视,表现出巨大的实用价值[9]。剑尾鱼作为一种重要的水生实验动物,其种质资源的鉴定方法仍有待完善,因此,本研究应用扩增稳定、清晰的46个微卫星位点,对RR-B系(红眼红体)、RW-H系(红眼白体)、野生种三个品系剑尾鱼进行DNA指纹图谱构建,并将形成的数字化指纹输入珠江水产研究所鱼类种质鉴定软件V1.0形成种质鉴定数据库。该图谱不仅能呈现出剑尾鱼的遗传概貌,用于剑尾鱼选育系及其野生品种的鉴定,而且也为水生实验动物剑尾鱼的品种选育和知识产权保护提供理论依据。
1 材料和方法
1.1 实验鱼
RR-B系剑尾鱼30尾(雌雄各15尾),从珠江水产研究所水生实验动物培育基地随机抽取;RWH系剑尾鱼30尾(雌雄各15尾),取自珠江水产研究所水生实验动物培育基地,已选育至15代;野生型剑尾鱼(非选育群体)购自广州观赏鱼市场。
1.2 基因组DNA样品的制备
取剑尾鱼背鳍约10 mg,参考《分子克隆试验指南》[10]方法提取基因组DNA。0.8%琼脂糖电泳检测DNA的完整性和纯度并用紫外分光光度计(Eppendorf BioPhotometer)检测其浓度,-20℃冰箱保存备用。
1.3 微卫星引物合成、PCR扩增及电泳
参考已报道的文献[11-12]及剑尾鱼中心网站中有关 微 卫 星 的 数 据 (www.xiphophorus.org/-m icrosats/microsat.htm),选取有多态性的微卫星引物50对,由上海英骏公司合成。PCR反应总体系为10μL,含有10×Buffer 1.0μL,MgCl2(25 mmol/L) 0.3~0.6μL,dNTPs(10 mmol/L)0.2μL,上、下游引物(20 mmol/L)各 0.5μL,Taq酶 0.5 U,模板DNA 50 ng左右。PCR反应程序为94℃预变性3 m in后进入循环体系,94℃变性30 s,各引物退火温度48~60℃,退火时间30 s,72℃延伸45 s,25个循环,最后72℃延伸7 min。以8%聚丙烯酰胺凝胶电泳检测PCR扩增产物,取3μL产物电泳,硝酸银染色,染色方法参照文献[13]。
1.4 微卫星位点的筛选
以8尾野生剑尾鱼的 DNA样本为模板,调节PCR的温度(48℃ ~60℃)、镁离子浓度(终浓度0.5~1.5 mmol/L),使PCR达到最佳扩增效果。挑选扩增效果稳定,电泳条带清晰的微卫星位点用于剑尾鱼DNA指纹图谱的构建。
1.5 数据统计与分析
PCR产物经聚丙烯酰胺凝胶电泳,银染显带后用扫描仪扫描,根据凝胶上DNA泳动距离,用Gel-pro analyzer 4.5软件分析条带大小。统计剑尾鱼个体在各个位点的条带大小,用Excel软件绘制散点图,从而形成3个群体的指纹图谱模式图。选取在3个剑尾鱼品系中具有特异扩增条带的5对微卫星引物形成数字化指纹,以便于3个品系及其杂交种的鉴定。
2 结果
2.1 剑尾鱼RR-B系、RW-H系及野生群体的微卫星扩增结果
用8尾剑尾鱼个体进行预实验,筛选合成的50对引物,经PCR条件优化,选取扩增结果稳定、条带清晰的引物,共筛选出46对引物。然后使用这些微卫星标记对剑尾鱼RR-B系、RW-H系及野生群体进行基因组扫描,46个位点在3个群体中共找到等位基因106个,平均每个位点2.3个,部分扩增结果见图1。
微卫星标记遵循孟德尔遗传法则,呈共显性遗传,因此能很好的区分纯合子和杂合子。如图1中,微卫星位点Msc036具有3种等位基因型,纯合个体仅扩增出其中一条带型,杂合个体则可扩增出其中二条带型,图中RR-H系剑尾鱼在位点Msc036为纯合。结果发现剑尾鱼 RR-B系在42个微卫星位点上表现为纯合、单态性,等位基因纯合率为91.3%; RW-H系则为43个位点纯合、单态性,等位基因纯合率为且为93.5%;而这些野生群体在这些位点(除位点Msb030外)则表现为杂合,反映出这2个选育系已经具有了很高的遗传纯度。

图1 剑尾鱼3个群体在微卫星位点Msc036的扩增产物电泳图Fig.1 Electrophoregram of locus Msd036 in three swordtail fish populations
2.2 剑尾鱼微卫星DNA指纹图谱模式图构建
采用Excel软件,根据46对微卫星引物在3个剑尾鱼群体中PCR扩增条带的大小,绘制剑尾鱼微卫星DNA指纹图谱模式图(见图2~4)。

图2 剑尾鱼RR-B系的微卫星DNA指纹图谱Fig.2 DNA fingerprinting of RR-B strain of Xiphophorus helleri using Microsatellites
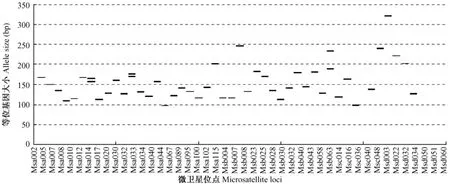
图3 剑尾鱼RW-H系的微卫星DNA指纹图谱Fig.3 DNA fingerprinting of RW-H strain of Xiphophorus helleri using M icrosatellites

图4 剑尾鱼非选育系的微卫星DNA指纹图谱Fig.4 DNA fingerprinting of wild Xiphophorus helleri using Microsatellites
2.3 剑尾鱼品系鉴定标记及其数字化指纹
选取在剑尾鱼RR-B系、RW-H系和非选育系中具有特异扩增条带的5对微卫星引物,根据扩增条带的大小,有带的记为1,无带的记为0,形成每个品系对应的数字化指纹,具体数据见表1。

表1 剑尾鱼特异微卫星标记的数字化指纹Tab.1 The digital fingerprint of Xiphophorus helleri on strain-specialm icrosatellite loci
2.4 剑尾鱼DNA指纹图谱鉴定数据及软件应用
珠江水产研究所鱼类种质鉴定软件 V1.0 (PRIFRI1.0)是由珠江水产研究所根据鱼类 DNA指纹数据特点开发的鱼类种质鉴定软件,已获得软件著作权(证书号2010SR026776)。将剑尾鱼数字化指纹数据根据软件要求整理成DNA指纹图谱数据库(如图5所示),该软件可从已建立的剑尾鱼指纹图谱数据库中挑选任意几个位点所形成的数字化指纹作为标准,以EXCEL形式导入软件,应用软件中已嵌入的计算公式,经基因频率、遗传相似度等计算,快速准确的鉴定的某一未知个体与各已知品系的相似度并确定其种群分类归属。
以剑尾鱼RR-B系的第一个个体在其中5个微卫星位点(Msa007、Msa008、Msa010、Msa012和Msa014)的数据“11000 010 01 010 10000”为例,输入该软件后,运行软件,结果如下图所示:
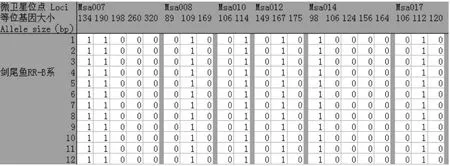
图5 剑尾鱼DNA指纹数据库示意图Fig.5 Part of the DNA fingerprinting database of Xiphophorus helleri

图6 剑尾鱼种质资源鉴定软件的运行示意图Fig.6 The software operation schematic of Xiphophorus germplasm resources appraisal software,PRIFRI1.0
3 讨论
实验动物是医学、生命科学研究的基础和重要支撑条件,在疾病模型的构建、药物安全性评价、环境污染监测、发育生物学、分子生物学等众多领域发挥着越来越重要的作用,剑尾鱼在应用中具有明显的特色与优势,具有广阔的应用前景。近交系动物中微卫星长度变化发生率很低,近交系实验动物的显著特征是基因纯合性及遗传稳定性,用于实验重复性好,可比性强,微卫星位点的等位基因则可成为某一近交系动物的恒定参数[14-15]。
剑尾鱼种质资源监测及近交系纯度鉴定是剑尾鱼作为实验动物的基础。微卫星DNA是对DNA的直接反应,要比生化标记更准确、可靠,已经广泛应用到大小鼠、仓鼠、沙鼠、家兔、犬、猴和猪等常用实验动物的遗传监测当中[16-17]。本研究构建的微卫星DNA指纹图谱可以用作剑尾鱼品种鉴定,这几个品系间具有特异扩增条带的5个微卫星标记将较好的用于区分剑尾鱼的不同品系,同时PRIFRI1.0软件的应用也将简化种质鉴定步骤。另一方面微卫星DNA指纹也可用于剑尾鱼品系的纯度检测。欧阳兆和等[18]用14个微卫星DNA对10个近交系小鼠多态分析表明,这些微卫星DNA在同一品系不同个体间表现为单态性,在不同品系间表现为多态性,可快速、经济的对近交系小鼠进行遗传检测和纯度鉴定。本研究中46个微卫星标记扩增的结果显示,在野生型剑尾鱼中表现为多态性的46个微卫星DNA标记,在RR-B系和RW-H系中分别有42和43个标记表现为单态,基因纯合率为91.3%、93.5%。这与李凯彬用生化标记方法检测出结果一致[8],也证明了微卫星标记在实验动物遗传监测中应用的可行性。
[1]吴淑勤,黄志斌.水生实验动物——剑尾鱼[M].北京:中国农业出版社,2005.
[2]黄志斌,吴淑勤,石存斌,等.剑尾鱼的若干生物学特性研究[J].中国水产科学,2000,7(3):107-109.
[3]Wu S,Huang Z,Yu R,et a1.Approach for the app lication of Xiphophorus helleri as experiment anima1[C].Proceeding of the Fourth Asian Fisheries Forum,1995.101-107.
[4]王春凤,方展强.汞和硒对剑尾鱼的急性毒性及其安全浓度评价[J].环境科学与技术,2005,28:32-35.
[5]聂湘平,王翔,李凯斌,等.抗生素药物环丙沙星对剑尾鱼的毒性效应[J].中山大学学报(自然科学版),2007,46(5):70 -73.
[6]常藕琴,石存斌,潘厚军,等.剑尾鱼硫酸铜急性中毒的病理学研究[J].动物医学进展,2005,26(7):82-85.
[7]潘厚军,吴淑勤,李凯彬,等.剑尾鱼在检测细菌毒力方面的应用[J].水产学报,2000,24(5):467-471.
[8]李凯彬,姜兰,潘厚军,等.RR-B系剑尾鱼LDH和GDH同工酶的分析[J].中国比较医学杂志,2004,13(3):46-50.
[9]王忠华.DNA指纹图谱技术及其在作物品种资源中的应用[J].分子植物育种,2006,4(3):425-430.
[10]萨姆布鲁克,弗里奇,曼尼阿蒂斯.分子克隆实验指南:第2版[M].北京:科学出版社,1999.
[11]李霞,白俊杰,吴淑勤,等.剑尾鱼RW-H近交系的遗传结构分析[J].水产学报,2004,28(4):365-370.
[12]李霞,白俊杰,吴淑勤,等.剑尾鱼微卫星DNA的筛选[J].中国水产科学,2004,11:196-201.
[13]张春雷,佟广香,匡友谊,等.微卫星产物变性与非变性PAGE-银染方法比较[J].水产学杂志,2010,23(1):11-14.
[14]Dallas JF.Estimation of microsatelite mutation rates in recombinant inbred strains ofmouse[J].Mammalian Genome,1992,3:452-456.
[15]Martinez AM ,Delgado JV,Roder A.Genetic structure of the Ibereian pig breed using microsatellites[J].Animal Genetics,2000,31:295-301.
[16]李瑞生,胡娟峰,曾林,等.微卫星DNA标记在常用实验动物遗传多态性的研究进展[J].中国比较医学杂志,2008,10:81 -81.
[17]李瑞生,陈振文,李晓娟,等.微卫星DNA标记在常用实验动物遗传监测中的分析[J].中国比较医学杂志,2010,10:75 -76.
[18]欧阳兆和,陈振文,李瑞生等.微卫星DNA多态性在十种近交系小鼠遗传监测中的应用研究[J].中国比较医学杂志,2004,14(2):71-74.
