IL-19对哮喘模型大鼠气道平滑肌细胞增殖的影响
2011-02-01李年珍张焕萍柴景伟
李年珍,张焕萍,柴景伟,张 彬
(1.山西医科大学,太原 030001;2.山西医科大学第一临床医学院呼吸内科,太原 030001)
气道平滑肌细胞(ASMCs)在哮喘气道慢性炎症、气道高反应性及气道重塑中均具有十分重要的作用。近年来研究表明,ASMCs不仅具有收缩和增殖功能,而且还有分泌功能[1]。ASMCs可分泌一些细胞因子、炎症因子和趋化因子,这些介质又可作用于ASMCs对细胞的增殖、凋亡进行调节。ASMCs在哮喘的发病及进展中扮演很重要的角色。IL-10在哮喘中的作用比较明确,IL-10对气道炎症起抑制作用。因IL-19与IL-10具有同源性,推测 IL-19也具有和 IL-10相似的生物学活性[2-4]。关于 IL-19的生物学作用尚存在争议。IL-19对哮喘的具体作用尚无相关报道。
本实验通过制备大鼠哮喘模型,培养大鼠叶支气管ASMCs,用不同浓度的IL-19干预细胞生长,观察ASMCs的增殖的变化。探讨IL-19对体外培养的哮喘平滑肌细胞增殖中的作用。
1 材料和方法
1.1 实验材料
卵清白蛋白(ovalbumin,OVA)、Ⅰ型胶原酶(collagenase)为美国 Sigma公司产品;DMEM培养基(Gibco公司);胎牛血清(杭州四季青生物所);小鼠抗α平滑肌肌动蛋白(α-actin)单克隆抗体购自博士德公司;白细胞介素-19(IL-19)购自美国Peprotech公司。余为进口或国产试剂,分析纯。
1.2 方法
1.2.1 大鼠哮喘模型的建立 健康雄性 W istar大鼠,体重200~250 g,由山西医科大学实验动物中心提供[SCXK(普)070101]。适应性喂养1周后,第1天大鼠腹腔注射含100 mg OVA和200 mg氢氧化铝的生理盐水1 m L,同时腹腔注射百日咳杆菌疫苗1 m L(约6×109个菌株)作为佐剂,第8天重复致敏1次,第15天开始激发,将大鼠置于特制玻璃容器内,用超声雾化器喷入2%OVA生理盐水50 m L,激发30 m in,每天1次,激发8周。激发后大鼠出现烦躁、呛咳、呼吸加快及轻度紫绀等哮喘发作症状。正常大鼠以等量生理盐水代替OVA注射,并吸入生理盐水50 mL8周。
1.2.2 ASMCs的分离、培养及鉴定 参照 Johnson等[5]的培养方法,上述大鼠腹腔注射25%乌拉坦(4 m L/kg)麻醉后,开胸迅速取出肺脏置于预先冰浴的D-hanks’溶液,在解剖显微镜下仔细分离出叶支气管,并将支气管外膜剥离干净,刮除内皮,将获得的单层ASM在青霉素小瓶中剪成1 mm×1 mm的小块后,加入1 g/LⅠ型胶原酶,37℃,5%CO2培养箱中消化1 h后加入DMEM液,混匀后用金属滤网过滤,滤液置离心管内1000 r/m in离心6 min。弃上清后,沉淀的细胞用含20%FBS、青霉素100 U/m L、链霉素100 U/m L的DMEM培养液重悬,接种到培养瓶内,让细胞贴壁生长。原代培养的细胞生长约7~10 d后融合。0.25%胰蛋白酶消化传代,以含10%FBS、青霉素100 U/m L、链霉素100 U/m L的DMEM培养液传代培养,每3~4d换液1次,约4~5 d细胞长满后传代,3~8代的细胞用于实验。小鼠平滑肌α-肌动蛋白(α-actin)免疫细胞化学染色鉴定为ASMCs[6]。
1.2.3 实验分组 取第3~8代培养的大鼠气道平滑肌细胞,0.25%胰蛋白酶消化,台盼蓝染色法计数,细胞存活率大于96%。用含10%FBS的DMEM培养,待细胞90%融合后,换无血清DMEM培养24 h,使细胞生长同步于 G0期,换用含 10%FBS的DMEM液,随机分为5组:(1)对照组:培养的正常大鼠ASMCs,每孔/瓶中不加任何干预;(2)哮喘组:培养的哮喘大鼠ASMCs,每孔/瓶中不加任何干预; (3)、(4)、(5)组分别为不同浓度的 IL-19干预组:培养的哮喘大鼠 ASMCs,每孔/瓶中分别加入终浓度为1μg/L、10μg/L、100μg/L的 IL-19放入 CO2培养箱中共培养12 h,进行下述实验。每4个复孔/瓶为一组,实验重复3次。
1.2.4 细胞增殖检测
1.2.4.1 流式细胞仪分析 ASMCs细胞周期:
ASMCs按106/m L的密度接种于100 cm2的培养瓶,培养及分组如前述,收集的ASMCs用PBS液配制成浓度为1×106个/m L的细胞悬液,用预冷的75%乙醇固定,加入 RNA酶、碘化丙啶室温作用后,用FACSort型流式细胞仪(美国BD公司)Cellquest软件分析细胞周期中各期所占的百分比。
1.2.4.2 四甲基偶氮唑蓝(MTT)微量比色法测定ASMCs增殖: 96孔板内的ASMCs培养结束时,每孔加MTT(5 g/L)20μL,培养4 h后去培养液,加二甲基亚砜150μL振荡30 min,使结晶物充分溶解。酶联免疫检测仪于490 nm处测定各孔A值。
1.2.5 统计学方法 应用统计分析软件包SPSS13.0进行统计学分析。实验数据以均数±标准差表示。组间差异显著性检验采用方差分析,两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞鉴定
在倒置显微镜下,经原代培养的 ASMCs呈梭形,有较长的突起,圆形的细胞核位于细胞中央,呈疏密相间、典型“峰和谷”生长状态(彩插2图1)。α-actin免疫细胞化学染色,免疫反应产物呈棕黄色。97%细胞α-actin染色阳性,所培养的细胞为平滑肌细胞[6](彩插2图2)。
2.2 流式细胞仪分析 ASM Cs细胞周期
与对照组ASMCs比较,哮喘组ASMCs的G0/G1期细胞所占比例明显减少(P<0.01),S期细胞所占比例增高(P<0.01),表明处于有丝分裂期的细胞数目增多。而加入不同浓度 IL-19共培养 12 h后,10μg/L、100μg/L IL-19干预组 S期细胞所占比例较哮喘组都明显下降(P<0.01),但仍高于对照组(P<0.01)(表1和图3)。同时这两个浓度IL-19干预组ASMCs的G0/G1期细胞所占比例较哮喘组明显增高(P<0.01),但仍低于对照组(P<0.01)。且上述两个指标两个浓度干预组间比较有差异(P<0.01)。但1μg/L IL-19干预组以上指标与哮喘组并无统计学差异(P>0.05)。
2.3 M TT检测ASM Cs增殖
与对照组相比,哮喘组ASMCs A值显著增加(P<0.01),10μg/L、100μg/L IL-19干预组ASMCs A值较哮喘组相比均显著降低(P<0.01),但仍高于对照组(P<0.01)(表1和图4)。而1μg/L IL-19干预组ASMCs A值与哮喘组并无统计学差异(P>0.05)。
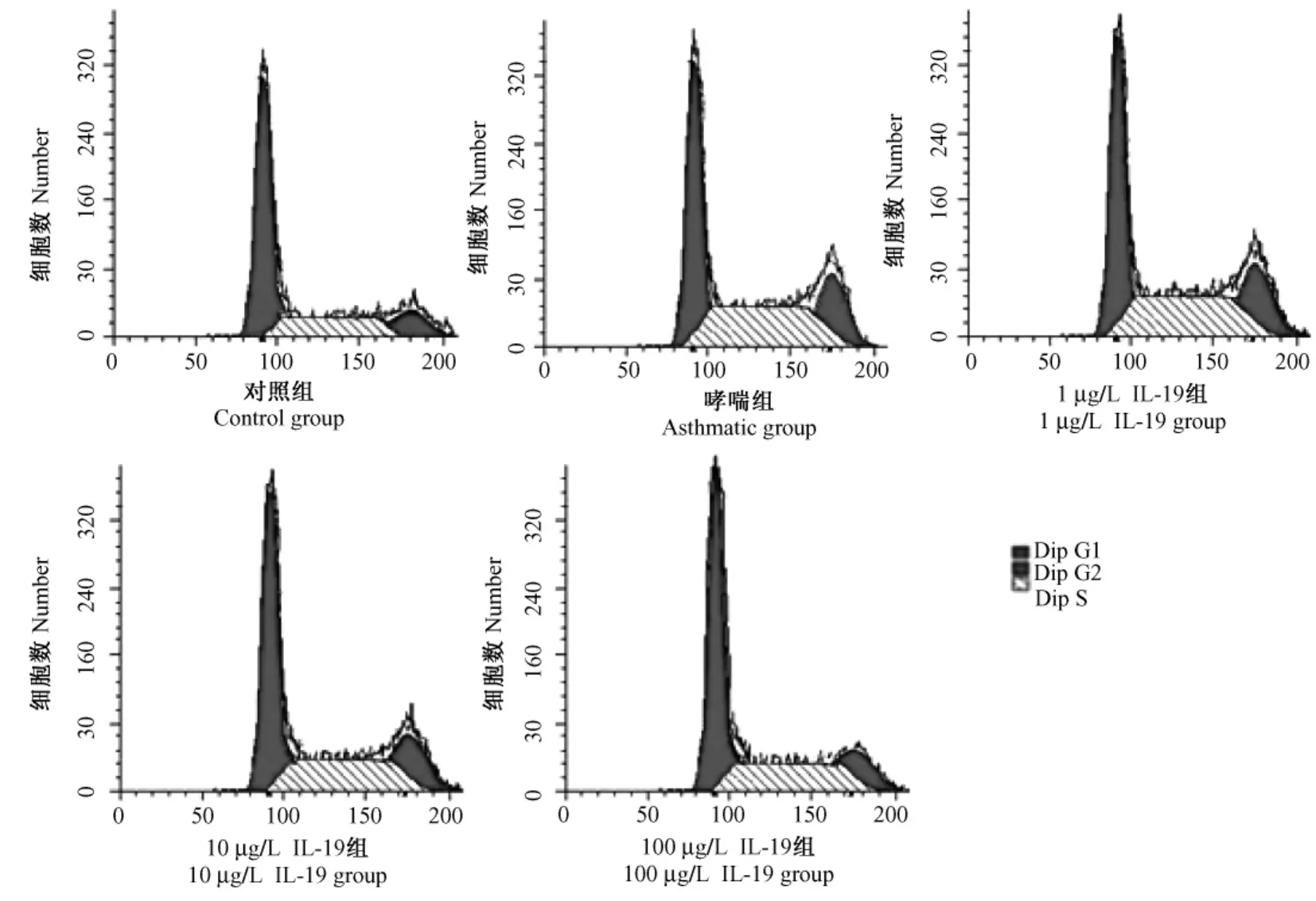
图3 流式细胞仪分析各组大鼠气道平滑肌细胞周期Fig.3 Analysis of cell cycle of ASMCs by flow cytometry
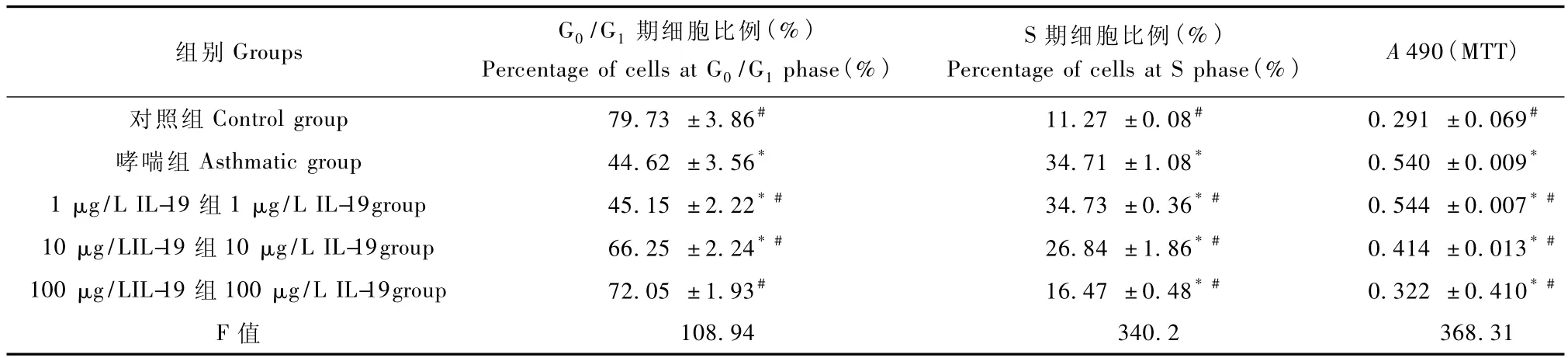
表1 IL-19对哮喘大鼠气道平滑肌细胞增殖的影响(n=3)Tab.1 IL-19effect on cell proliferation of ASMCs in asthmatic rats(n=3)
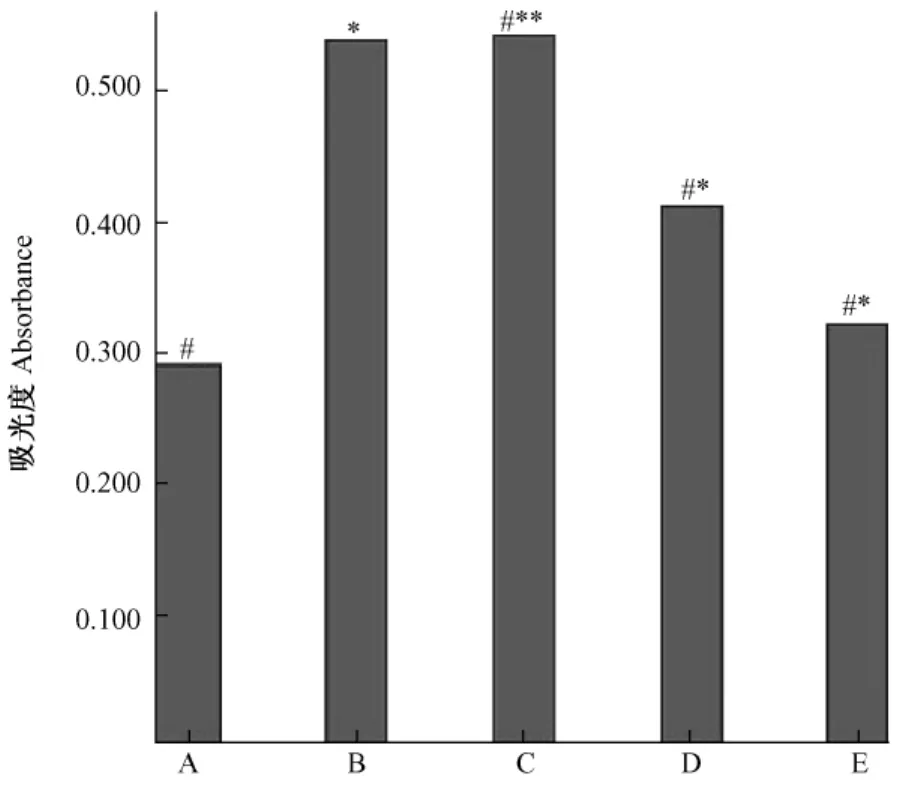
图4 MTT法检测各组大鼠气道平滑肌细胞的增殖A:对照组 B:哮喘组 C:1μg/L IL-19组D:10μg/L IL-19组 E:100μg/L IL-19组注:*P<0.01与对照组比较;#**P>0.05与哮喘组比较;#*P<0.01与哮喘组比较Fig.4 Proliferaion of ASMCs were detected by MTT A:Control group;B:Asthmatic group;C:1μg/L IL-19 group;D:10μg/L IL-19 group;E:100μg/L IL-19 group.Note:*P<0.01 compared with control group;#**P>0.05compared with asthmatic group;#*P<0.01 compared with asthmatic group
3 讨论
支气管哮喘是一种由多种炎症细胞、炎症介质和细胞因子共同参与并相互作用的气道慢性炎症性疾病。在气道炎症中,气道平滑肌细胞(ASMCs)不仅有收缩功能,而且有合成分泌炎症介质的功能。ASMCs在哮喘气道炎症、气道高反应性与气道重构中有重要作用。多种炎症介质和炎性细胞产物又可作用于ASMCs,对ASMCs的增殖进行调节。增殖的ASMCs使气道壁增厚,导致基础气道阻力增加和不可逆性气流受限的发生。
白细胞介素-19(IL-19)是新近发现的 IL-10超家族成员中的一员。IL-10被广泛认为是系统性的抑制炎症反应的细胞因子[7]。因 IL-19与IL-10具有同源性[8],推测IL-19也具有和IL-10相似的生物学活性。关于IL-19的生物学作用尚存在争议。在Sommerville[9]研究IL-19对受损血管平滑肌的作用过程中,发现在它可使受损血管平滑肌增殖减少。但它对哮喘大鼠气道平滑肌细胞的作用目前还尚无报道。实验结果表明:一定浓度 IL-19可使慢性哮喘大鼠气道平滑肌细胞增殖减弱,处于增殖期的细胞数目减少。提示IL-19对体外培养的哮喘气道平滑肌细胞有抑制增殖的作用。这与IL-19可使受损血管平滑肌增殖减少的报道一致。我们还发现随着IL-19干预浓度的增高,处于增殖期的细胞比例逐渐减少但仍高于正常对照组,提示可能所选择的IL-19干预浓度仍较低,或者ASMCs上还可能存在其它类型的促进细胞增殖的信号转导通道,有待进一步研究。
以上实验结果表明,一定浓度的 IL-19可以抑制哮喘大鼠ASMCs的增殖。目前对于已形成的气道重塑当前尚无特效药物,大力加强防治哮喘气道重塑药物的研究势在必行,本课题为哮喘的防治提供了新思路。关于IL-19抑制哮喘气道平滑肌细胞增殖的具体机制还未完全阐明,有待进一步研究。
[1]Chung KF.Airway smooth muscle cells:contributing to and regulating airway mucosal inflammation[J]?Eur Respir J,2000,15(5):961-968
[2]Dumoutler L,Leemans C,Lejeune D,et al.[J].J Immunol,2001,167(7):3545-3549.
[3]Wolk K,Kunz S,Asadullah K,et al.[J].J Immunol,2002,168 (11):5397-5402.
[4]Fickenscher H,Hor S,Kupers H,et al.[J].Trends Immunol,2002,23(2):89-96.
[5]Johnson PR,Roth M,Tamm M,et al.Airway smooth muscle cell proliferation is increased in asthma[J].Am J Respir Crit Care Med,2001,164(3):474-477.
[6]Bai J,Liu XS,Xu YJ,et al.Extracellular signal-regulated kinase activation in airway smooth musclle proliferation in chronic asthmatic rats.Acta physiologica sinica,June,2007,59(3):311 -318
[7]Parrish-Novak J,Xu WF,Brender Ty et al.[J].Biological Chemistry 2002,12(6):47517
[8]Gallagher G,Dickensheets H,Eskdale J,et al.[J].Genes Immun,2000,1(7):442-450.
[9]Tian Y,Laura J,Sommervill,et al.[J].The American Joumal of Pathology,2008,173:901-909
[10]Kavurma MM,Khachigian LM.ERK,JNK and p38 MAP kinases differentially regulate Proliferation and migration of phenotypically distinct smooth muscle cell subtypes[J].JCell Biochem,200-3,89(2):289-300.
