硫糖铝在体外对抗幽门螺杆菌HpaA IgY的保护作用评价
2011-01-30邓西川胡晓莉沈旭东杨致邦
邓西川 黄 伟 戴 维 胡晓莉 沈旭东 杨致邦*
(1 重庆医科大学基础医学实验教学中心病原生物学与免疫学实验室,重庆 400016;2 西南大学荣昌校区动物医学系,重庆 402460;3 重庆医科大学临床医学五年制2007级4班,重庆 400016)
大量研究已经表明,幽门螺杆菌(Helicobacter pylori,HP)是人类常见的感染病原之一,是多种胃疾病的生物致病因素,也是发生胃癌的重要危险因素,世界卫生组织已将其列为第一类生物致癌因子[1],防治HP感染具有重要的临床意义。
近年来,许多研究已经证实口服卵黄免疫球蛋白(immunoglobulin yolk,IgY)可通过被动免疫有效防治胃肠道感染性疾病[2,3],但在胃内,由于受到高酸性和高胃蛋白酶的生态环境的影响,使其应用受到限制。提高IgY对酸和蛋白酶的耐受性对口服IgY的开发具有重要意义。硫糖铝(sucralfate)作为抗消化性溃疡的制剂已在临床广泛应用。该药对胃黏膜具有黏附性,可与许多大分子物质如黏液、糖脂蛋白等结合;并可与胃黏膜表面的黏液结合形成复合的胶状物,起到黏膜保护作用[4]。
HP在胃内定植的关键环节是黏附,其黏附素(Helicobacter pylori adhesin A,HpaA)具有黏膜结合特性,由黏附素受体系统介导与宿主细胞发生特异性黏附,从而使HP定植于胃内[5]。本文制备抗HP的重组HpaA特异性IgY,将适当比例的硫糖铝加入HpaA IgY中,以提高HpaAIgY对酸和蛋白酶的耐受性,通过体外试验评价硫糖铝对HpaA IgY的保护作用。
1 材料与方法
1.1 材料
H.pylori重组菌DH5α-hpaA-pQE30为本实验室构建[6]并保存,Ni2+-NTA亲合层析柱为Qiagen公司产品;30周龄立克体鸡由西南农业大学荣昌分校生物中心提供,常规饲养;HRP标记的羊抗鸡IgG、羊抗人IgG购自Southern Biotech公司;检测血中抗HP特异性IgG的Western blot试剂盒购自上海元谷科技发展公司;HP选择培养基、LA培养基、ELISA试验中的抗原包被液、酶稀释液、显色剂等为本室配制;HpaA(+)血清为本实验室从HP阳性的患者血清筛选;胃蛋白酶购自Amresco公司产品;硫糖铝混悬液购自上海旭东海普制药公司。
1.2 方法
1.2.1 制备重组HpaA抗原
将表达菌DH5α-hpaA-pQE30接种于LA培养基中,37℃振摇培养16h。再转种于LA培养基中,37℃培养至细菌浓度达到A600=0.6时,用1mmol/L的IPTG诱导表达4h;再将菌液4℃、8500r/min离心10min;收集沉淀物超声碎菌,4℃、8500r/min离心45min;加入包涵体裂解液裂解2h,4℃、8500r/min离心45min,取上清液,用Ni2+-NTA树脂亲和层析纯化。纯化物用12%SDS-PAGE分析,用Bradford法测定纯化物的蛋白含量;用Western blot鉴定重组蛋白的抗原性;将重组蛋白免疫家兔,用间接ELISA法检测其血清的抗hpaA效价以鉴定其免疫原性;-70℃保存备用。
1.2.2 制备抗重组HpaA的IgY
以纯化的重组hpaA为抗原,参照黄进等[7]的方法,将重组hpaA与等量完全弗氏佐剂充分研磨乳化后接种洛曼母鸡[6]。初次接种剂量为100µg/只;15d后进行第2次接种,200µg/只;以后每隔1个月进行一次加强免疫,计量为300µg/只,共接种2次。在末次接种后1周开始收集鸡蛋,取出蛋黄液混合后,先用水稀释,再用氯仿粗提hpaAIgY,饱和硫酸铵法纯化,最后过滤除菌。纯化蛋白用12%SDS-PAGE分析,Bradford法测定IgY蛋白含量,间接ELISA法测定hpaAIgY效价,-20℃保存。
1.2.3 强酸下硫糖铝对HpaAIgY的保护作用观察
参照Kyong AL[8]的方法,用pH值分别为1.5、2.0、3.0的磷酸二氢钠缓冲液将hpaA IgY稀释后,分别加入10%~60%的硫糖铝(体积百分比),使IgY终浓度为1mg/mL;37℃维持2h后,立即加入适量的NaOH(2mol/L)中和,将pH值调至7.0,ELISA法测定IgY的A450值。将含1mg/mL pH7.0的IgY稀释液37℃维持2h作为参照,以IgY试验液的A450值与参照IgY的A450值之比测算IgY的剩余抗体活性,用(AR/AC)%表示。与同样条件处理但未加硫糖铝的IgY液为对照,评价硫糖铝对hpaA IgY的保护作用。
1.2.3.1 硫糖铝对胃蛋白酶裂解HpaAIgY的保护作用观察
参照Kyong AL[8]的方法,用pH 2.0、pH 3.0的磷酸二氢钠缓冲液将hpaA IgY稀释后,分别加入终浓度为0.02mg/mL的胃蛋白酶,再分别加入10%、30%、50%的硫糖铝,使IgY终浓度为1mg/mL;37℃维持4h,立即加入适量的NaOH(2mol/L),将pH值调至7.0,ELISA法测定IgY的A450值。以同样条件处理的未加胃蛋白酶和硫糖铝,pH7.0含1mg/mL的hpaA IgY稀释液作参照,并按前述方法计算其剩余抗体活性。以同样条件处理加胃蛋白酶未加硫糖铝的IgY液为对照,评价硫糖铝对胃蛋白酶裂解hpaA IgY的保护作用。
1.2.3.2 反复冻融下硫糖铝对特异性IgY的保护作用
用pH7.0的磷酸盐缓冲液稀释hpaA IgY,再分别加入10%、30%、50%的硫糖铝,使IgY的终浓度为1mg/mL,4℃反复冻融7次,每次间隔1h;以未冻融处理、未加硫糖铝、在4℃存放的同样稀释度的IgY为参照,ELISA法检测IgY的A450值,并按前述方法计算其剩余抗体活性。以同法处理的不加硫糖铝的IgY液为对照,评价在反复冻融条件下硫糖铝对hpaA IgY的保护作用。
2 结 果
2.1 重组hpaA抗原的制备
表达的重组hpaA蛋白经SDS-PAGE后凝胶扫描图象软件分析,破碎菌的上清与沉淀在相对分子质量30000处均可见明显的外源蛋白的表达带,约占全菌的70%。经纯化后可见单一条带,纯度达90%以上,见图1。Bradford法测定重组蛋白含量为1.08mg/mL。Western blot鉴定在相对分子质量30000处出现相应的条带,大小与预期的一致(图2)。ELISA法测得免疫后兔抗血清与VacA抗原反应的效价为1∶1280。

图1 重组HpaA蛋白表达的SDS-PAGE分析
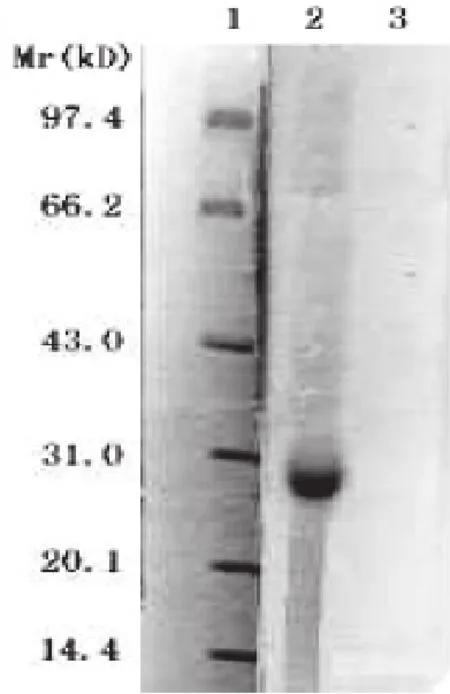
图2 重组HpaA蛋白的Western blot分析
2.2 抗重组hpaA特异性IgY的制备
蛋黄液纯化浓缩后,测得其hpaA IgY的蛋白含量为6.4mg/mL;经SDS-PAGE分析,在相对分子质量65000和25000处分别可见两条条带,与IgY重链和轻链的分子质量相符(图3),IgY的两重链及两轻链之和与总相对分子质量180×103相符合。凝胶扫描图象软件分析其纯度为72.0%。ELISA法测得I其效价为1∶12800。
2.3 各种保护作用的观察
2.3.1 强酸下硫糖铝对特异性IgY的保护作用
在强酸条件下,加入硫糖铝后抗体活性明显提高,并随硫糖铝浓度增高而提高。在pH 1.5条件下,未含硫糖铝的hpaA IgY的抗体活性仅能维持30.5.%;含30%硫糖铝的IgY的剩余抗体活性为35.4%,含50%硫糖铝的IgY可使剩余抗体活性提高到48.2%,含60%硫糖铝的IgY可使剩余抗体活性提高到65.8%。在pH 2.0条件下,未加硫糖铝之IgY剩余抗体活性为35.6%,含30%硫糖铝的IgY可使剩余抗体活性提高到85.4%,含50%的硫糖铝的IgY几乎可完全保持其抗体活性。在pH 3.0条件下,不加硫糖铝的IgY抗体活性能保持64.8%,30%硫糖铝即可使IgY抗体活性保持87.3%,而50%以上浓度的硫糖铝几乎可完全保持IgY的抗体活性(图4)。
2.3.2 硫糖铝对胃蛋白酶裂解特异性IgY的保护作用
在pH 2.0 、3.0和0.02mg/mL胃蛋白酶浓度条件下,加硫糖铝的hpaA IgY抗体的剩余活性随硫糖铝的浓度增高而提高。在pH 2.0 时,不加硫糖铝的IgY抗体的剩余活性为20.1%,含10%、30%、50%硫糖铝IgY的剩余活性分别为62.8%、71.6%、82.5%。在pH 3.0 时,不加硫糖铝的IgY抗体的剩余活性为42.4%,含10%、30%、50%硫糖铝IgY的剩余活性分别为75.6、87.4%、94.5%(图5)。与不加硫糖铝比较,差异有显著性(P<0.01)。

图3 纯化后IgY的SDS-PAGE分析
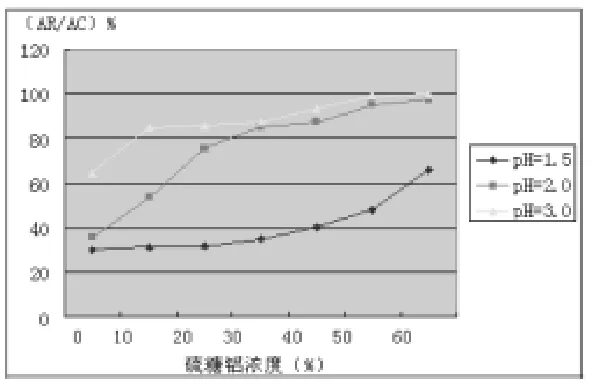
图4 在pH 1.5、2.0和3.0条件下加入0%~60%硫糖铝hpaA IgY的剩余抗体活性
2.3.3 反复冻融下硫糖铝对特异性IgY的保护作用
经反复冻融后,未含硫糖铝的IgY的剩余抗体活性下降至62.4%,加入硫糖铝后,随所含硫糖铝浓度的增高,其剩余抗体活性也提高。含10%硫糖铝的IgY可使其剩余抗体活性提高到70.6%,含30%硫糖铝的IgY可使其剩余抗体活性提高到82.7%,50%硫糖铝可提高到89.3%(图6)。

图5 在pH 2.0、3.0和0.02mg/mL的胃蛋白酶条件下加入10%、30%和50%硫糖铝的hpaA IgY的剩余抗体活性

图6 反复冻融下硫糖铝对HpaA IgY的保护作用
3 讨 论
高酸性和含高浓度的胃蛋白酶是胃内生态环境最主要的特点。陈剑秋等[9]对健康成人胃内24h pH值的动态检测表明,胃内pH值的基线为(1.63±0.34),当进食时pH值升高,胃内食物排空后降至基线水平。正常成人胃内的胃蛋白酶浓度为0.02 mg/mL,胃蛋白酶作用的最适pH为1.5~2.2,最适温度为37 ℃左右。因此,防治HP感染的制剂在胃内必须耐受高酸性和高蛋白酶的作用才能奏效。
Kyong等[10]的报道表明,当pH<3时,IgY的抗体活性可降低50%,在pH 2.0条件下4h,IgY几乎完全失活。在pH3.0条件下,加入30%山梨醇可显著提高IgY的稳定性,加入50%山梨醇可完全维持IgY的抗体活性。Xiao等[11]用壳聚糖-藻酸盐微胶囊包裹IgY,将胶囊置于pH3.0~6.0的模拟胃液中试验,其结果可使IgY活性维持到61.36%~74.61%。本文的结果表明,在IgY液中加入硫糖铝,可显著提高IgY在酸性环境中的稳定性,其保护作用明显优于糖类,也优于用壳聚糖-藻酸盐微胶囊包裹IgY。30%~50%硫糖铝可在胃内pH 2.0和含0.02mg/mL胃蛋白酶的模拟胃液环境中有效保护IgY的活性,提高IgY抗冻融力。
硫糖铝是一种含8个硫酸根的蔗糖硫酸酯铝盐(C12H30Al8O5lS8xAl(OH)3yH20),其硫酸蔗糖部分在碱性的氢氧化铝分子之间交联,为立体结构的桥形复合物,黏附性强,带负电荷,能与多种带正电荷的化学基团或大分子物质结合,如黏液、糖脂蛋白以及药物、金属等;也可与胃十二指肠黏膜表面的黏液结合,形成复合的胶状物,对黏膜起到保护作用[4,12]。硫糖铝遇酸解离之后,其氢氧化铝凝胶可发挥抗酸作用,不仅可缓解强酸环境,也可破坏胃蛋白酶作用的最适酸性环境。而且,硫糖铝本身可与胃蛋白酶络合,直接、持续地抑制胃蛋白酶的活性。用硫糖铝作为IgY的保护剂,不仅可降低胃酸和胃蛋白酶对IgY的破坏作用,还可发挥硫糖铝本身对胃黏膜的保护作用,是比较理想的IgY保护剂。因此,制备含硫糖铝的hpaA特异性IgY有望使IgY在胃内发挥更加有效的预防HP感染的作用。
[1] International Agency for Research on Cancer.Schistosomes,liver flukes and Helicobacter pylori[M].IARC Monograph on the Evaluation of Carcinggenic Risks to Human.Lyon: IARC,1994.
[2] Mine Y,Kovacs-Nolan J.Chiken egg yolk antibodies as therapeutics in enteric infections disease[J].J Med Food,2002,5(3):159-169.
[3] Suzuki H,Nomura S,Masaoka T,et al.Effect of dietary anti-Helicobacter pylori-urease immunoglobulin Y on Helicobacter pylori infection[J].Alimentary Pharmacology and Therapeutics,2004,20(9):185-192.
[4] Ochi Kiyoshige.Chemistriy of sucralfate[M].New York:Pienum Medical book Company,1995:47-58.
[5] Jones AC,Logan RP,Foynes S,et al.A flagellar sheath protein of Helicobacter pylori is identical to HpaA,a putative N-acetylneuraminyllactose-binding hemagglutinin,but is not an adhesin for AGS cells[J].J Bacteriol 1997,179(17):5643-5647.
[6] 吴利先,杨致邦,林珊等.幽门螺杆菌临床株粘附素HpaA基因的克隆表达及在诊断中的价值[J].中国人兽共患病杂志,2004,20(4):275-278.
[7] 黄进,杨致邦,黄伟等.抗幽门螺杆菌rHpaA鸡蛋黄抗体的研制[J].中国免疫学杂志,2006,22(10):937-939.
[8] Kyong AL,Sung KC,Yoon JL,et al.Acid stability of anti-Helicobacter pylori IgY in aqueous polyol solution[J].J Biochem Mol Biol,2002,35(5):488-493.
[9] 陈剑秋,许兰薇,张颖等.健康成人24小时pH节律的观察[J].天津医药,1997,25(11):668-670.
[10] Shimizu M,Miwa Y,Hashimoto K,et al.Encapsulation of chicken egg yolk immunoglobulin G (IgY) by liposomes[J].Biosci Biotechnol Biochem,1993,57(9):1445-1449.
[11] Xiao YL,Li JJ,TimA MA,et al.Chitosan-Alginate Microcapsules for Oral Delivery of Egg Yolk Immunoglobulin (IgY) Agric[J].Food Chem,2007,55 (8):2911 -2917.
[12] Ishimori A.History of the development of sucralfate[M].New York:Plenum Medical book Company,1995:35-45.
