冬虫夏草对自发性高血压大鼠klotho表达及氧化应激的影响
2010-11-26周巧玲VeeraragooPouranan刘志纯
唐 荣 周巧玲 Veeraragoo Pouranan 肖 舟 刘志纯
氧化应激是高血压肾损伤的重要发病机制之一,而应用抗氧化剂可延缓高血压肾损伤的进展[1]。klotho基因是 Kuro-o等新发现的一种抗衰老基因,与氧化应激关系密切[2,3]。近年来,klotho基因在肾脏疾病发病机制中的作用日益受到关注。冬虫夏草(cordyceps sinensis,CS)是一种名贵中药,其在肾脏疾病中的应用日益广泛,对药物性肾损伤、缺血性肾损伤、糖尿病肾病、慢性肾衰等均具有良好的肾保护作用[4,5]。我们前期的研究显示,CS可通过抗肾小管上皮细胞凋亡减轻高血压肾损伤,但对血压无明显影响[6]。本实验用 CS干预自发性高血压大鼠(spontaneously hypertensive rat,SHR),以氯沙坦(losartan)为对照药物,观察肾脏 klotho基因表达及氧化应激相关指标的变化,进一步探讨高血压肾损伤的相关机制以及 CS的肾保护作用机制。
材料与方法
主要试剂 CS菌丝粉(江西济民可信公司惠赠),内容物为蝙蝠蛾拟青霉 Cs-4菌粉,又称为发酵虫草菌粉,是从青海产天然冬虫夏草菌中分离纯化所得的虫草菌——蝙蝠蛾拟青霉经液体深层发酵培养、过滤、干燥、粉碎制成的产品;Losartan(100mg/片,杭州默沙东公司惠赠);RNA抽提试剂Trizol(美国 Invitrogen);逆转录试剂盒 (美国Fermentas Life science);Taq Mix酶(北京天为时代);兔抗大鼠 Klotho多克隆抗体 (美国 US Biogical);兔抗大鼠 GAPDH多克隆抗体及辣根过氧化物酶标记抗兔二抗(美国 Santa Cruz);总抗氧化能力(T-AOC)、丙二醛(MDA)、铜锌超氧化物歧化酶(Cu/Zn-SOD)、锰超氧化物歧化酶 (Mn-SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒(南京建成生物工程研究所)。
实验方法
实验动物及分组 22周龄雄性 SHR 15只及健康雄性 Wistar-Kyoto(WKY)大鼠 5只(成都史莱克实验动物研究所提供)。适应性喂养 l周后,按随机数字表法将 22周龄 SHR大鼠分为三组(每组 5只):模型组 (SHR组),冬虫夏草组 [CS组5 g/(kg·d)灌胃],Losartan组[Los组 50mg/(kg·d)灌胃]。22周龄雄性 WKY大鼠 5只(WKY组)作为正常对照。SHR组和 WKY组予等量蒸馏水清晨灌胃。共喂养 8周。
一般检测及标本采集 实验前及实验第 8周(处死前一天)分别检测各组大鼠的体重、尾动脉收缩压、24h尿蛋白量及尿 NAG酶。实验结束时予10%水合氯醛腹腔麻醉,心脏采血 10 ml,用于检测血尿素氮(BUN)及血肌酐(SCr);取左肾称重后去包膜纵向切开后置于 4%多聚甲醛溶液中固定 24h,常规石蜡包埋,切成 4μm厚的切片用于 HE、Masson及免疫组化染色。右肾予生理盐水和 0.1%二乙基焦磷酰胺(DEPC)水冲洗后,取肾皮质于液氮中保存,用于 RT-PCR、Western Blot及氧化应激相关指标的检测。
肾脏病理 常规固定、包埋肾组织后切片,行常规 HE和 Masson染色,在普通光学显微镜下观察。结果判断:取 HE染色切片,单盲依序观察左上、右上、左下、右下、中间五个肾小管间质视野(×200),按肾间质损伤八项指标进行评分,作为该标本的肾小管间质损伤指数。取 Masson染色切片,每例切片低倍镜下观察 10个互不重叠肾小管间质视野,计算肾间质 Masson染色阳性面积占整个视野百分比,以对肾间质胶原含量进行半定量分析。
免疫组织化学染色法检测肾组织 k1otho表达参照SP试剂盒说明书进行试验,阳性结果为细胞质及胞核染成棕黄色。结果判断:显微镜显影系统采集图像;每个标本随机选择不重叠的 10个视野(×400),计算机自动测量并计算平均阳性信号积分吸光度(超清晰度病理图文分析系统 PIPS-2020,重庆天海)。
RT-PCR检测肾组织 klotho基因表达 取 100mg肾组织,低温(液氮)下将组织研磨粉碎,加入Trizol裂解后参照试剂盒说明书提取总 RNA及cDNA模板合成。PCR引物由上海生工合成。大鼠Klotho:上游 5′-CAAT GGCTTCCCTCC TTTAC-3′,下游 5′-AGCACAGGTTTGCGTAGTCT-3′(512bp);大鼠 β-actin上 游 5′-ACCCACACTGTGCCCATCTATGA-3′,下游 5′-CA TCGGAACCGCTCATTG CCGATAG-3′(296 bp)。 klotho反应条件:94℃预变性5 min,94℃ 30s,56℃ 30s,72℃ 1 min,30个循环,72℃终止反应 10 min,4℃冷却。PCR产物于 1.5%琼脂糖凝胶上电泳,凝胶摄像分析系统定量,比较目的基因/内参平均光密度值。
Western Blot检测肾组织 klotho蛋白表达 将肾组织加入预冷的裂解液中充分研磨,提取总蛋白。Bradford法检测蛋白浓度。取 30~40μg蛋白样品100℃变性 5 min后,SDS-PAGE凝胶电泳,待溴酚蓝达胶底部时结束电泳。分离蛋白至 PVDF膜上,置含 5%脱脂奶粉的 PBS中室温封闭 2 h后加入一抗(klotho 1∶300,GAPDH 1∶2 000)室温孵育 2 h,二抗(1∶2 000)室温孵育 2h,ECL显色成像。凝胶分析系统定量,比较目的条带/内参条带平均光密度值。
肾组织氧化应激指标的检测 取处死后冻存的大鼠部分肾组织称重,置 9倍于组织块重量的预冷生理盐水中,冰水浴中匀浆,制成 10%的组织匀浆,于 4℃,10 000 r/min离心 15 min,取上清液检测。硫代巴比妥酸(TBA)法检测 MDA含量,黄嘌呤氧化酶法检测 Cu/Zn-SOD及 Mn-SOD活性,紫外分光光度法检测 CAT活性,比色法测定 T-AOC及GSH-Px活性 。
结 果
实验前后一般资料 实验前(22周龄)四组大鼠体重(Wt)无统计学差异;SHR组、CS组及 Los组24h尿蛋白量及尿 NAG酶均明显增高(与 WKY组比较 P均 <0.01),且此三组间上述指标无统计学差异(P>0.05表1)。实验第 8周(30周龄),SHR组 24h尿蛋白量、尿 NAG酶、BUN及 SCr均明显增高(与 WKY组比较,P均 <0.01)。经 CS或 Los干预后,上述指标均降低 (P<0.05或 P<0.01);Los组收缩压显著低于 SHR组,CS对血压无明显影响;各组大鼠左肾质量/体质量(LR/BW)无统计学差异(P>0.05)(表2)。
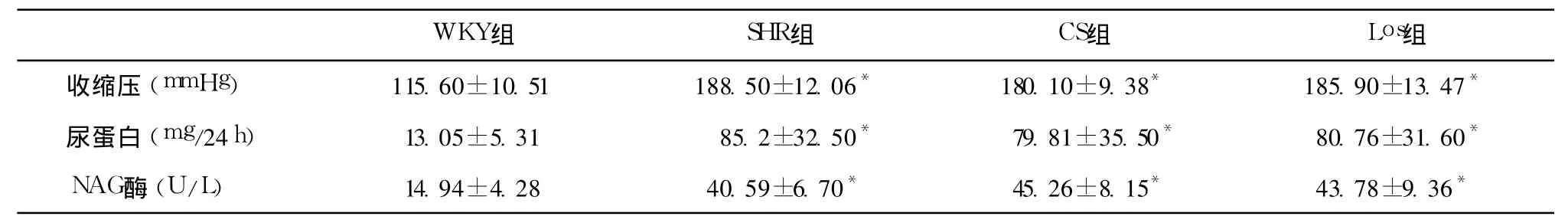
表1 用药前一般情况(22周)

表2 用药后指标变化情况(30周)
肾组织病理改变 HE染色显示,WKY组大鼠肾组织结构未见明显异常;SHR组可见肾脏入球小动脉管壁增厚,部分肾小球毛细血管缺血、皱缩,肾小管上皮细胞空泡及颗粒变性,部分间质炎性细胞浸润,肾小管间质损伤指数明显增加(P<0.01);CS组和 Los组上述病理损伤减轻,肾小管间质损伤指数下降(P<0.01)(图 l)。Masson染色显示,WKY组大鼠肾小球包曼囊及周围的肾小管间质区可见极少量蓝绿染的胶原纤维;SHR组大鼠肾小球包曼囊及周闱肾小管间质区可见增多的蓝绿染的胶原纤维,肾间质胶原相对面积明显增加(P<0.01);CS组和 Los组肾间质胶原减少(P<0.01)(图2)。
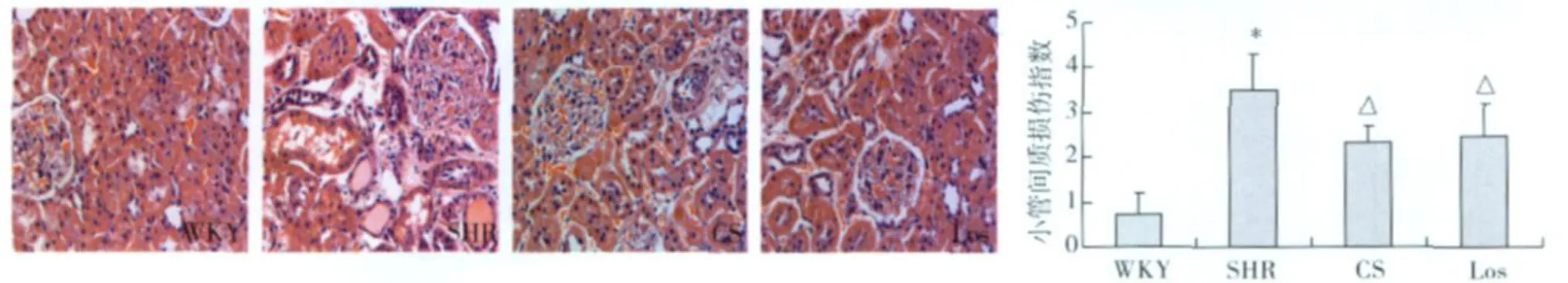
图1 肾组织病理变化(HE,×400)
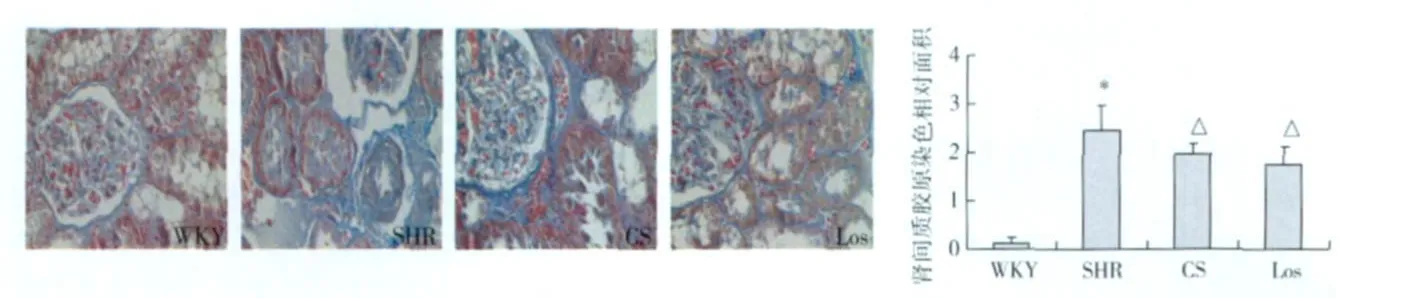
图2 肾组织病理变化(Masson,×400)
肾组织 klotho mRNA及蛋白表达 klotho蛋白主要表达于肾小管上皮细胞胞质及胞核中,且以远曲小管为主;WKY组大鼠肾小管有一定量的 klotho蛋白表达。与 WKY组比较,SHR组肾组织 klotho mRNA及蛋白表达减少(P<0.01);经 CS或 Los干预后,klotho mRNA及蛋白表达明显高于 SHR组(P<0.05或 P<0.01),两药物干预组间无统计学差异(P>0.05)(图3~4)。
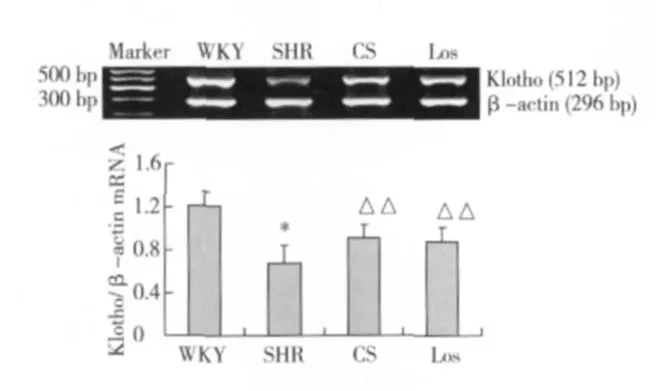
图3 各组肾 klotho mRNA表达变化
肾组织氧化应激指标的变化 与 WKY组比较,SHR组肾组织 MDA含量增加,T-AOC、Cu/Zn-SOD、CAT及 GSH-Px活性降低(P<0.01);经 CS或 Los干预后,SHR组 MDA含量减少,T-AOC、Cu/Zn-SOD、CAT及 GSH-Px活性增加(P<0.05或 P<0.01)。各组大鼠Mn-SOD活性无统计学差异(P>0.05)(表3)。
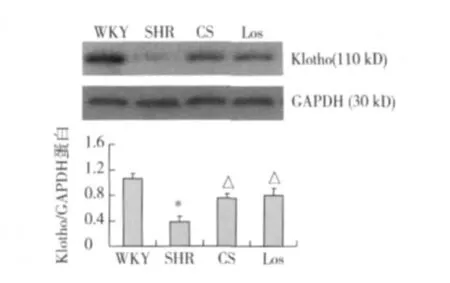
图4 肾klotho蛋白表达变化
讨 论
在过去 10余年中,美国终末期肾脏疾病(ESRD)的发病率以每年9%的速度递增,其中 28%ESRD患者因高血压肾损伤所致[7]。在我国,高血压肾损伤的发病率也逐年上升。在高血压肾损伤的发生发展过程中,氧化应激的作用日益得到人们的重视。氧化应激是指由于活性氧(reactive oxygen species,ROS)过度产生与抗氧化防御机制减弱,两者平衡失调导致的组织损伤。氧化应激是高血压肾损伤进展的重要因素,已经在不同的高血压实验动物模型中得到证实,并且抗氧化应激治疗具有较好的疗效[8]。
SHR的发病机制和病理特点与人类高血压病相似,是研究人类原发性高血压最常用的动物模型。与以往对 SHR的研究相一致,本研究发现,SHR的血压、24 h尿蛋白量、尿 NAG酶、BUN和 SCr水平高于同龄 WKY大鼠,并出现典型的高血压肾损伤的病理特征。这一结果表明,30周龄 SHR已出现肾功能损害、肾小球及肾小管间质损伤。
klotho基因主要表达于肾脏远端小管上皮细胞。klotho基因缺陷鼠可出现一系列类似人类衰老的表现,如生长迟缓,动脉硬化,异位钙化,骨质疏松,肺气肿,寿命缩短和不育等[9]。慢性肾衰患者常出现以上类似表现。已有学者在 SHR、癌症研究所(Institute of Cancer research,ICR)衍生性肾小球肾炎小鼠、肾脏上皮细胞癌、急性肾衰竭大鼠、慢性肾衰及其钙磷代谢紊乱等研究中证实,klotho基因与肾脏疾病关系密切[10-12]。在 klotho基因众多的分子机制中,研究最热的是抗氧化活性。klotho基因可通过抑制胰岛素/胰岛素样生长因子 1信号通路、激活 cAMP信号通路或增加一氧化氮的产生等机制清除 ROS,从而增加细胞或生物体对氧化应激损伤的抵抗性[13]。因此,klotho基因与氧化应激关系密切。研究发现,SHR肾组织 klotho基因表达明显受抑制,提示 klotho表达异常可能参与了高血压肾损伤的发生发展。
持续高血压状态可导致氧化应激水平增加,抗氧化活性降低,使 ROS的生成明显超过机体清除能力,从而引起肾组织结构的损伤[14]。T-AOC是反映机体整体抗氧化水平的重要指标之一;MDA是氧自由基攻击生物膜中多不饱和脂肪酸引发脂质过氧化的最终产物,可间接反映细胞受自由基攻击的损伤程度;SOD、CAT及 GSH-Px是体内清除氧自由基的抗氧化酶系统的重要成员。为明确 SHR肾组织的氧化应激状态,我们检测了 T-AOC、MDA水平和抗氧化酶 SOD、CAT及 GSH-Px的活性。结果显示,SHR肾脏 T-AOC活性明显降低,证实了 SHR体内氧化应激状态的存在。与正常对照组比较,模型组肾组织 MDA含量升高,klotho表达受抑制,Cu/Zn-SOD、CAT及 GSH-Px活性明显降低。氧化产物 MDA水平增加提示此时 SOD活性增高不足以保护机体免受损伤。抗氧化酶 Cu/Zn-SOD、CAT及GSH-Px的活性降低提示 SHR肾组织中抗氧化系统遭到破坏后其清除自由基的能力明显减弱。鉴于klotho基因与氧化应激的密切关系,我们推测 SHR氧化应激指标的变化可能部分继发于 klotho表达的异常。而氧化应激指标表达的变化是否位于 klotho的下游,我们将展开进一步的研究。
CS的主要成分包括腺苷、多糖、甘露醇、微量元素、硬脂酸及多种必需氨基酸,具有抗炎、抗肿瘤、免疫调节、抗氧化等作用[15]。药理学研究表明,CS的抗氧化机制复杂,其抗氧化应激功效可能是所含的多种抗氧化损伤成分协同作用的结果,其中多糖、腺苷、虫草素和 D甘露醇等成分是 CS中具有抗氧化作用的有效组分[16]。
本研究应用 CS或 Los对 SHR进行干预后,24h尿蛋白量、尿 NAG酶、BUN及 SCr均降低;肾脏klotho表达增强;肾脏 MDA含量明显降低,T-AOC、Cu/Zn-SOD、CAT及 GSH-Px等抗氧化酶类活性有不同程度的恢复;肾组织病理损伤明显减轻。这表明 CS可清除自由基,保护抗氧化酶活性,有效地抑制氧化应激损伤。CS的抗氧化应激机制可能有双重途径:一是直接清除自由基,通过减少自由基的生成降低对脂质、蛋白和 DNA的损伤;二是通过调节细胞内抗氧化系统发挥其抗氧化作用。CS可能通过直接抗氧化应激或部分通过上调 klotho基因的表达抑制氧化应激,从而对 SHR起到肾保护作用。研究结果显示,CS对血压无明显影响,提示其对高血压肾损伤的保护作用不依赖于血压的降低。

表3 肾脏氧化应激指标的比较
综上所述,klotho表达异常及氧化应激在高血压肾损伤的发病机制中起重要作用。CS可上调肾脏 klotho表达和抑制氧化应激反应,这可能是其治疗高血压肾损伤的作用机制之一。
1 Yen PL,Chen BH,Yang FL,et al.Effects of deep-frying oil on blood pressure and oxidative stress in spontaneously hypertensive and normotensive rats.Nutrition,2010,26(3):331-336.
2 Kuro-o M,Matsumura Y,Aizawa H,et al.Mutation of the mouse klotho gene leads to a syndrome resembling ageing.Nature,1997,390(6655):45-51.
3 Kuro-o M.Klotho as a regulator of oxidative stress and senescence.Biol Chem,2008,389(3):233-241.
4 Wojcikowski K,Johnson DW,Gobe G.Herbs or natural substances as complementary therapies for chronic kidney disease:ideas for future studies.JLab Clin Med,2006,147(4):160-166.
5 周巧玲,刘抗寒,王衍慧,等.冬虫夏草对糖尿病肾病模型鼠肾组织转化生长因子 βl、结缔组织生长因子表达的影响.肾脏病与透析肾移植杂志,2006,15(5):443-446,468.
6 周巧玲,唐荣,朱俐俐,等.冬虫夏草对自发性高血压大鼠肾脏Klotho表达和肾小管上皮细胞凋亡的影响.中华肾脏病杂志,2009,25(4):305-312.
7 Ruilope LM.The kidney as a sensor of cardiovascular risk in essential hypertension.JAm Soc Nephrol,2002,13(3):S165-168.
8 Hou X,Shen YH,Li C,et al.PPARalpha agonist fenofibrate protects the kidney from hypertensive injury in spontaneously hypertensive rats via inhibition of oxidative stress and MAPK activity.Biochem Biophys Res Commun,2010,394(3):653-659.
9 Masuda H,Chikuda H,Suga T,et al.Regulation of multiple ageinglike phenotypes by inducible klotho gene expression in klotho mutant mice.Mech Ageing Dev,2005,126(12):1274-1283.
10 Wang Y,Sun Z.Klotho gene delivery prevents the progression of spontaneous hypertension and renal damage.Hypertension,2009,54(4):810-817.
11 Haruna Y,Kashihara N,Satoh M,et al.Amelioration of progressive renal injury by genetic manipulation of Klotho gene.Proc Natl Acad Sci U S A,2007,104(7):2331-2336.
12 Sugiura H,Yoshida T,Mitobe M,et al.Klotho reduces apoptosis in experimental ischaemic acute kidney injury via HSP-70.Nephrol Dial Transplant,2010,25(1):60-68.
13 Kuro-o M.Klotho.Pflugers Arch,2010,459(2):333-343.
14 Tyther R,Ahmeda A,Johns E,et al.Proteomic profiling of perturbed protein sulfenation in renal medulla of the spontaneously hypertensive rat.J Proteome Res,2010,9(5):2678-2687.
15 Zhou X,Gong Z,Su Y,et al.Cordyceps fungi:natural products,pharmacological functions and developmental products.J Pharm Pharmacol,2009,61(3):279-291.
16 Hamburger M.Comment on Comparison of protective effects between cultured Cordyceps militaris and natural Cordyceps sinensis against oxidative damage.J Agric Food Chem,2007,55(17):7213-7214.
