盐酸司维拉姆和低蛋白饮食对单侧输尿管结扎大鼠甲状旁腺细胞增生的影响
2010-11-26周道远覃丹平钟小仕
肖 笑 刘 岩 周道远 覃丹平 钟小仕
继发性甲状旁腺功能亢进是慢性肾功能衰竭 (CRF)的常见并发症。研究证实,体内磷潴留在甲状旁腺细胞增生及继发性甲状旁腺功能亢进的发病和进展中起着重要作用[1,2],同时高磷血症还被认为是影响肾衰患者死亡率的独立危险因素[3]。临床研究也证明控制血磷水平,可以有效地纠正钙磷代谢紊乱,延缓继发性甲状旁腺功能亢进的进展[4,5]。临床上治疗高磷血症除了减少磷摄入外,肠道磷结合剂也可降低血磷水平[6,7]。最常用的磷结合剂含有钙盐和铝制剂,临床应用常导致严重不良反应[8,9]。盐酸司维拉姆是一种不含钙铝的磷结合剂,它可以降低 CRF血液透析患者的血磷并抑制甲状旁腺功能亢进,同时避免使用含钙的磷结合剂所致的高钙血症及心血管钙化[10.11]。我们的研究旨在通过免疫组化研究探讨盐酸司维拉姆对单侧输尿管结扎(UUO)导致慢性梗阻性肾病的 CRF大鼠甲状旁腺增生和甲状旁腺激素分泌的影响。
材料与方法
模型制作与取材 75只 7周龄 Wistar雄性大鼠(日本东京 SLC公司提供),体重 170~180g,先给予普通饲料喂食 5d,大鼠可以自由取食及饮水,收集 24h尿标本,每组收集 5只大鼠血标本及甲状旁腺,作为 d0资料。其余大鼠通过尾静脉注射苯巴比妥 0.1ml/100g体重麻醉,然后以 4-0丝线结扎左侧输尿管制造 UUO模型[12]。将大鼠随机分成三组,普通饲料 (n=20,蛋白含量 22%,磷含量400mg/100g,对照组),5%盐酸司维拉姆(日本东京化工提供)加普通饲料组(n=20,盐酸司维拉姆含量 5%,SH组);低蛋白饲料组(n=20蛋白含量6%,含磷 350mg/100g,LP组)。随后,分别在第3、7、14和 28d,各组的大鼠分别测量体重及置于代谢笼中收集 24h尿标本,在每个时间点每组随机抽取 5只大鼠,麻醉后取血标本及甲状旁腺组织标本。
血清及尿液生化检验 血标本离心分离血清,标本置于 -80℃保存待检。血清钙、磷、肌酐及尿素氮,24h尿磷使用标准实验室自动生化检测。血清全段甲状旁腺激素使用大鼠专用全段甲状旁腺激素免疫放射检测。
甲状旁腺的组织学和免疫组织化学检测 甲状旁腺组织置于 20%甲醛溶液固定,蜡块包埋,制成 3 μm切片,分别行 HE和 PAS染色,其他切片待免疫化学检查。为评估甲状旁腺细胞的增生,3μm的组织切片使用 Universal Immuno-enzyme Polymer(UIP)方法 (USA Patent No 6252053)进行免疫组化染色,使用增殖细胞核抗体 (PCNA)作为一抗(抗大鼠 IgG,医学及生物实验室,日本,名古屋)。在显微镜下(400X,总细胞数为 381±42/每个视野),计数每高倍视野的 PCNA阳性细胞,每张切片计算五个视野的平均值。
结 果
三组大鼠的一般情况 三组大鼠在整个实验过程中均无脱失。三组大鼠的体重、血清白蛋白和血清前白蛋白水平在各个时间点,组间比较均无显著性差异。UUO后三组大鼠血清尿素氮与肌酐均缓慢上升,至实验结束,呈现倍增[BUN:(11.60±0.51)μmol/L vs(22.25±1.44)μmol/L,对照组;(13.60±1.21)μmol/L vs(21.50±2.40)μmol/L,SH组;(11.00±0.71)μmol/L vs(20.00±1.50)μmol/L,LP组;d0 vs d28]。尽管对照组比 SH组和LP组上升更为明显,但各组间差异无统计学意义。
血磷的变化 在 SH组,血磷水平从 d3开始逐渐降低,与对照组比较,在 d14,及 d28显示出显著性的降低[(7.80±0.20)mg/dl vs(8.50±0.04)mg/dl,P<0.05和(7.57±0.15)mg/dl vs(8.47±0.60)mg/dl,P<0.05](图1)。并且,在 d3,d14和d28与 d0(9.72±0.15)相比,降低具有显著性(P<0.01),在 LP组,血清磷有降低趋势,但与 d0对照,仅 d14的下降呈现出统计学差异。
尿磷的变化 治疗前三组间的 24h尿磷排泄并无差异,但在 d14和 d28,与对照组比较,SH组的尿磷排泄显著降低[(12.45±2.86)mg/24h vs(23.51±2.33)mg/24h,P<0.01和(12.79±1.04)mg/24h vs(19.29±0.66)mg/24h,P<0.01],LP组也表现出与 SH组相似的变化 (图2)。
血清全段甲状旁腺激素的变化 在 d0三组大鼠的血清全段甲状旁腺激素(i-PTH)水平无差异,从 d3起,对照组的i-PTH逐渐升高,而在 SH组和 LP组这种上升的趋势受到抑制,在 d14和 d28与对照组相比,SH组的 i-PTH明显降低,差异具有显著性[(6.00±0.30)pg/ml vs(9.0±3.64)pg/ml,P<0.05;(7.12±2.27)pg/ml vs(10.00±1.14)pg/ml,d28,P<0.05],LP组也表现出与 SH组相似的变化(图3)。
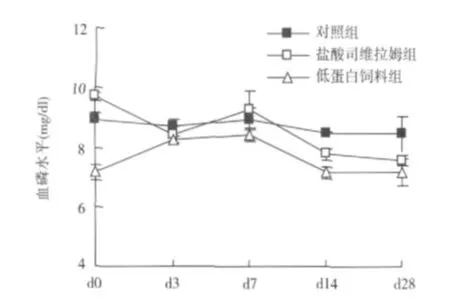
图1 三组实验大鼠血磷的变化
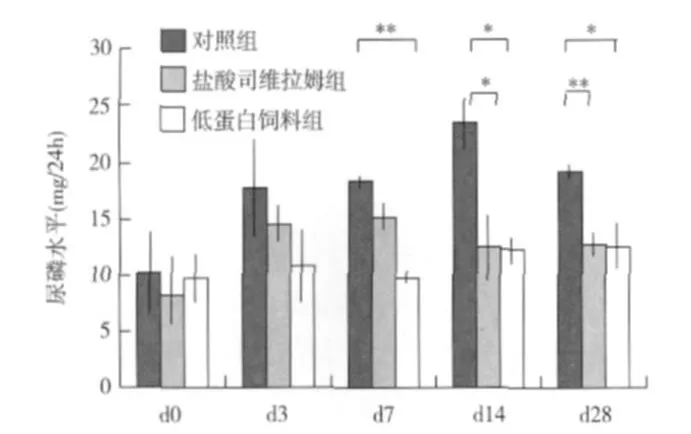
图2 三组实验大鼠各时间点 24小时尿磷的排泌
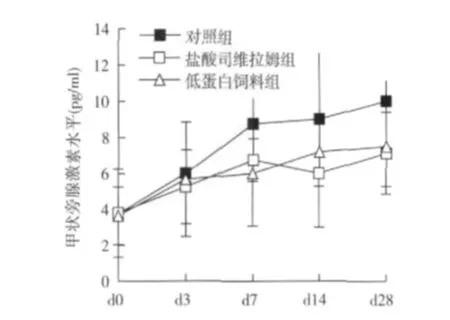
图3 三组实验大鼠血甲状旁腺素变化
PCNA阳性细胞计数 在对照组,从 d3出现显著的甲状旁腺细胞增生,与 d0相比,PCNA阳性细胞计数显著增多[(20.6±2.5)个 /Hp vs(13.76±1.98)个/Hp,P<0.05]。而 SH组尽管也有甲状旁腺细胞增生,但整个实验过程中 SH的 PCNA阳性细胞较对照组显著减少[(12.2±1.4)个/Hp vs(20.6±2.5)个/Hp,d3,P<0.05;(11.5±0.93)个 /Hp vs(18.2±2.9)个 /Hp,d7;(10.35±0.88)个/Hp vs(19.2±1.0)个/Hp,d14,P<0.01;(9.2±1.4)个/Hp vs(15.93±0.18)个 /Hp,d28,P<0.01](图4)。在d7,和 d14,低蛋白饮食也抑制了甲状旁腺细胞的增生[(7.3±0.6)个/Hp;P<0.05,d7(9.9±1.0)个 /Hp;P<0.01,d14](图5)。
讨 论
继发性甲状旁腺功能亢进是 CRF患者常见的并发症,也是透析患者致残的主要原因之一。甲状旁腺功能亢进可以导致肾性骨病和转移性钙化,而发生甲状旁腺功能亢进的始动因子为高磷血症刺激甲状旁腺细胞增生。当甲状旁腺细胞增生一旦发生,往往不可逆[13]。因此,早期预防尤其重要。
盐酸司维拉姆是一种不含钙的磷结合剂,它在胃肠道内通过离子交换结合磷与胆汁酸,其颗粒直径较大(平均 45mm),在胃肠不被吸收而随粪便排出,全身不良反应很少,用于治疗终末期肾病患者的高磷血症,可以避免含钙和铝的磷结合剂所导致的不良反应[14,15]。
在我们的研究中,三组大鼠的体重、血清蛋白、前白蛋白水平均无显著差异。和对照组相比,SH组和 LP组大鼠血清磷水平从实验的第 7天开始明显降低,在 d14和 d28差异有统计学意义,而且,SH组和LP组大鼠24h尿磷排泄量也显著低于对照组,这说明,盐酸司维拉姆可以通过肠道结合磷使大鼠磷摄入减少,低蛋白饲料也有同样作用。在我们的研究中,SH组和 LP组血清 i-PTH的升高明显受到抑制,提示盐酸司维拉姆具有与低蛋白饲料相似的预防及减轻继发性甲状旁腺功能亢进的作用。同时,三组大鼠的甲状旁腺 PCNA阳性细胞的差异,也证实了盐酸司维拉姆抑制甲状旁腺细胞增生的作用。
我们发现,三组大鼠的血磷在整个观察期均无明显增高,但检测血清 i-PTH表现出逐渐升高,虽然在 SH组及 LP组升高的趋势受到抑制,但仍然较基线升高。这是因为在本研究中,三组大鼠的血尿素氮与肌酐水平在实验结束时,较基线升高约一倍,对于早期的肾小球功能受损,肾小球滤过率 60~80 ml/min时,出现 i-PTH升高的主要影响因素是肾脏分泌活性 1,25(OH)2D3低下,直至肾小球滤过率降至 25 ml/min时,高磷血症才成为影响 i-PTH的主要因素[16]。
我们的实验结果显示,从 CRF的早期开始,就出现了甲状旁腺细胞的显著增生,盐酸司维拉姆和低蛋白饲料都能有效降低血磷,降低血清 i-PTH,从而防止并抑制甲状旁腺细胞增生。因此,我们推断在 CRF患者早期,即部分肾小球毁损而出现肾小球超滤过状态时就应该注意控制血清磷浓度,防止甲状旁腺细胞增生及继发性甲状旁腺功能亢进的发生。
在我们的实验中,对于血清磷、i-PTH水平的控制以及对于甲状旁腺细胞增生的抑制,盐酸司维拉姆均表现出与低磷饮食相似的作用,但对于 CRF的患者而言,达到治疗要求的低蛋白饮食的实施具有一定的难度。
因此,我们建议在肾功能不全的早期,一旦出现血尿素氮及肌酐增高,及时检测血清 i-PTH,若出现增高,这时即使有部分患者尚未表现出高磷血症,也可给予患者盐酸司维拉姆治疗,有利于抑制甲状旁腺细胞的增生及继发性甲状旁腺功能亢进。
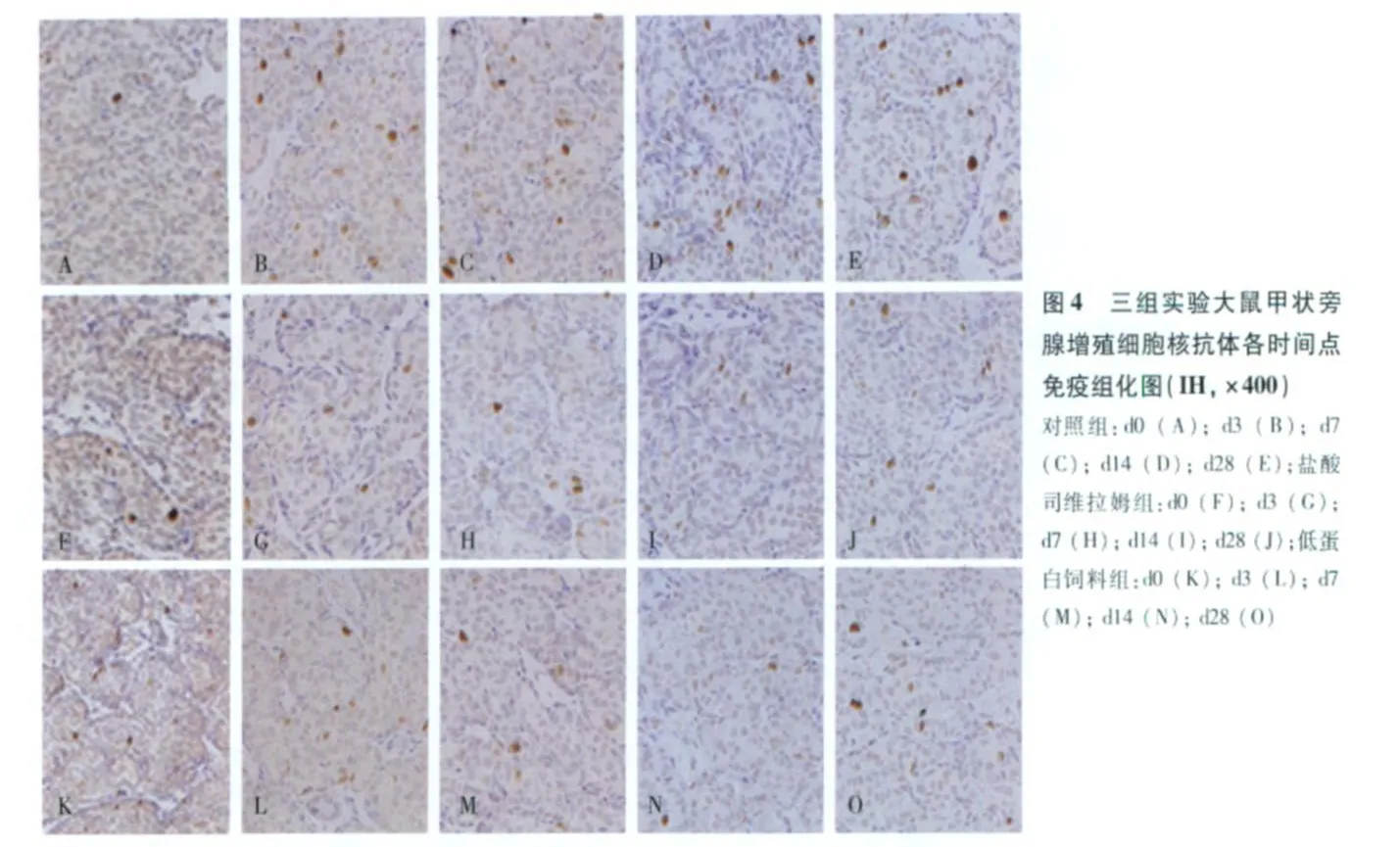
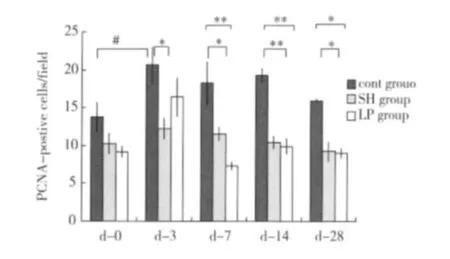
图5 三组实验大鼠甲状旁腺增殖细胞数的比较
1 Stillion JR,Ritt M.Renal secondary hyperparathyroidism.Compend contin Educ Vet,2009,31(6):E1-E11.
2 Slatopolsky E,Dusso A,Brown AJ.The role of phosphorus in the development of secondary hyperparathyroidism and parathyroid cell proliferation in chronic renal failure.Am J Med Sci,1999,317(6):370-376.
3 Block GA,Klassen PS,Lazarus JM,et al.Mineral metabolism,mortality,and morbidity in maintenance hemodialysis.J Am Soc Nephrol,2004,15(8):2208-2218.
4 Slatopolsky E,Finch J,Denda M,et al.Phosphorus restriction prevents parathyroid gland growth.High phosphorus directly stimulates PTH secretion in vitro.J Clin Invest,1996,97(11):2534-2540.
5 Yi H,Fukagawa M,Yamato H,et al.Prevention of enhanced parathyroid hormone secretion,synthesis and hyperplasia by mild dietary phosphorus restriction in early chronic renal failure in rats:possible direct role of phosphorus.Nephron,1995,70(2):242-248.
6 Brancaccio D,Gallieni M,Cozzolino M.Treatment of hyperparathyroidism-why is it crucial to control serum phosphate?Nephrol Dial Transplant,1996,11(3):420-423.
7 Fournier A,Moriniere P,Sebert JL,et al.Calcium carbonate,an aluminum free agent for control of hyperphosphatemia,hypocalcemia and hyperparathyroidism in uremia.Kidney Int Suppl,1986,18:S114-119.
8 Block GA,Port FK.Re-evaluation of risk associated with hyperphosphatemia and hyperparathyroidism in dialysis patients:Recommendations for a change in management.Am J Kidney Dis,2000,35(6):1226-1237.
9 Guérin AP,London GM,Marchais SJ,et al.Arterial stiffening and vascular calcifications in end-stage renal disease.Nephrol Dial Transplant,2000,15(7):1014-1021.
10 Castro R,Herman A,Ferreira C,et al.RenaGel efficacy in severe secondary hyperparathyroidism.Nefrologia,2002,22(5):448-455.
11 Zhang Q,Li M,Lu Y,et al.Meta-analysiscomparing sevelamer and calcium-based phosphate binders on cardiovascular calcification in hemodialysis patients.Neohron Clin Pract,2010,115(4):c259-c267.
12 王海燕,李晓枚,赵明辉,等.单侧输尿管梗阻致肾间质纤维化模型//王海燕.肾脏病学.第三版.北京:人民卫生出版社,2008:620-622.
13 Locatelli F,Cannata-Andia JB,Drüeke TB,et al.Management of disturbances of calcium and phosphate metabolism in chronic renal insufficiency,with emphasis on the control of hyperphosphataemia.Nephrol Dial Transplant,2002,17(5):723-731.
14 Cozzolino M,Staniforth ME,Liapis H,et al.Sevelamer hydrochloride attenuates kidney and cardiovascular calcifications in long-term experimental uremia.Kidney Int,2003,64(5):1653-1661.
15 Braunlin W,Zhorov E,Guo A,et al.Bile acid binding to Severlamer HCI.Kidney Int,2002,62(2):611-619.
16 Llach F,Massry SG.On the mechanism of secondary hyperparathyroidism in moderate renal insufficiency.J Chin Endocrinol Mctab,1985,61(4):601-606.
