局灶节段性肾小球硬化患者足细胞钙神经蛋白的表达
2010-11-26郑春霞张明超曾彩虹朱晓东刘志红
汤 曦 吴 青 郑春霞 张明超 曾彩虹 张 炯 朱晓东 刘志红
局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)是成人肾病综合征的常见病因之一。FSGS的病变突出表现在足细胞损伤,但其病因复杂,除免疫因素外,还有毒物、代谢、血流动力学、感染、遗传等多种因素参与[1]。FSGS的形态学特点为局灶、节段性病变,但是肾小球局部病变性质不均一,对治疗的反应和预后也不相同。虽然糖皮质激素是目前治疗 FSGS的首选药物,但成人 FSGS激素治疗反应较差,完全缓解率不足 30%[2]。临床上观察到钙神经蛋白抑制剂(calcineurin inhibitor,CNI)治疗激素依赖、抵抗的肾病综合征缓解率达80%[3,4]。传统观点认为 CNI通过抑制活化 T细胞核因子(nuclear factor of activated T cells,NFAT)信号通路、调节 T细胞免疫治疗肾脏疾病。近期有研究发现 CNI可直接抑制由足细胞calcineurin(Cn)过度活化介导的 synaptopodin去磷酸化,稳定细胞骨架,促进足细胞的修复[5]。上述研究表明,足细胞Cn的过度活化将触发足细胞损伤过程,而有效地抑制其活性可逆转足细胞病变。Cn由催化亚基 A(CnA)和调节亚基 B(CnB)组成,其主要活性单位为 CnA亚基。CnA又分为 α、β、γ三种亚型,不同组织中 CnA亚型分布不同。那么,FSGS患者足细胞是否表达 Cn,若有,它是否与疾病活动有关,能否有助于 FSGS的临床诊断和治疗选择。为此,本研究对 FSGS患者肾组织 Cn的表达进行了观察。
对象和方法
病例选择 纳入年龄≥16岁,尿蛋白>3.5g/24h,血清白蛋白 <35 g/L,血清肌酐<265.3μmol/L,且经肾活检明确诊断的患者,排除肥胖、糖尿病肾病、乙肝、淀粉样变性等继发因素,选取特发性 FSGS 63例(平均年龄 24.5岁,男 /女为47/16),MCD 24例 (平均年龄 27.6岁,男/女为17/7),及肾移植供肾 10例。活检时 FSGS患者尿蛋白(8.76±4.62)g/24h,尿视黄醇结合蛋白(rentiol binding protein,RBP)2.16(0.01~210.7)mg/L,血清肌酐(106.08±55.69)μmol/L均高于MCD患者(P<0.05);二者间年龄、性别、尿 N-乙酰-β-葡萄糖苷酶 (N-Acetyl-β-D-Glucosaminidase,NAG)、血清白蛋白以及血清总胆固醇等均无统计学差异(表1)。
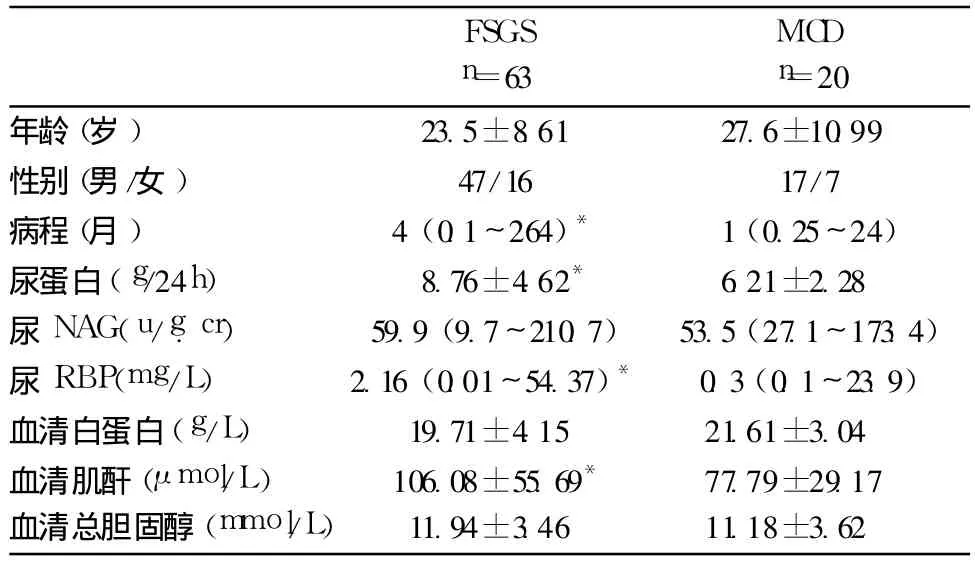
表1 肾活检时患者的临床特征
肾活检组织病理 肾组织石蜡切片行 HE、PAS、PASM、Masson三色染色,光镜下观察肾组织病变,根据哥伦比亚方法[6]对 FSGS病变进行分型;免疫病理采用冰冻切片直接免疫荧光法;电镜组织以3.75%冷戊二醛固定,1%四氧化锇后固定,60~70 nm超薄切片,醋酸铀、柠檬酸铅双染色,置于Hitachi 7500透射电子显微镜下观察。
肾组织 CnA免疫组织化学染色 石蜡切片(2μm)脱蜡,在甲醇中用 3%H2O2封闭内源性过氧化物酶 30 min。10mM的柠檬酸盐缓冲剂(pH6.0)条件下加热 30 min修复抗原,置PBS-0.1%小牛血清 15 min后,再加入 10%小牛血清封闭。分别加兔抗人CnAα、β、γ一抗(Santa CruZ,MA,1∶50)、Cn A+B抗体(Chemicon,CA,1∶100),4℃孵育过夜,PBS洗三遍,然后加二抗EnVision(Dako,CA)孵育 30 min。用DBA显色,苏木素复染核,中性树胶(Sigma,USA)封片,置显微镜(Olympus BX51,Tokyo,Japan)下观察。选取人扁桃体组织,采用上述染色作为阳性对照,用同等浓度的非免疫兔血清 IgG(Dako,CA)染色作为阴性对照。
肾组织 synaptopodin免疫荧光染色 石蜡切片按上述方法脱蜡、修复抗原后,加入羊抗人synaptopodin一抗(SantaCruz,MA,1∶10),避光 ,湿盒内室温孵育 2h,PBS漂洗三次;然后加入硫氰酸四甲基罗丹明(tetramethylrhodamine isothiocyanate,TRITC)标记的驴抗羊二抗(Dako,CA,1∶50),湿盒内室温孵育 40 min,PBS漂洗三遍,吹干,采用抗淬灭的封片剂(Vector Laboratories,CA)封片,置荧光显微镜(Olympus,Tokyo,Japan)同等曝光条件下观察。
结果判断两位病理医生分别盲法评判染色结果。选取≥10个肾小球的组织标本进行分析。非节段病变的单个肾小球中≥50%足细胞 CnAα阳性定义为肾小球 CnAα阳性。患者肾组织中≥1个肾小球阳性即为 CnAα阳性病例。单个切片上选取荧光强度最强的 5个肾小球进行 Syanaptopodin染色评分。染色强度分为:++,+,-[7]。
肾组织CnAα与 synaptopodin双重免疫荧光染色石蜡切片如前步骤脱蜡、修复抗原后,加入Avidin/biotin非特异性结合 15 min,0.1%马血清封闭10 min,加兔抗人 CnAα一抗(1∶50)孵育 2h,加生物素化抗兔 IgG二抗(Vector Laboratories,CA,1∶200)孵育 30 min,PBS漂洗三次,再加荧光素标记 Avidin DCS(Vector Laboratories,CA,1∶300)孵育 10 min。非特异性交叉反应采用 Avidin/biotin封闭 15 min,0.1%马血清封闭 10 min,加羊抗人 synaptopodin(1∶20)孵育 2h,加生物素化抗羊 IgG(Vector Laboratories,CA,1∶400)孵育 30 min,再加稀释的德克萨斯红 Avidin DCS(Vector Laboratories,CA,1∶400)孵育10 min,PBS洗三次,甘油封片,共聚焦荧光显微镜(LSM510,Carl Zeiss)下观察并扫描采集图像。
免疫电镜 将肾组织块切块(1 mm3),放入含2%(w/v)甲醛和 0.02%(v/v)戊二醛 (p H7.2)的0.1M PBS固定剂(p H7.4)中,室温固定 2h,PBS漂洗三次,投入含 10%明胶溶液中 15 min,再投入含2.3 mol/L蔗糖的 0.1MPBS缓冲液中室温下渗透处理 2h。参照 Tokuyasu技术[7]使用 Leica EM FC6冷冻超薄切片机进行冷冻切片(90 nm),将其转移至镍网上。切片复温后缓冲液漂洗,5%BSA孵育15 min,加入兔抗人 CnAα一抗(1∶50),4℃冰箱孵育过夜,漂洗,加入的羊抗兔二抗胶体金抗体(Aurion,PA,1∶25)室温孵育 1h,PBS漂洗三次,1%戊二醛固定10 min,充分冲洗,再加由 2%(w/v)甲基纤维素溶液和 4%(w/v)酸性醋酸铀溶液按9∶1比例配制的染液染色 5 min,切片干燥后置Hitach7500透射电镜下观察。
统计分析 采用 SPSS16.0 for windows统计软件对数据资料进行统计分析,计量资料采用均值 ±标准差或者中位数表示,组间采用 t检验或者非参数秩和检验;计数资料采用百分比描述,组间比较采用 χ2检验或者 Fisher确切概率法。采用 Kappa检验对两位病理医生的评判结果进行一致性检验。采用 logistic逐步回归分析筛选与足细胞 CnAα过表达相关的因素。P<0.05差异有统计学意义。
结 果
移植供肾组织 CN的表达 移植供肾组织肾小球 CnAα、CnAβ、CnAγ染色均阴性 (图1 A1、2、3),近曲、远曲肾小管、皮质集合管 CnAα、β微弱着色(图2 D1、2,表2),肾小管 CnAγ染色阴性(图2 D3)。
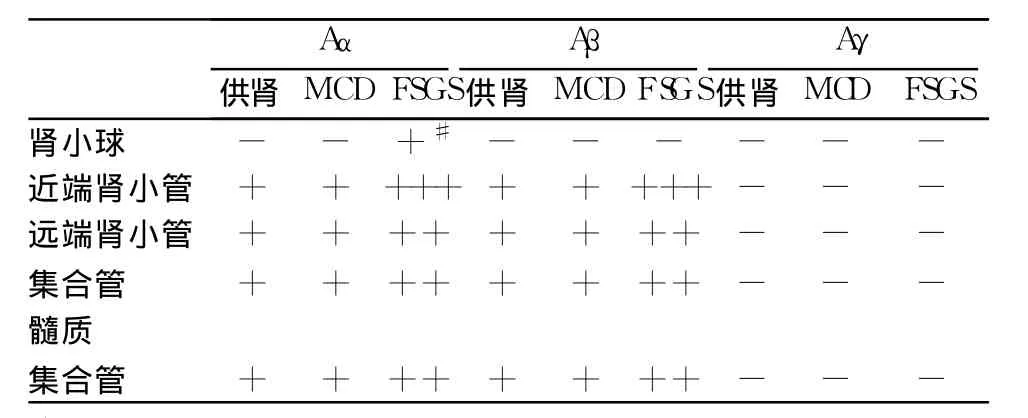
表2 CnA异构体在供肾、微小病变(MCD)、局灶节段性肾小球硬化(FSGS)患者肾组织中的表达情况
FSGS与 MCD患者肾组织 Cn的表达分布 63例 FSGS患者肾小球 CnAβ、CnAγ均阴性(图1 C2、3);其中 26例的肾小球 CnAα表达上调(图1 C1),主要分布于毛细血管袢外缘(图3 A、B)及部分包曼囊壁层上皮细胞(图3 D)。肾小球节段硬化处 CnAα阴性(图3 C)。 24例 MCD患者肾小球 CnAα、CnAβ、CnAγ表达均阴性(图1 B1、2、3)。双重免疫荧光标记发现 synaptopodin与 CnAα在同一部位表达(图4),进一步证实了 CnAα主要表达于肾小球足细胞。胶体金免疫电镜显示 CnAα颗粒主要分布于足突胞质(图5)。60例 FSGS和 7例 MCD肾小管 CnAα表达增加,弥漫分布达于近曲、远曲小管及集合管(图2 E1、F1),近曲小管阳性程度强于远曲小管及集合管(表2)。肾小管 CnAα阳性患者伴同部位小管 CnAβ表达上调。局部近曲小管上皮细胞胞质中 CnAα近基膜端聚集(图2 F1),而 CnAβ在近曲小管上皮细胞顶膜刷状缘侧聚集(图2 F2)。FSGS与 MCD患者肾小管 CnAγ均为阴性(图2 E3、F3)。
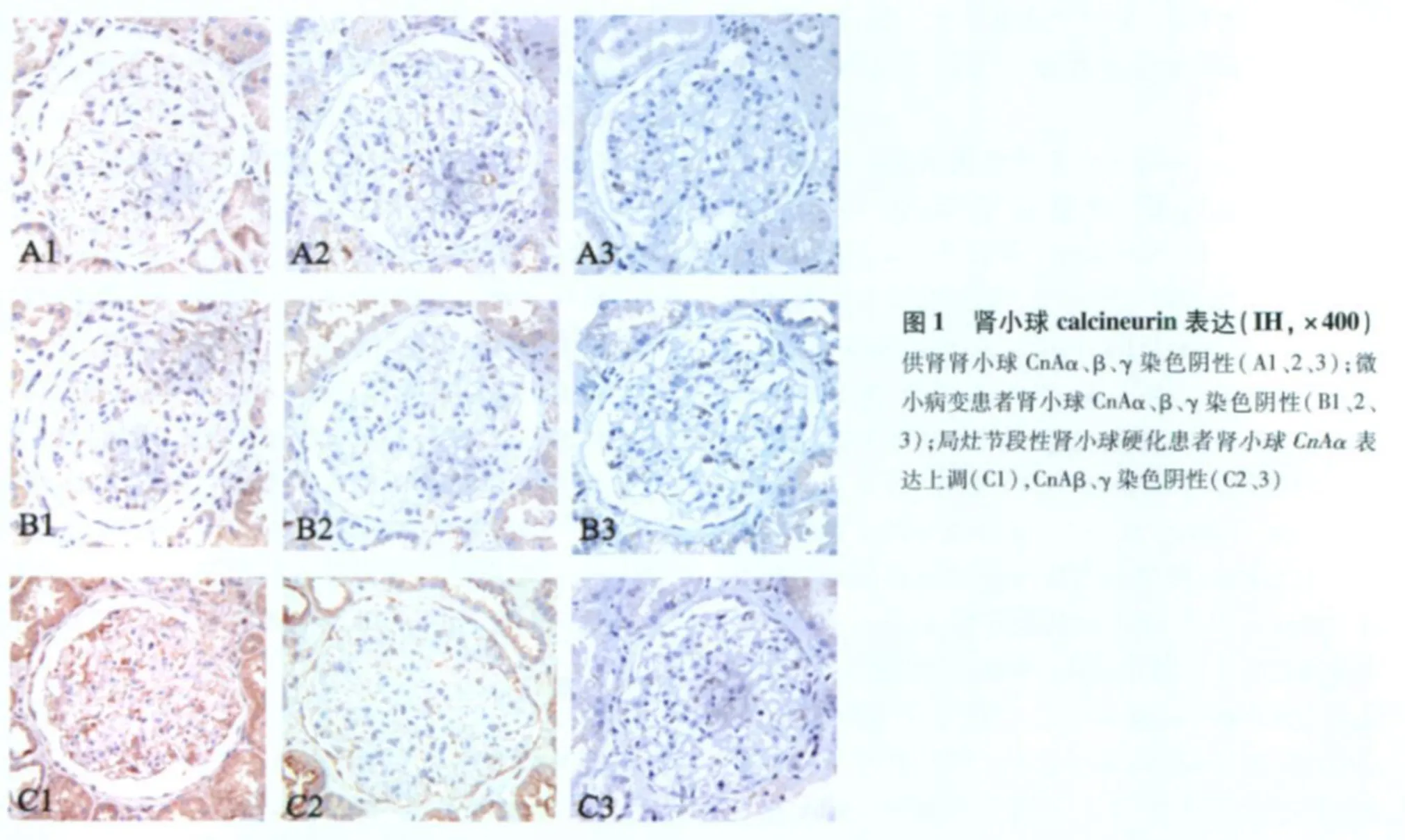
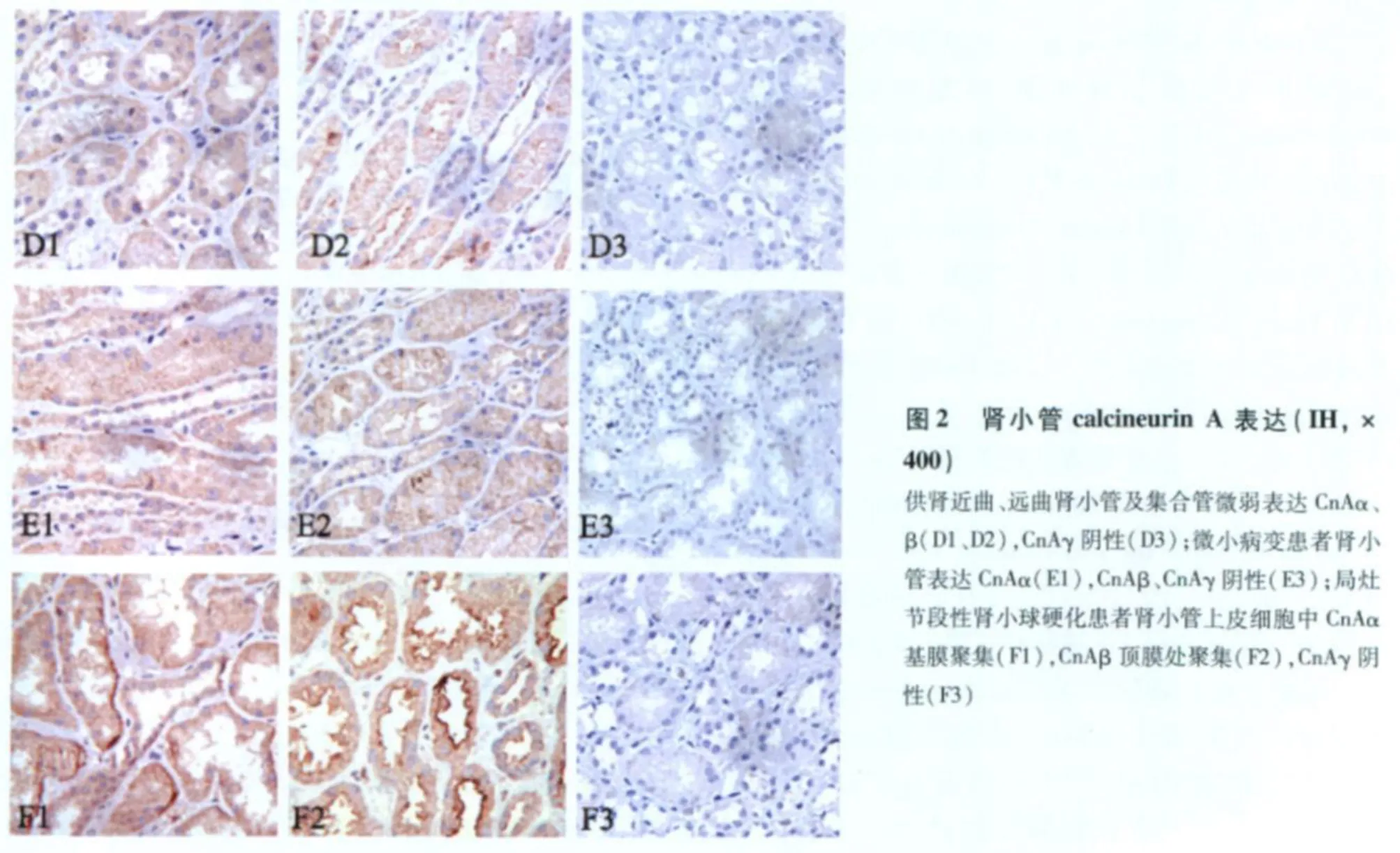
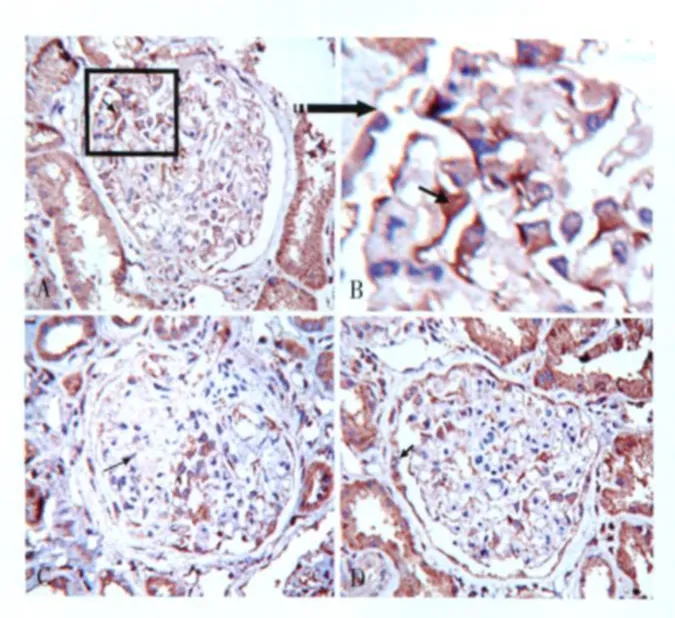
图3 局灶节段性肾小球硬化患者肾小球CnAα的表达分布
FSGS患者肾小球足细胞 CnAα与 synaptopodin的表达 26例(41.27%)FSGS患者足细胞 CnAα阳性,明显高于 MCD患者 0%(P<0.01)。其中 18例(69.23%)足细胞 CnAα阳性 FSGS患者的肾小球 synaptopodin表达减弱且不连续(图6)。
FSGS患者肾小球足细胞 CnAα与临床病理特点的关系 63例 FSGS患者活检时的临床病理特点见表3。足细胞 CnAα阳性的患者尿液 RBP 20.91(0.17,54.37)mg/L、血清肌酐(128.18±56.58)μmol/L高于阴性患者(P<0.05);两组间病理类型构成存在统计学差异(P<0.01);而年龄、性别、蛋白尿程度、尿 NAG、血清白蛋白及胆固醇无统计学差异。比较不同病理类型 FSGS间足细胞 CnAα的阳性率,发现塌陷型(83.33%)>细胞型(66.67%)>顶部型(61.54%)>门周型(20%),14例经典型均阴性(P<0.01,表3)。单因素 Logistic回归分析发现 FSGS患者血清肌酐 (OR 4.229,P=0.01)、塌陷型(OR 43.333,P<0.01)、细胞型 (OR 17.333,P<0.01)、顶部型(OR 13.867,P<0.01)与足细胞CnAα过表达相关。进一步多因素 Logistic回归分析示血清肌酐(OR 4.855,P<0.01)、塌陷型(OR 11.069,P<0.05)为 FSGS患者足细胞 CnAα过表达的主要相关因素(表4)。
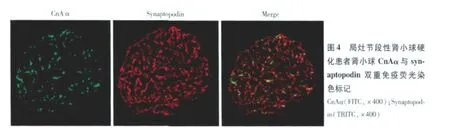
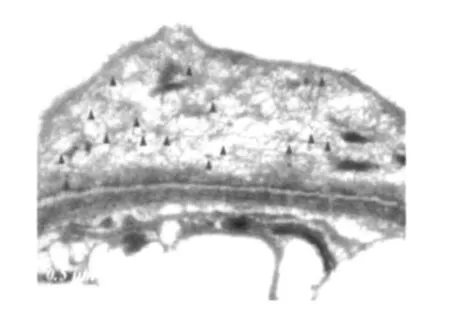
图5 胶体金免疫电镜标记 CnAα主要分布于局灶节段性肾小球硬化患者足突胞质(箭头示)
FSGS患者肾小球足细胞 CnAα与激素治疗反应的关系 63例 FSGS患者中 23例为初治或停用激素、雷公藤多苷等免疫抑制剂 2月以上的患者。10例(43.47%)初治患者足细胞 CnAα阳性,与非初治患者足细胞阳性率 47.83%相比无统计学差异(P>0.05)。其中 12例初治 FSGS患者采用足量激素诱导治疗,随访观察 3月,发现 2例足细胞 CnAα阳性患者完全缓解;足细胞 CnAα阴性患者中 7例完全缓解,1例部分缓解,2例无效(P>0.05)。
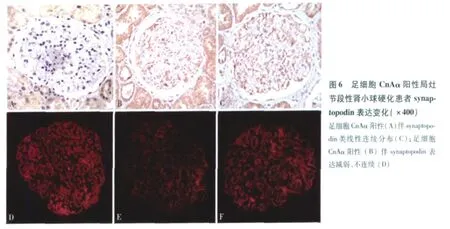

表3 足细胞 CnAα阳性与阴性FSGS患者的临床病理特点比较
讨 论
FSGS是表现为肾病综合征的常见足细胞疾病,常伴肾小管间质损伤,对激素反应较 MCD差。部分早期 FSGS受肾活检取材部位的影响,未见典型节段病变而不易与 MCD鉴别。对于激素抵抗的肾病综合征患者,临床 CNI降蛋白尿有效,但因具有肾毒性而受限制。就 CNI的肾毒性,既往研究关注 Cn在肾小管的作用[8];而其降蛋白尿的机制尚不完全明了。体外和动物实验发现 Cn的过度活化导致足细胞损伤、蛋白尿,但 FSGS患者肾小球内 Cn的表达、活性及作用目前尚无研究报道。
Cn是一种受 Ca2+及钙调蛋白特异调节的丝/苏氨酸蛋白磷酸酶,广泛分布于真核生物体内,通过去磷酸化离子通道、蛋白酶、受体、核转录因子如 NFAT,调节细胞的增殖、分化、凋亡、流动、黏附等。生理情况下 Cn参与神经元发生、细胞骨架调节、轴突延伸、突触发生、神经介质囊泡的胞吞和胞吐;激活 T淋巴细胞、释放 IL-2等细胞因子并转导信号等[9]。据研究发现 Cn的高表达在阿尔茨海默病[10]、肿瘤转移[11]、心肌肥大[12]等疾病中起着重要作用。肾脏组织中主要表达 CnAα、β,分布在近曲、远曲肾小管、髓袢升支粗段,而肾小球 Cn表达阴性[8]。其中 CnAα为肾脏发育所必需,特别对出生后肾脏的发育分化成熟至关重要[13]。糖尿病小鼠中肾小管、内皮细胞、系膜细胞 Cn表达上调,参与了肾小球细胞肥大、胞外基质增生[14]。体外实验发现转化生长因子 β、胰岛素样生长因子 1通过Cn/NFAT信号通路介导系膜基质肥大[15]。
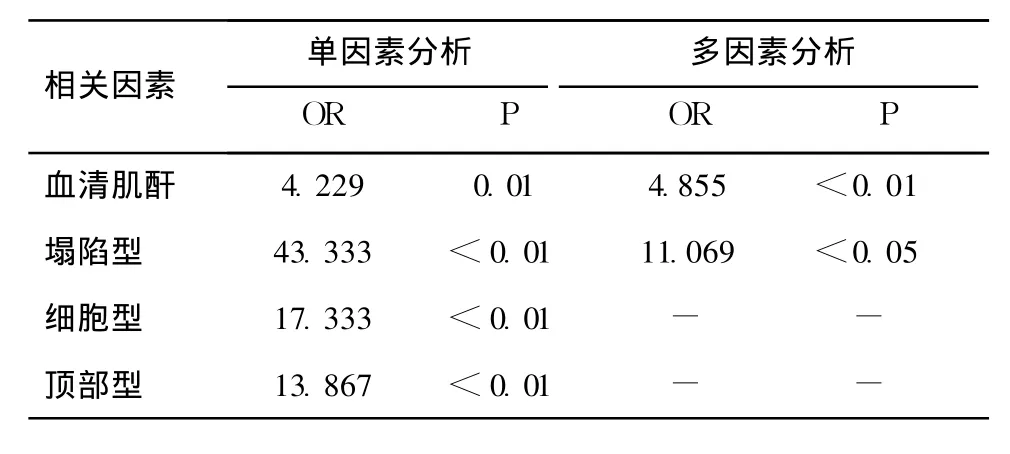
表4 logistic回归分析示与局灶节段性肾小球硬化患者足细胞CnAα表达上调相关的因素
本研究首次发现 FSGS患者中非节段病变的肾小球足细胞 CnAα表达增加,而健康人和 MCD患者肾小球 Cn表达阴性。关于 MCD与 FSGS是一个疾病的不同阶段,还是两个不同的疾病,一直存在着争议。临床中观察到首次肾活检表现为 MCD的患者因蛋白尿控制不佳重复肾活检为 FSGS[16]。人们试图寻找某些生物标记物鉴别两者。Regele等[17]发现足细胞骨架蛋白与肾小球基膜的连接分子肌营养不良蛋白聚糖在 MCD患者中表达减弱,而 FSGS患者表达正常。Garin等[18]发现 MCD复发患者尿液及肾小球中 CD80较缓解期增加,而 FSGS患者无此变化。本研究发现足细胞 CnAα在 FSGS和MCD间的表达差异,也提示二者发病机制不同。对于临床怀疑 FSGS而肾脏病理未见节段病变的患者,足细胞 CnAα阳性者应高度考虑 FSGS。足细胞 CnAα检测是否有助于诊断 FSGS,还有待进一步扩大病例或者行重复肾活检验证。
本研究发现部分 FSGS患者肾小球中 Cn高表达,主要定位于足细胞而非系膜或内皮细胞。为了避免肾小球足细胞数目对结果判断的影响,我们选择连续切片中的正切小球计数,排除节段病变的影响,并以单个肾小球足细胞阳性百分率为阳性判断标准,发现同等蛋白尿程度的 FSGS患者以塌陷型、细胞型、顶部型足细胞 CnAα表达增加显著,个别伴壁层上皮细胞阳性,而经典型阴性。尽管早期糖尿病小鼠和脂多糖干预的小鼠均表现为足突融合,肾小球病变轻微,但人 MCD并无 Cn表达上调。这从分子病理角度提示 FSGS与糖尿病肾病、MCD足细胞损伤的机制不同,且 FSGS本身为异质性的临床病理综合征。T细胞免疫功能异常[19]和循环通透因子[20]在获得性 FSGS发病中固然很重要,但激素治疗 FSGS的完全缓解率不足 30%[2],表明非免疫因素参与 FSGS发生。目前已知遗传因素如瞬时受体电势蛋白通道 6(transient receptor potential channel 6,TRPC6)突变[21]、感染(如 HIV病毒)、代谢和血流动力学异常(如肥胖)、药物(如帕米二磷酸钠)、金属锂中毒等均能导致肾小球 FSGS样病变。此外,足细胞 CnAα阳性的 FSGS患者伴有壁层上皮细胞 CnAα阳性,提示在某些因素的刺激下,壁层上皮细胞 Cn的活化可能参与了肾小球足细胞病变。Dijkman等研究发现 FSGS节段病变处足细胞表型与壁层上皮细胞相似,表达细胞角质蛋白[22]、P钙粘素[23,24]。因此,进一步对足细胞 Cn上调因素的体外研究将有助于对 FSGS病因机制的探讨。
就 CnAα表达上调对足细胞的影响,我们进一步检测发现大部分足细胞 CnAα阳性患者肾小球synaptopodin表达减弱、不连续,与 Faul等[5]体外研究的报道一致。Cn去磷酸化后的 synaptopodin而不易与 14-3-3蛋白结合,使后者易被 cathepsin L降解,导致足细胞骨架紊乱。有趣的是,少部分足细胞CnAα阳性患者肾小球 syanptopodin表达分布未见异常。这一方面提示体内 synaptopodin的表达可能同时受 CnAα、14-3-3蛋白、cathepsin L等多种因素调节;另一方面提示FSGS患者中 CnAα还可能通过NFAT等其他途径导致足细胞损伤。Wang等[25]发现足细胞内 NFAT信号通路的激活参与了小鼠蛋白尿和肾小球节段局灶硬化的发生,提示 TRCP6突变可能通过钙离子激活 Cn/NFAT参与部分 FSGS患者的发病。Gq受体亦可激活 Cn/NFAT信号通路,上调环氧化物酶 2,导致足细胞坏死[26]。另外,Cn还可能通过调节细胞周期介导 FSGS中局部足细胞的增殖和去分化。CnAα基因敲除的小鼠肾组织中细胞周期蛋白激酶抑制物 P27增加[13]。FSGS患者中高表达 CnAα的足细胞细胞周期是否异常有待进一步证实。
进一步探讨足细胞 CnAα表达与 FSGS临床指标的关系发现,足细胞 CnAα阳性患者血肌酐和尿RBP水平较高,而未见与蛋白尿程度、激素治疗反应等相关。下一步对足细胞 CnAα阳性的 FSGS患者中肾小管 Cn表达分布及小管间质急慢性病变的分析,将会加深我们对 CnAα在 FSGS发病中的认识。本研究纳入病例数有限,FSGS患者足细胞 Cn表达增加与是否初治无关。初发激素治疗患者例数有限,随访周期不够,尚不能说明 FSGS患者中肾小球 Cn表达与激素治疗反应的关系。激素抵抗患者肾小球 Cn的表达检测可能有助于二线治疗方案的选择。
综上所述,部分FSGS患者足细胞CnAα表达增加,以塌陷型、细胞型、顶部型显著,伴血肌酐升高。而 MCD患者肾小球 CnAα阴性。这提示 MCD和FSGS二者的发病机制不同,为 FSGS的发病提供了新线索。对临床怀疑 FSGS而未见明确节段病变的患者,足细胞 CnAα的过表达有助于诊断。进一步阐明 FSGS患者足细胞 CnAα表达增加的机制及其在肾组织损伤的作用,有助于 FSGS的正确诊断和合理治疗。
1 Thomas DB,Franceschini N,Hogan SL,et al.Clinical and pathologic characteristics of focal segmental glomerulosclerosis pathologic variants.Kidney Int,2006,69(5):920-926.
2 张 炯,刘志红,曾彩虹,等.泼尼松治疗成人局灶节段性肾小球硬化患者的临床疗效.肾脏病与透析肾移植杂志,2009,18(1):13-19.
3 Choudhry S,Bagga A,Hari P,et al.Efficacy and safety of tacrolimus versus cyclosporine in children with steroid-resistant nephrotic syndrome:a randomized controlled trial.Am J Kidney Dis,2009,53(5):760-769.
4 Hamasaki Y,Yoshikawa N,Hattori S,et al.Cyclosporine and steroid therapy in children with steroid-resistant nephrotic syndrome.Pediatr Nephrol,2009,24(11):2177-2185.
5 Faul C,Donnelly M,Merscher-Gomez S,et al.The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporine A.Nat Med,2008,14(9):931-938.
6 D'Agati V.Pathologic classification of focal segmental glomerulosclerosis.Semin Nephrol,2003,23(2):117-134.
7 Srivastava T,Garola RE,Whiting JM,et al.Synaptopodin expression in idiopathic nephrotic syndrome of childhood.Kidney Int,2001,59(1):118-125.
8 Tumlin JA.Expression and function of calcineurin in the mammalian nephron:physiological roles,receptor signaling,and ion transport.Am JKidney Dis,1997,30(6):884-895.
9 Rusnak F,Mertz P.Calcineurin:form and function.Physiol Rev,2000,80(4):1483-1521.
10 Hata R,Masumura M,Akatsu H,et al.Up-regulation of calcineurin Abeta mRNA in the Alzheimer's disease brain:assessment by cDNA microarray.Biochem Biophys Res Commun,2001,284(2):310-316.
11 Liu Y,Zhang Y,Min J,et al.Calcineurin promotes proliferation,migration,and invasion of small cell lung cancer.Tumour Biol,2010,31(3):199-207.
12 Fiedler B,Wollert KC.Targeting calcineurin and associated pathways in cardiac hypertrophy and failure.Expert Opin Ther Targets,2005,9(5):963-973.
13 Gooch JL,Toro JJ,Guler RL,et al.Calcineurin A-alpha but not A-beta is required for normal kidney development and function.Am J Pathol,2004,165(5):1755-1765.
14 Gooch JL,Barnes JL,Garcia S,et al.Calcineurin is activated in diabetes and is required for glomerular hypertrophy and ECM accumulation.Am JPhysiol Renal Physiol,2003,284(1):F144-154.
15 Gooch JL,Tang Y,Ricono JM,et al.Insulin-like growth factor-I induces renal cell hypertrophy via a calcineurin-dependent mechanism.J Biol Chem,2001,276(45):42492-42500.
16 Fogo A,Hawkins EP,Berry PL,et al.Glomerular hypertrophy in minimal change diseasepredictssubsequent progression to focal glomerular sclerosis.Kidney Int,1990,38(1):115-123.
17 Regele HM,Fillipovic E,Langer B,et al.Glomerular expression of dystroglycans is reduced in minimal change nephrosisbut not in focal segmental glomerulosclerosis.J Am Soc Nephrol,2000,11(3):403-412.
18 Garin EH,Mu W,Arthur JM,et al.Urinary CD80 is elevated in minimal change disease but not in focal segmental glomerulosclerosis.Kidney Int,2010,78(3):296-302.
19 Shalhoub RJ.Pathogenesis of lipoid nephrosis:a disorder of T-cell function.Lancet,1974,2(7880):556-560.
20 Savin VJ,McCarthy ET,Sharma M.Permeability factors in focal segmental glomerulosclerosis.Semin Nephrol,2003,23(2):147-160.
21 Winn MP,Conlon PJ,Lynn KL,et al.A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis.Science,2005,308(5729):1801-1804.
22 Kihara I,Yaoita E,Kawasaki K,et al.Origin of hyperplastic epithelial cellsin idiopathic collapsing glomerulopathy.Histopathology,1999,34(6):537-547.
23 Dijkman HB,Weening JJ,Smeets B,et al.Proliferating cells in HIV and pamidronate-associated collapsing focal segmental glomerulosclerosis are parietal epithelial cells.Kidney Int,2006,70(2):338-344.
24 Dijkman H,Smeets B,van der Laak J,et al.The parietal epithelial cell is crucially involved in human idiopathic focal segmental glomerulosclerosis.Kidney Int,2005,68(4):1562-1572.
25 Wang Y,Jarad G,Tripathi P,et al.Activation of NFAT Signaling in Podocytes Causes Glomerulosclerosis.J Am Soc Nephrol,2010.
26 Wang L,Flannery PJ,Rosenberg PB,et al.Gq-dependent signaling upregulates COX2 in glomerular podocytes.J Am Soc Nephrol,2008,19(11):2108-2118.
27 Buchholz M,Ellenrieder V.An emerging role for Ca2+/calcineurin/NFAT signaling in cancerogenesis.Cell Cycle,2007,6(1):16-19.
28 Periasamy M.Calcineurin and the heartbeat,an evolving story.J Mol Cell Cardiol,2002,34(3):259-262.
