广州管圆线虫组织蛋白酶Z基因的原核表达及免疫学分析*
2010-08-21岳永亮于彦杰曲振宇李卓雅詹希美
岳永亮,于彦杰,杨 潇,程 梅,何 蔼,曲振宇,刘 静,王 琳,李卓雅,詹希美
广州管圆线虫组织蛋白酶Z基因的原核表达及免疫学分析*
岳永亮,于彦杰,杨 潇,程 梅,何 蔼,曲振宇,刘 静,王 琳,李卓雅,詹希美
目的克隆并原核表达广州管圆线虫组织蛋白酶-Z基因,评价其融合蛋白在免疫诊断中的应用前景。方法利用生物信息学分析工具,分析广州管圆线虫组织蛋白酶-Z的理化性质、结构与功能特征;克隆目的基因至原核表达载体pET30a(+),经PCR、双酶切鉴定后,IPTG诱导表达,表达产物通过SDS-PAGE鉴定,融合蛋白用His-镍蛋白纯化柱纯化;ELISA检测融合蛋白作为诊断抗原的敏感性及特异性。结果该蛋白理化性质较稳定,含有分泌型信号肽;含有构成半胱氨酸蛋白酶催化中心的Cys84、His232和Asn253三个氨基酸残基。成功构建了重组质粒且目的基因在E.coliBL21中获得高效表达,经亲和层析获得了纯化的融合蛋白。融合蛋白可被其免疫的BALB/c小鼠血清及感染广州管圆线虫的小鼠血清识别;作为包被抗原用于ELISA检测小鼠血清其敏感性及特异性均为100%与粗抗原无差别,检测其他寄生虫病人血清及正常人血清其特异性分别为100%和97.4%与粗抗原相比特异性较高。结论广州管圆线虫组织蛋白酶-Z与多个物种组织蛋白酶-Z基因同源,是一种半胱氨酸蛋白酶,含有信号肽,可能是重要的虫体分泌排泄抗原成分,在广州管圆线虫病的免疫诊断方面有潜在的应用前景。
广州管圆线虫;组织蛋白酶-Z;生物信息学;原核表达;免疫诊断
广州管圆线虫在其适宜宿主大鼠体内进入肺动脉并发育为成虫,而在人体及其他非适宜宿主体内主要侵犯宿主中枢神经系统引起嗜酸性粒细胞增多性脑膜脑炎或脑膜炎为主要特征的广州管圆线虫病〔1〕。广州管圆线虫病患者神经系统症状比较明显,如剧烈的头痛、颈项强直等脑膜刺激征,还有感觉过敏、肢体乏力,严重者可致昏迷甚至死亡〔2-3〕,然而广州管圆线虫病无特异的症状或体征,极易误诊、漏诊从而造成严重后果。本实验室从广州管圆线虫功能基因组学研究入手,开展了与致病、诊断和疫苗有关基因的鉴定和功能研究〔4〕。通过对构建的四期幼虫cDNA文库大规模的测序及归类,从中发现了组织蛋白酶-Z的同源基因。本研究通过生物信息学分析揭示该基因及其编码蛋白的结构特征,预测编码蛋白的生物学功能,克隆并通过原核表达该基因获得了融合蛋白,ELISA法检测了该融合蛋白用于诊断广州管圆线虫病的敏感性及特异性,为研制新型广州管圆线虫病诊断试剂盒奠定了基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 清洁级BALB/c雄性小鼠,由中山大学实验动物中心提供。
1.1.2 文库、质粒、菌株 广州管圆线虫四期幼虫全长cDNA质粒文库由本室构建,文库的EST大规模测序和Unigene分析由上海联合基因有限公司完成。原核表达质粒pET30a(+)和E.coliBL21由本室保存。
1.1.3 主要试剂和工具酶 Taq DNA聚合酶,dNTP,K pnⅠ,X hoⅠ,DNA分子量标准(DL2 000)购自广州瑞真生物技术有限公司;T4 DNA连接酶(NEB)购自广州基因公司。异丙硫代2β-D半乳糖苷(IPTG)购自美国 Promega公司;Ni-IDA Agarose购自美国Novagen公司;蛋白分子量标准购自立陶宛MBI公司;DNA凝胶回收试剂盒、质粒纯化试剂盒购自东盛生物公司;H RP标记的山羊抗小鼠IgG二抗、DAB(3,3二氨基联苯胺)显色试剂盒均购自武汉博士德生物工程有限公司;NC膜购自Millipore公司。First Strand cDNA Synthesis Kit购自美津生物试剂公司。
1.1.4 引物合成和DNA测序 基因扩增引物由上海生工生物工程技术服务有限公司合成。重组质粒DNA测序由广州瑞真生物技术有限公司完成。1.1.5 血清 阴性及阳性小鼠血清由本实验室自制;其他寄生虫病患者血清由中山大学中山医学院病原生物诊断中心提供;正常人类血清由本实验室流行病调查收集血清。
1.2 方法
1.2.1 利用生物信息学软件对所选基因与其它物种相似基因的同源性进行预测 预测该基因编码蛋白的基本理化性质及结构、功能特征。
1.2.2 实验动物的感染与广州管圆线虫四期幼虫的获得 广州管圆线虫三期幼虫40条左右灌胃法感染六周龄BALB/c雄性小鼠。感染后20d眼球取血制备阳性小鼠血清;解剖脑部获得广州管圆线虫四期幼虫。
1.2.3 组织蛋白酶-Z基因的扩增Trizol法提取广州管圆线虫四期幼虫的总 RNA,采用cDNA第一链合成试剂盒,根据说明书进行合成广州管圆线虫四期幼虫的总cDNA第一链。根据已获得的广州管圆线虫组织蛋白酶-Z cDNA序列,去除信号肽的编码序列并设计引物。上游引物:ATGGTACCGCTAATAACAGATACAATCTCCG,带KpnⅠ酶切位点;下游引物:ATCTCGAGT TACACAATCGGGTCCG,带X hoⅠ酶切位点。以合成的广州管圆线虫四期幼虫的总cDNA第一链为模板,使用合成的广州管圆线虫组织蛋白酶-Z特异引物扩增目的基因。1%琼脂糖凝胶电泳回收PCR产物。
1.2.4 重组原核表达质粒的构建及鉴定 将PCR产物和原核表达质粒pET30a(+)经K pnⅠ,X hoⅠ,双酶切后回收,连接,转化E.coliBL21感受态细胞,卡那霉素筛选阳性克隆。对阳性克隆提取质粒进行PCR,双酶切。
1.2.5 重组质粒在E.coliBL21中的诱导表达取培养过夜的阳性克隆菌液,加入含有卡那霉素的LB培养基中,37℃250r/min振摇至OD450=0.4~0.6时,加入IPTG诱导表达5h。离心收集菌体,在沉淀中加入1×SDS-PAGE上样缓冲液,处理后离心1min,取上清进行SDS-PAGE电泳分析。
1.2.6 融合蛋白的纯化 经摸索诱导表达条件发现该蛋白为包涵体表达,按优化的诱导表达条件进行大量诱导表达。离心收集菌体,冰上超声裂解,离心收集沉淀,加入含尿素的结合缓冲液重悬沉淀,冰浴溶解包涵体,离心收集上清过滤,参照Ni-IDA Agarose说明书,进行蛋白纯化,收集蛋白洗脱液,SDS-PAGE电泳分析目的蛋白。透析去除尿素对蛋白的影响,蛋白浓缩后-70℃保存备用。
1.2.7 实验动物的免疫及血清IgG抗体滴度的测定 8周龄BALB/c小鼠20只随机分为免疫组和对照组,每组10只。免疫组小鼠每只注射蛋白量约50μ g,与等体积弗氏完全佐剂混匀至乳化;间隔2周进行加强免疫,每只小鼠注射蛋白量与初次免疫剂量相同,与弗氏不完全佐剂混匀至乳化;间隔2周进行第2次加强免疫,与第一次加强免疫相同;腹部四肢等多点皮内注射免疫,每次免疫前断尾取血,第3次免疫后2周,眼球取血,制备血清。对照组不进行免疫,与免疫组小鼠同时取血,制备血清。ELISA法检测实验小鼠血清IgG抗体滴度水平。
1.2.8 Western blotting 将纯化的蛋白进行SDS-PAGE电泳,使用电转移仪于100V冰浴转印1h,将蛋白转移至NC膜上。将含蛋白预染Marker条带剪下观察膜转印效果。一抗分别为His标签单抗(1∶1 000稀释)、免疫小鼠血清(1∶100稀释)、广州管圆线虫感染阳性小鼠血清(1∶100稀释),正常小鼠血清(1∶100稀释),二抗为HRP标记的兔抗小鼠IgG(1∶2 000稀释)。DAB显色至出现目的条带,去离子水终止反应。
1.2.9 两种抗原诊断效果的比较 棋盘滴定法确定融合蛋白检测小鼠血清最佳抗原包被浓度7μ g/mL,检测人类血清最佳抗原包被浓度4μ g/mL;粗抗原检测小鼠血清及人类血清最佳抗原包被浓度均为3μ g/mL;小鼠血清最佳稀释度为1∶300;人类血清最佳稀释度为1∶400;二抗最佳稀释度为1∶30 000。融合蛋白与成虫粗抗原分别用确定的最佳包被浓度包被96孔ELISA板,4℃包被过夜,一抗为待检的小鼠血清、其他寄生虫病患者血清及正常人类血清。二抗相应的为HRP标记的兔抗小鼠IgG和HRP标记的兔抗人IgG。TMB显色,2mol/L的H2SO4终止反应,酶标仪测OD450值,比较两种抗原的诊断效果。
2 结 果
2.1 生物信息学分析 克隆号为00012F09的EST基因在GenBank中与多个物种的组织蛋白酶-Z基因同源,其中与新隐杆线虫的组织蛋白酶-Z的同源性最高,一致性达82%,相似性达89%。在物种进化关系上,与新隐杆线虫及秀丽隐杆线虫源于同一祖先,亲缘关系最近。编码294个氨基酸;N端的17个氨基酸属于分泌型信号肽,未发现线粒体等亚细胞定位序列,无跨膜序列;具有构成真核生物半胱氨酸蛋白酶活性中心的3个氨基酸残基(Asn253,Cys84,His232),片段属于木瓜蛋白酶家族中的半胱氨酸蛋白酶;蛋白的理论分子质量约33.3kDa,在溶液中性质稳定。
2.2 重组质粒的鉴定 将重组质粒进行PCR和双酶切鉴定,产物进行1%琼脂糖凝胶电泳。图1中第1-2泳道是双酶切鉴定结果,在750~1 000bp之间有一清晰的条带,与目的基因的大小基本相符。第3-4泳道PCR结果,出现与目的基因相符的条带;质粒PCR、双酶切表明重组质粒构建成功。
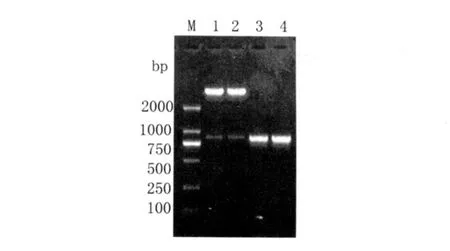
图1 重组质粒的PCR及双酶切鉴定Fig.1 Identification of the recombinants by PCR amplification and double digestion with restriction enzymes
2.3 蛋白表达纯化结果 将构建好的重组质粒转化到E.coliBL-21中表达,SDS-PAGE电泳分析结果如图2-A大约在35kD左右处出现表达条带,与目的蛋白分子量基本相符。将蛋白进行纯化,结果如图2-B,其位置与目的蛋白相符,证明目的蛋白纯化成功。
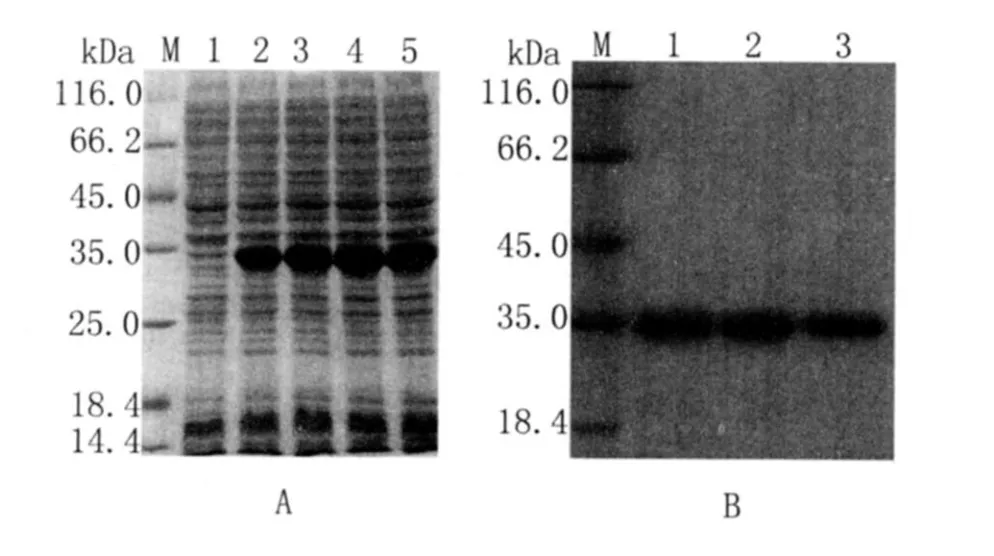
图2 重组质粒在大肠杆菌BL-21中的表达产物及其纯化产物的SDS-PAGE电泳分析Fig.2 SDS-PAGE analysis of the prokaryotic expression product and purified product
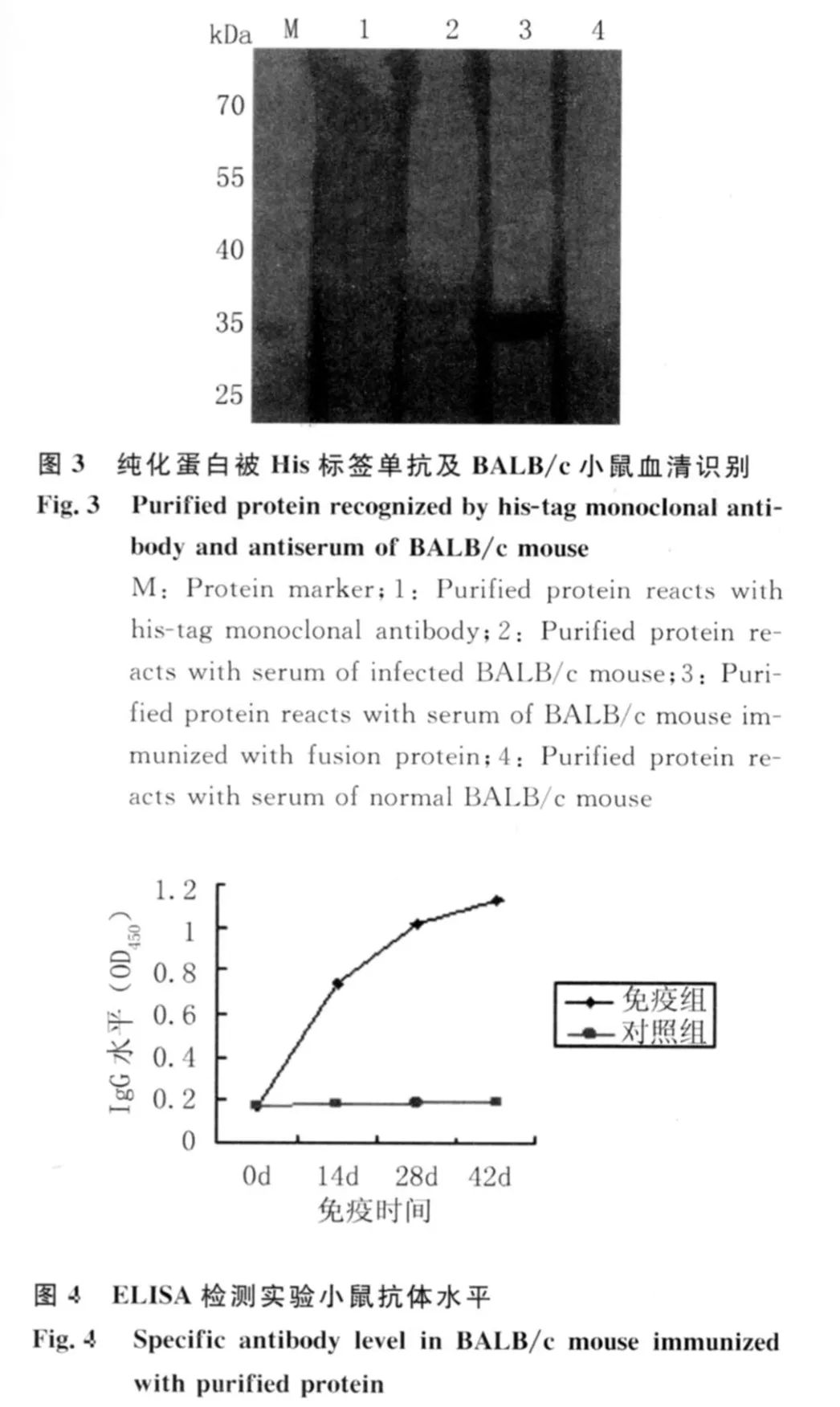
2.3 Western blotting鉴定 His标签单抗、融合蛋白免疫的小鼠血清及感染广州管圆线虫的小鼠血清均与纯化蛋白反应显示清晰的条带。而正常的血清没有出现反应条带,见图3。
2.4 实验小鼠IgG抗体水平的检测 用棋盘滴定法确定的间接ELISA最佳条件,纯化的融合蛋白作为包被抗原检测实验小鼠抗体水平,实验小鼠免疫后血清IgG水平与对照组相比明显升高,表明融合蛋白有很好的抗原性及免疫反应性,见图4。
2.5 纯化融合蛋白与成虫粗抗原诊断效果的评估分别用纯化融合蛋白和粗抗原作为包被抗原检测24份广州管圆线虫感染小鼠血清,20份阴性小鼠血清,根据阴性组的OD值计算临界值(S+3D)。结果:融合蛋白临界值 =0.442,粗抗原临界值 =0.383,两种抗原的敏感性均为 100%(24/24),特异性也为100%(20/20);检测96份其他寄生虫病人血清,根据11份阴性对照血清的OD值计算临界值(S+3D),结果:融合蛋白临界值=0.445,特异性为100%(96/96)粗抗原临界值=0.419,特异性为93.7%(90/96);检测 114份正常人血清,根据 11份阴性对照血清的OD值计算临界值(S+3D),结果:融合蛋白临界值=0.449,特异度为97.4%(111/114),粗抗原临界值=0.465,特异度为 90.4%(103/114)。
通过统计学分析,检测小鼠血清,采用融合蛋白抗原与粗抗原相比,融合蛋白与粗抗原的灵敏度与特异度均为100%,无区别;检测其他寄生虫感染病人血清融合蛋白的特异度高于粗抗原,P=0.029,小于0.05,差别有统计学意义;检测正常人血清采用融合蛋白的特异度比采用粗抗原的特异度高,且P=0.027,小于0.05,差别有统计学意义。统计学处理采用SPSS软件完成。
3 讨 论
广州管圆线虫病的诊断,实验室最常采用ELISA法检测病人血清中的特异抗体。早期用于ELISA检测的包被抗原通常为粗抗原,结果与其他寄生虫有一定的交叉反应〔5-6〕。近年相继报道了用纯化的特异性抗原来检测病人血清和脑脊液中的抗体,在一定程度上降低了交叉反应〔7-9〕。但大量获得上述纯化抗原均较困难,因此克隆表达广州管圆线虫具有高敏感性和特异性的抗原组分是广州管圆线虫病免疫诊断研究的重要方向。本实验通过生物信息学分析发现广州管圆线虫组织蛋白酶-Z含有信号肽,无线粒体等其他亚细胞靶向定位结构,无跨膜区域,因此推断该蛋白酶为一种分泌性的蛋白酶,作为分泌抗原则有可能进入宿主体内刺激宿主产生可供临床检测的特异抗体;该蛋白酶是一种半胱氨酸蛋白酶,有研究表明半胱氨酸蛋白酶是多种寄生虫的免疫优势抗原,作为诊断抗原具有很好的敏感性及特异性〔10〕;与其它物种的组织蛋白酶-Z同源性较高,因此可能存在一定的交叉反应,这也可能是ELISA检测值较高的原因之一。
本研究成功构建了广州管圆线虫组织蛋白酶-Z的原核表达载体,并获得了高效表达,表达产物以包涵体的形式存在,经变性处理后亲和层析纯化能得到大量融合蛋白以供免疫动物或作为诊断抗原进行ELISA检测。使用该融合蛋白对免疫小鼠血清IgG抗体水平的检测及Western blotting结果表明该蛋白酶具有很好的免疫原性和免疫反应性;用于ELISA法检测小鼠血清其敏感性及特异性与粗抗原无差别,对患其他寄生虫病人类血清及正常人血清的检测特异性高于粗抗原,因此该蛋白酶在广州管圆线虫病的免疫诊断方面有潜在的应用价值。然而本实验尚未能全面评价广州管圆线虫组织蛋白酶-Z在免疫诊断中的应用价值,首先本实验检测的阳性小鼠其感染度均较高(感染度最低者脑部检出24条四期广州管圆线虫),因此还需对不同感染度的血清进行检测,进一步评价其敏感性;此外本实验仅对血清IgG抗体进行了检测,有研究表明,广州管圆线虫感染小鼠或大鼠后其血清中特异性IgM抗体水平在感染后早期即开始升高,第6~8d可达高峰〔11-12〕。因此尚需对特异性IgM 抗体进行检测,进一步评价融合蛋白在早期诊断中的价值。
〔1〕詹希美.人体寄生虫学(八年制)〔M〕.北京:人民卫生出版社2005:227-229.
〔2〕Sawanyawisuth K,T akahashi K,Hoshuyama T,et al.Clinical factors predictive of encephalitis caused byAngiostrongy lus cantonensis〔J〕 .Am J T rop Med Hyg,2009,81(4):698-701.
〔3〕李道宁,何蔼,李旭东,等.广州管圆线虫病致3例婴幼儿死亡报告〔J〕.第一军医大学学报,2001,21(12):42-43.
〔4〕He H,Cheng M,Yang X,et al.Preliminary molecular characterization of the human pathogenAngiostrongy lus cantonensis〔J〕.BMC Mol Biol,2009,10:97.
〔5〕Chye SM,Yen CM,Chen ER.Detection of circulating antigen by monoclonal antibodies for immunodiagnosis ofangiostrongy liasis〔J〕 .Am J T rop Med Hyg,1997,56(4):408.
〔6〕朱佩娴,熊钟谨,吴春云,等.Dot-ELISA检测广州管圆线虫抗体的研究〔J〕.中国人兽共患病学报,2002,18(5):51-53.
〔7〕Maleewong W,Sombatsawat P,Intapan PM,et al.Immunoblot evaluation of the specificity of the 29-kDa antigen from young adult female wormsAngiostrongylus cantonensisfo r immunodiagnosis of human angiostrongyliasis〔J〕.Asian Pac J Allergy Immunol,2001,19(4):267-273.
〔8〕Chye SM,Chang JH,Yen CM.Immunodiagnosis of human eosinophilic meningitis using an antigen ofAngiostrongylus cantonensisL5with molecular weight 204 kD〔J〕.Acta Trop,2000,75(1):9-17.
〔9〕李华,陈晓光,沈浩贤,等.广州管圆线虫M r32000抗原的免疫诊断效果评价〔J〕.第一军医大学学报,2005,25(4):380-383.
〔10〕段文元,邱宗文.半胱氨酸蛋白酶在医学寄生虫学领域的研究进展〔J〕.中国血吸虫病防治杂志,2004,16(3):231-235.
〔11〕陈代雄,沈浩贤,李小敏,等.广州管圆线虫感染大鼠血清 IgM抗体水平的动态观察〔J〕.中国热带医学,2006,6(8):1356-1358.
〔12〕卢改会,申丽洁,何蔼,等.IgM-ELISA法早期诊断广州管圆线虫感染的初步研究〔J〕.中国人兽共患病学报,2009,25(1):56-58.
Prokaryotic expression of cathepsin Z gene fromAngiostrongylus cantonensisand the immunological analysis of the fusion protein
YUE Yong-liang,YU Yan-jie,YANG Xiao,CHENG Mei,HE Ai,QU Zhen-yu,LIU Jjin,WANG Lin,LI Zhuo-ya,ZHAN Xi-mei
(Department of Parasitology,ZhongshanSchool of Medicine,Sun Yat-sen University,Guangzhou510080,China)
In order to clone and express cathepsin Z gene ofAngiostrongyluscantonensis(A.cantonensis)to evaluate its prospects in immunodiagnosis,bioinformatics analysis tools were applied to analyze physicochemical properties,structural,and functional characteristics of gene encoded protein.Target gene was cloned into prokaryotic expression vector pET30a(+)and the recombinant was identified by PCR and double enzyme digestion respectively.When the recombinant was expressed inE.coliBL21 by IPTG induction,the expressed product was identified by SDS-PAGE and the fusion protein was purified by Ni-IDA affinity chromatography.As fusion protein was used as diagnostic antigen,the sensitivity and specificity of that were tested by ELISA.The protein contained a secretory signal peptide with stable physicochemical property and three key amino acids for cysteine proteinase,which contained Cys84,His232 and Asn253 to form the catalytic sites.The recombined plasmid was successfully constructed and expressed inE.coliBL21 effectively.Purified protein was obtained by affinity chromatography and could react with serum of mouse that infected withA.cantonensisor immunized with the fusion protein.ELISA results showed that the sensitivity and specificity were 100%in testing serum of mouse by using fusion protein as the coating antigen,and has no difference compared with crude antigen.But in the test for human serum,its specificity was higher than that of crude antigen.In conclusion,cathepsin Z ofA.cantonensisis homologous with cathepsin Z from other species and contained a secretory signal peptide.It is probably a crucial component of excretory-secretory antigen and might be a promising candidate for immunodiagnosis of Angiostrongyliasis.
Angiostrongyluscantonensis;Cathepsin-Z;bioinformatics;prokaryotic expression;immunodiagnosis
R383.1
A
1002-2694(2010)09-0810-04
*国家自然科学基金-广东省人民政府联合基金(u0632003);973项目(2010CB530004)基金资助
詹希美,Email:zhanximei@yahoo.com.cn
中山大学中山医学院寄生虫学教研室,广州 510080
2010-01-19;
2010-06-20
