实验性脑出血后大鼠神经细胞凋亡与NF-κB的表达
2010-07-30滕伟禹
吴 丹,滕伟禹
(中国医科大学附属第一医院神经内科,辽宁沈阳 110001)
脑出血是神经系统常见病,出血后继发性损害导致的神经细胞死亡具有重要临床意义,细胞凋亡(apoptosis)作为一种基因调控的细胞死亡方式可能为其中的一个重要环节。陈吉相等[1]研究发现,假手术组偶见凋亡细胞,表明正常脑组织一般不发生细胞凋亡;脑出血后凋亡细胞数明显增多,据此认为,细胞凋亡是脑出血周围组织损伤的一个标志,在一定程度上反映了其受损伤的程度。核因子-κB(nuclear factor kappa B,NF-κB)是一种广泛存在、功能多样的核转录因子,参与多种炎症相关基因的表达和调控[2]。近年来的研究显示,NF-κB在中枢神经系统中广泛存在,可见于大脑皮质、海马和小脑突触,神经元、神经胶质细胞与血管内皮细胞中均有表达[3]。目前关于脑出血后血肿周围组织NF-κB表达的研究甚少。本实验应用立体定向技术,将自体不凝血注入大鼠尾状核制备脑出血模型,用TUNEL染色观察神经细胞凋亡,用免疫组化染色观察NF-κB的表达,并初步探讨脑出血后神经细胞凋亡与NF-κB表达的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
健康雄性SD大鼠45只,体重250~300 g,由中国医科大学实验动物中心提供。将大鼠随机分为脑出血组和假手术组,分别按6 h、1 d、3 d、7 d分为4个亚组,每组5只;另设对照组5只。
1.1.2 试剂与器材
NF-κB/p65兔抗鼠多克隆抗体、即用型SABC免疫组化试剂盒、细胞凋亡检测试剂盒均购自武汉博士德生物工程有限公司;动物头颅立体定位仪(SN-2,NARISHIGHE,日本);微量注射器(上海激光医学仪器厂);电子分析天平(BP211D,赛多利斯,德国);OLYMPUS光学显微镜(日本);图像分析仪(Metamorph Image System V4.6 VIC,美国);紫外分光光度仪(UV300,Spestronic Unicam,美国)。
1.2 方法
1.2.1 大鼠脑出血模型的制作
将大鼠用10%水合氯醛(300 mg/kg)腹腔注射麻醉后,用微量注射器从大鼠右侧股动脉抽取70 μl血。在立体定位仪引导下将50 μl血缓慢注入右侧尾状核(前囟前0.2 mm,中线右旁3.0 mm处),进针6 mm,留针10 min后退针。假手术组注入50 μl生理盐水,其他操作同实验组。对照组不给予任何处置。术后观察大鼠的行为改变,给水、给食饲养。根据实验计划在不同时间点将大鼠断头取脑。
1.2.2 标本的采集及检测
在各时间点前15 min用过量水合氯醛麻醉大鼠后,开胸经左心室插管至主动脉(0.5 min内),依次灌注生理盐水100 ml及4℃4%多聚甲醛溶液250 ml,断头取脑,固定于4%多聚甲醛溶液中持续12~24 h,然后进行酒精脱水,二甲苯透明,浸蜡,包埋。
1.2.2.1 常规HE染色 切片常规脱蜡、水化,依次经苏木素染色、1%盐酸酒精分化、返蓝以及伊红染色后进行脱水、透明、封片。光镜下观察,胞质为红色,胞核为蓝色。
1.2.2.2 TUNEL染色 以TUNEL法检测凋亡细胞。切片常规脱蜡、水化,滴加脱氧核糖核酸转移酶(TDT)和地高辛标记的dUTP反应液,37℃孵育120 min;滴加生物素化抗地高辛抗体,37℃孵育30 min后DAB显色,苏木素复染,脱水、透明、封片。
1.2.2.3 NF-κB/p65免疫组化染色 用免疫组化SABC法检测NF-κB/p65蛋白的表达。切片常规脱蜡、水化后行抗原热修复,滴加 50 μl兔抗鼠多克隆 NF-κB/p65 抗体(1∶200),4℃过夜;然后滴加生物素化山羊抗兔IgG,室温20 min;滴加SABC,室温20 min。DAB显色,苏木素复染,脱水,透明,封片。
1.3 统计学处理
在400倍光镜下观察并随机选择血肿周围5个不重复视野,计算阳性细胞积分光密度。所有数据以均数±标准差()表示,采用SPSS 13.0软件进行数据分析,采用t检验及Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 HE染色
脑出血后6 h可见轻度脑水肿,血肿内红细胞形态完整。1 d可见脑水肿明显,血肿周围可见中性粒细胞及淋巴细胞浸润,胶质细胞开始增生。3 d时脑水肿最重,大量炎症细胞浸润,胶质细胞增生明显,大量神经元变性坏死。7 d时血肿有所吸收,血肿周围组织疏松,胶质细胞及血管增生明显。假手术组及对照组无明显病理改变。见图1。

图1 脑出血后不同时间点HE染色(×400)
2.2 TUNEL染色
TUNEL染色阳性细胞是凋亡细胞,表现为核周染色质浓缩的点状深染棕褐色细胞。凋亡细胞在脑出血后6 h出现,1 d明显增多,3 d达到高峰,此后逐渐减少,持续到7 d,与对照组比较,差异有统计学意义(P<0.05)。凋亡细胞主要分布在脑出血周围组织和同侧大脑皮层。假手术组仅见及少量凋亡细胞。见表1、图2。
表1 脑出血后不同时间点TUNEL阳性细胞表达(,积分光密度/HP)

表1 脑出血后不同时间点TUNEL阳性细胞表达(,积分光密度/HP)
与对照组比较,*P<0.05;与脑出血组6 h比较,#P<0.05
组别 时间6 h 1 d 3 d 7 d对照组(n=5)2.11±1.19---假手术组(n=5)5.12±0.736.39±2.138.48±3.738.42±1.75脑出血组(n=5)27.95±7.51*62.93±1.95*#88.59±4.91*#57.16±4.18*#
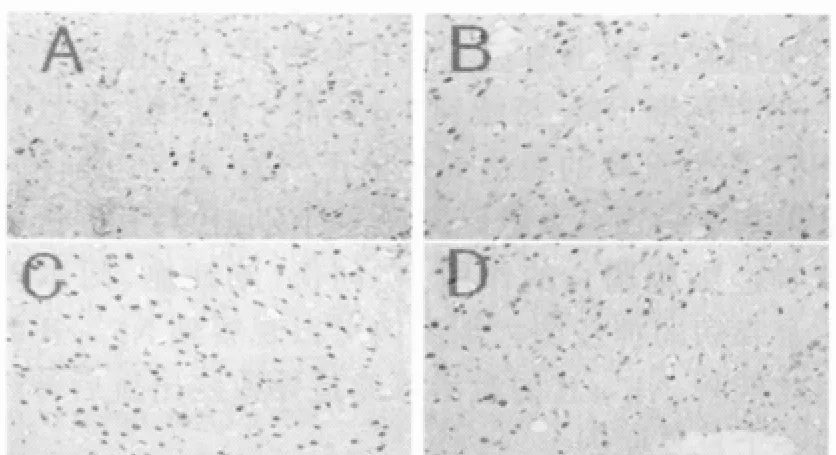
图2 脑出血后不同时间点TUNEL阳性细胞的表达(×400)
2.3 NF-κB/p65免疫组化染色
脑出血周围组织NF-κB/p65阳性细胞于术后6 h开始出现,1 d后逐渐增多,3 d达高峰,此后逐渐减少,持续到7 d仍高于对照组(P<0.05)。阳性表达部位为胞核,主要表达于神经细胞和少量胶质细胞。假手术组可见极少量阳性细胞。见表 2、图 3。
表2 脑出血后NF-κB/p65蛋白表达(,积分光密度/HP)

表2 脑出血后NF-κB/p65蛋白表达(,积分光密度/HP)
与对照组比较,*P<0.05;与脑出血组6 h比较,#P<0.05
组别 时间6 h 1 d 3 d 7 d对照组(n=5)4.29±1.96---假手术组(n=5)12.67±3.5213.64±2.5818.84±3.9618.06±3.72脑出血组(n=5)30.31±3.97*#53.17±1.32*#88.37±8.67*#42.86±1.60*#
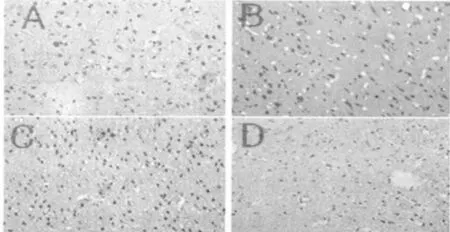
图3 脑出血后不同时间点NF-κB/p65阳性细胞的表达(×400)
2.4 脑出血后神经细胞凋亡与NF-κB/p65表达的相关性分析
脑出血后TUNEL表达与NF-κB/p65表达呈正相关(r=0.957,P<0.01)。
3 讨论
凋亡即程序性死亡,是在中枢神经系统涉及正常发育、再生、增殖和病理变性的细胞死亡的主要方式[4]。已有研究发现,在缺血性脑组织的不同部位可见到神经细胞凋亡[5-6]。本实验结果显示,凋亡细胞在脑出血后6 h出现,3 d达高峰,7 d时仍有少量表达,提示脑出血后存在细胞凋亡且呈动态性变化,据此推断细胞凋亡是脑出血周围组织损伤的一个重要标志。
NF-κB是一种广泛存在、功能多样的核转录因子,它在免疫、炎症、细胞生长、分化、凋亡、癌变和个体发育等方面发挥着多种重要的生物学功能[7]。它由ReIA(p65)和p502个亚基以二聚体形式组成,仅p65含有激活转录的处理区[8]。已有研究证实,脑出血早期即有NF-κB表达,参与脑出血周围组织继发性损伤及脑水肿形成[9]。刘兵荣等[10]也研究发现NF-κB与脑出血后脑水肿有关。本实验结果显示,NF-κB/p65免疫组化阳性细胞于脑出血后6 h开始增多,1 d继续上升,3 d达高峰,此后逐渐下降,持续到7 d仍高于对照组,并且NF-κB与TUNEL阳性细胞的表达变化呈正相关,这与刘宗超等[11]的实验结果基本一致。大量研究证实,NF-κB具有促进中枢神经系统神经细胞凋亡的作用,在创伤、脑缺血、阿尔茨海默病及帕金森病的神经凋亡细胞内可以观察到NF-κB的激活[12-13]。由此推断,NF-κB的激活可能是导致脑出血后神经细胞凋亡的一个重要原因。
综上所述,脑出血后存在细胞凋亡,且可能与NF-κB的激活有关。进一步研究其具体机制将为脑出血的治疗提供新的思维空间。
[1]陈吉相,季艳梅,孙圣刚,等.依达拉奉对脑出血大鼠细胞凋亡及NF-κB表达的影响[J].山东医药,2007,47(1):7-8.
[2]周向阳,吴家幂.大鼠脑出血后血肿周围核因子-κB的表达和意义[J].皖南医学院学报,2006,25(1):15-17.
[3]董为伟.神经保护的基础与临床[M].北京:科学出版社,2002:230-235.
[4]Orrenius S.Mitochondnal regulation of apoptotic cell death [J].Toxicol Left,2004,149(1):19-23.
[5]Niwa M,Hara A,Iwai T,et al.Caspase activation as an apoptotic evidence in the gerbil hippocampal CA1 pyramidal cells following transient forebrain ischemia[J].Neurosci Lett,2001,300(2):103-104.
[6]Namura S,Zhu J,Fink K,et al.Activation and cleavage of caspase-3 in apoptosis induced by experimental cerebral ischemia[J].J Neuro,1998,18(10):3659-3660.
[7]Siebenlist U,Franzoso G,Brown K,et al.Structure,regulation and function of NF-kappa B[J].J Annu Rev Cell Biol,1994,10(2):405-455.
[8]Chen FE,Huang DB,Chen YQ,et al.Crystal structure of p50/p65 heterodimer of transcription factor NF-κB bound to DNA[J].J Nature,1998,391(22):410-413.
[9] AronowskiJ,HallCE.New horizonsforprimary intracerebral hemorrhage treatment:experience from preclinical studies[J].Neurol Res,2005,27(9):268-279.
[10]刘兵荣,丁新生,张勇,等.大鼠脑出血后核因子-κB的表达及黄芪多糖的干预作用[J].中国神经免疫学和神经病学杂志,2007,14(2):160-163.
[11]刘宗超,饶明俐,周官恩.实验性脑出血中NF-κB的动态表达及其与凋亡的关系[J].中风与神经疾病杂志,2007,24(3):288-290.
[12]Aoki E,Yano R,Yokoyama H,et al.Role of nuclear transcription factor kappa B(NF-kappa B)for MPTP(1-methyl-4-phenyl-1,2,3,6-tetrahyropyridine)-induced apoptosis in nigral neurons of mice[J].Experimental and Molecular Pathology,2009,86(10):57-64.
[13]Pizzi M,Spano P.Distinct roles of diverse nuclear factor-kappa B complexes in neuropathological mechanisms[J].Eur J Pharmacol,2006,545(7):22-28.
