基于蛋白质组学探讨丹参饮对高脂血症模型大鼠血脂异常的调节机制Δ
2024-05-14张玉昆冯月男卞敬琦刘欣欣肖洪彬牛雯颖黑龙江中医药大学实验实训中心黑龙江中医药大学教育部北药基础与应用研究重点实验室哈尔滨150040
张玉昆,冯月男,卞敬琦,刘欣欣,肖洪彬,牛雯颖 (黑龙江中医药大学实验实训中心/黑龙江中医药大学教育部北药基础与应用研究重点实验室,哈尔滨 150040)
高脂血症是一种体内脂质代谢紊乱性疾病,临床表现为血浆甘油三酯(triglyceride,TG)、胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)升高和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)降低[1]。我国成年血脂异常者超过2亿人,是心脑血管病易发人群[1—2]。因此,对高脂血症的发病机制和治疗机制进行研究具有重要的社会意义。
丹参饮是治疗气滞血瘀证的经典方剂,具有活血化瘀、行气止痛之功。临床和基础实验研究发现,丹参饮加减服用月余可明显降低临床患者血清TG、TC水平,亦可显著降低高脂饲料和高脂乳剂诱导的高脂血症模型大鼠血浆TC、TG、LDL-C水平[3—4]。本课题组前期基础研究及以往多项研究均证实,丹参饮可以有效改善血脂水平[5—8]。高脂血症的发生、发展机制极为复杂,但是脂质代谢的相关酶、脂质转运的相关蛋白具有表达相对稳定、可被检测等特征,且肝脏是脂质代谢的重要器官。本研究拟通过对高脂血症模型大鼠肝脏进行蛋白质组学研究,从蛋白质表达谱角度解读丹参饮治疗高脂血症的靶点蛋白,以期明确丹参饮对高脂血症模型大鼠血脂异常的调节机制。
1 材料
1.1 主要仪器与软件
本研究使用的主要仪器与软件有:C18反相色谱柱、S-3500RS型色谱仪、Q-Exactive Plus型质谱仪、Vanquish Flex型二元超高效液相色谱(UPLC)仪、Xcalibur 4.0数据采集软件(美国Thermo Fisher Scientific公司),ACQUITY UPLC BEH C18色谱柱(美国Waters公司),TGL-16G型台式高速离心机(苏州捷美电子有限公司),7600-020型全自动生化分析仪(日本株式会社日立高新技术公司),BX43型光学显微镜(日本Olympus公司),LE204E型分析天平(瑞士Mettler Toledo公司),iMARK型酶标仪(美国Bio-Rad公司),DYY-7C型电泳仪、WD-9413B型凝胶成像分析系统、DYCZ-40D型转移槽(北京六一生物科技有限公司)。
1.2 主要药品与试剂
丹参饮水煎液由实验室自制。处方组成为《时方歌括》中原方用量:丹参30 g,檀香3 g,砂仁3 g。以上3味中药饮片均购自哈尔滨市道外区新安康药材站,产地分别为山东、云南、广东,批号分别为210301、210502、210101,经黑龙江中医药大学田明教授鉴定,所有饮片均符合2020年版《中国药典》标准。煎煮工艺:以上处方组成按比例扩大5倍,药材用8倍量(mL/g)水浸泡0.5 h后,冷凝回流提取2次,合并煎煮液,浓缩煎煮液,最终煎液含生药质量浓度为0.36 g/mL。
TC、TG、LDL-C、HDL-C试剂盒(批号分别为212027、218061、221651、221751)均购自中生北控生物科技股份有限公司;氨水、四乙基溴化铵(tetraethylammonium bromide,TEAB)缓冲液、碘乙酰胺(批号或货号分别为P1210525、BCBR4372V、P1806457)均购自德国Sigma公司;改良胰蛋白酶(货号409668)购自美国Promega公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙酮(批号分别为21190409、21201202)均购自国药集团上海有限公司;TMT 10PlexTM标记试剂、蛋白酶抑制剂混合物、预染蛋白、乙腈、甲醇、甲酸、去离子水、BCA蛋白检测试剂盒、三(2-羧乙基)膦盐酸盐|[tri(2-carboxyethyl)phosphine hydrochloride,TCEP]溶液、预制聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶(批号或货号分别为VL320580、410069、983063、211448、213511、215715、210416、UI289351、VG305342、21121170)均购自美国Thermo Fisher Scientific公司;兔源环氧化物水解酶2(epoxide hydrolase 2,EPHX2)多克隆抗体、兔源围脂滴蛋白2(perilipin 2,PLIN2)重组抗体、兔源过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)多克隆抗体、兔源糖原合酶激酶3β(glycogen synthase kinase-3β,GSK-3β)多克隆抗体、β-肌动蛋白(β-actin)多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG(货号分别为bs-3880R、bsm-54764R、bs-0530R、bs-0028R、bs-0061R、bs-0295G)均购自北京博奥森生物技术有限公司。
1.3 实验动物与饲料
42只健康清洁级雄性Wistar大鼠(220~240 g)购自哈尔滨医科大学,实验动物生产许可证号为SCXK(黑)2018-003。大鼠饲养于黑龙江中医药大学动物实验中心。本实验方案通过黑龙江中医药大学实验动物伦理委员会批准(批件号为2021012802),并严格按照伦理委员会批准方案实施。高脂饲料购自北京科澳协力饲料有限公司,由基础饲料、蔗糖、猪油、胆固醇、胆酸钠组成,含量分别为67%、20%、10%、2.5%、0.5%。
2 方法
2.1 分组、造模与给药
42只大鼠在经过7 d适应性喂养后,分为空白组(n=14)和高脂组(n=28)。空白组大鼠给予基础饲料喂食,高脂组大鼠给予高脂饲料喂食。于第8周末检测造模大鼠的血脂水平,参考第4版《药理实验方法学》中标准,当血脂四项中有一项水平异常,则认为造模成功。高脂组造模成功的大鼠根据体重和血脂水平,随机分为模型组、丹参饮组,继续喂养高脂饲料。根据前期研究结果,丹参饮临床等效剂量(3.6 g/kg)为最优剂量(药效学最显著)[9],鉴于本研究目的在于探讨丹参饮的对血脂异常的调节机制,因此采用单一剂量(3.6 g/kg)进行蛋白质组学研究。分组后,于第9周开始,丹参饮组大鼠灌胃相应药液(以蒸馏水为溶剂,按生药量计,根据临床等效剂量换算而得),空白组和模型组大鼠灌胃等体积生理盐水,每天1次,连续4周。
2.2 样本采集
大鼠给药第4周后禁食、不禁水,在最后一次给药30 min后,腹腔注射1%戊巴比妥钠进行麻醉,在髂主动脉取血,置于含有枸橼酸钠的抗凝管中,用于血脂水平检测。取大鼠部分肝脏组织于-80 ℃冻存用于蛋白质组学研究,剩余肝脏固定位置切成数块,置于10%中性福尔马林中用于病理形态观察。
2.3 大鼠血脂水平检测
采用全自动生化分析仪检测。取“2.2”项下抗凝血以3 000 r/min离心12 min后获取上层血浆,按相应试剂盒说明书要求检测血浆TC、TG、LDL-C、HDL-C水平。
2.4 大鼠肝脏组织病理形态学检测
采用苏木精-伊红(HE)染色法观察。取“2.2”项下固定位置切块的肝脏组织适量,经常规包埋,切片,透明,脱蜡,脱水,苏木精染色8 min;水洗后,伊红染色2 min;再次水洗,脱水,透明2次;经中性树胶封片后,置于光镜下观察大鼠肝脏组织的病理形态变化情况。
2.5 TMT定量蛋白质组学分析
分别从空白组、模型组和丹参饮组中随机选取3只大鼠的肝脏样本进行TMT定量蛋白质组学分析。
2.5.1 样本质控分析
(1)肝脏样本蛋白的提取。在冷冻状态下取出样本,转移至振荡管中;加入适量含蛋白酶抑制剂的蛋白裂解液(8 mol/L尿素+1%SDS);组织研磨仪上振荡研磨3次,每次40 s;冰上裂解30 min,每5 min漩涡混匀1次,时长为10 s;以16 000 r/min离心30 min,温度设置为4 ℃,取上清液备用。(2)BCA法定量蛋白质浓度。应用BCA蛋白检测试剂盒,并按照要求操作,用酶标仪测得562 nm波长处的吸光度,绘制标准曲线并计算样本浓度。(3)SDS-PAGE。对9个样本进行SDS-PAGE(上样量为15 μg)。(4)样本处理和液相串联质谱检测。①取100 μg蛋白样本,用裂解液补充体积至90 μL,分别加入终浓度100 mmol/L的TEAB和终浓度10 mmol/L的TCEP,置于37 ℃下反应1 h,再加入终浓度40 mmol/L的碘乙酰胺,避光条件下室温反应40 min;各管分别加入6倍体积的预冷丙酮,置于-20 ℃条件下沉淀4 h,然后以16 000 r/min离心20 min;弃上清液,沉淀用100 μL 50 mmol/L的TEAB充分溶解,按照样品质量加入2%胰蛋白酶,在37 ℃条件下酶解过夜。②用TMT试剂标记肽段并进行等量混合,每100 μg多肽加入一管TMT试剂,室温孵育2 h;加入羟胺,室温反应15 min,按顺序分别标记9个样本。③利用C18反相色谱柱对肽段进行预分离,用UPLC上样缓冲液复溶多肽样本后用C18反相色谱柱进行高pH液相分离。④将分离馏分合并成10个馏分真空离心浓缩后,用质谱上样缓冲液溶解,进行第二维分析。色谱分离时间为120 min;流动相A为2%乙腈、0.1%甲酸;流动相B为80%乙腈、0.1%甲酸;流速为300 nL/min;质谱扫描范围为m/z350~1 300;采集模式为数据依赖型采集,Top 20,输出raw文件,进行数据库搜索。
2.5.2 差异蛋白分析
经搜库鉴定和波峰分析,获得不同样本中同一蛋白的表达丰度;再进行样本间蛋白的差异表达分析,筛选出样本间的差异蛋白。通过设置显著性差异检验方法及蛋白表达量差异倍数,运用统计学方法,获得显著差异表达蛋白的信息及差异数据表。
2.6 大鼠肝脏组织中EPHX2、PLIN2、GSK-3β、PPARγ蛋白表达的检测
采用Western blot法检测。每组随机选取3个冷冻肝脏组织样本,精密称取100 mg,剪碎,加入组织蛋白裂解液,用研磨仪研磨裂解后,以4 ℃、13 000 r/min离心10 min,取上清液,采用BCA蛋白定量法检测蛋白浓度。加蛋白上样缓冲液,95 ℃煮沸变性,SDS-PAGE分离,将凝胶中的蛋白转印至PVDF膜上,用封闭液在室温下摇床封闭1 h;添加一抗(EPHX2、PLIN2、GSK-3β、PPARγ的稀释比例均为1∶1 000),4 ℃下孵育过夜,TBST洗膜3次;特异性蛋白与二抗(HRP标记的山羊抗兔IgG稀释比例为1∶5 000)室温下孵育2 h,TBST洗膜3次;成像系统曝光显影、拍照。采用PhotoShop整理去色,采用Alpha软件计算各条带的灰度值,以目的蛋白灰度值与内参β-actin蛋白灰度值的比值表示目的蛋白的表达水平。
2.7 统计学处理
采用SPSS 22.0软件对数据进行统计分析。计量资料满足正态分布以±s表示,多组间比较采用单因素方差分析,组间进一步两两比较采用LSD-t检验。检验水准α=0.05。蛋白质组学通过差异倍数和P值筛选组间差异蛋白。差异分析采用Student’st检验,双尾检验,上调差异倍数1.20,下调差异倍数0.83。蛋白质组学中的P<0.05表示蛋白表达有差异。
3 结果
3.1 丹参饮对大鼠血脂水平的影响
实验过程中因操作不当每组大鼠有脱落,但例数仍满足统计学要求。与空白组比较,模型组大鼠血浆TC、TG、LDL-C水平均显著升高(P<0.05),血浆HDL-C水平显著降低(P<0.05)。与模型组比较,丹参饮组大鼠血浆TC、TG、LDL-C水平均显著降低(P<0.05),血浆HDL-C水平显著升高(P<0.05)。结果见表1。
表1 各组大鼠血脂水平比较(±s)

表1 各组大鼠血脂水平比较(±s)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05。
组别空白组模型组丹参饮组LDL-C/(μmmol/L)0.66±0.14 0.84±0.21a 0.67±0.13b例数9 8 9 TC/(mmol/L)1.62±0.36 2.43±0.72a 1.67±0.54b TG/(mmol/L)0.34±0.12 0.47±0.16a 0.30±0.10b HDL-C/(μmmol/L)1.08±0.15 0.89±0.17a 1.05±0.14b
3.2 丹参饮对大鼠肝脏组织病理形态的影响
HE染色结果显示,空白组大鼠肝脏组织染色均匀,细胞质、细胞核清晰,肝板呈放射状排列,肝血窦间隙排列清晰,未见变性和炎症细胞浸润。模型组大鼠肝脏组织染色不均,肝板排列紊乱,肝血窦消失,部分细胞的细胞核固缩或消失,细胞质肿胀、融合,结缔组织增生,呈现弥散性空泡样脂肪滴改变。与模型组比较,丹参饮组大鼠肝脏组织上述病理形态均有不同程度的改善。结果见图1。

图1 各组大鼠肝脏组织病理形态显微图(HE染色,×400)
3.3 TMT定量蛋白质组学分析结果
3.3.1 样本质控分析结果
电泳结果显示,9个样本电泳图相对清晰,无拖尾现象,组内条带相对稳定,可用于后续实验研究。根据峰形和时间每组共收取20个馏分,合并成10个馏分。结果见图2。
图2 9个样本的SDS-PAGE电泳图
3.3.2 差异蛋白分析结果
搜库鉴定结果共鉴定蛋白5 866个。波峰分析结果显示,模型组和空白组样本间共筛选出显著差异表达蛋白298个,相对表达水平显著升高的蛋白数目为151个,相对表达水平显著降低的蛋白数目为147个。其中,EPHX2差异倍数为2.5倍,是最显著的差异蛋白;差异蛋白环加氧酶1(cyclooxygenase 1,COX1)、COX2均处于低表达水平,并与EPHX2在蛋白功能上存在一定联系。丹参饮组和模型组样本共筛选出显著差异表达蛋白139个,相对表达水平显著升高的蛋白数目为47个,相对表达水平显著降低的蛋白数目为92个。其中PLIN2差异倍数为0.41倍,是较为显著的差异蛋白,参与PPAR信号通路,是脂质类代谢的关键信号调节通路;GSK-3β差异倍数为1.9倍,也是较为显著的差异蛋白,其参与调节糖脂代谢。结果见图3。上述差异蛋白均为表达差异倍数较为显著的差异蛋白,因此,选择EPHX2、PLIN2、GSK-3β、PPARγ进行后续试验验证。
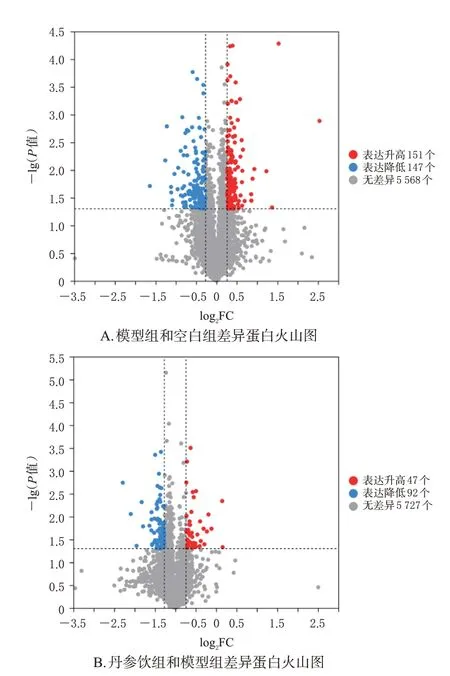
图3 差异蛋白火山图
3.4 大鼠肝脏组织中EPHX2、PLIN2、GSK-3β、PPARγ蛋白表达结果
与空白组比较,模型组大鼠肝脏组织中EPHX2、PLIN2蛋白表达水平均显著升高(P<0.01),GSK-3β、PPARγ蛋白表达水平均显著降低(P<0.01)。与模型组比较,丹参饮组大鼠肝脏组织中EPHX2、PLIN2蛋白表达水平均显著降低(P<0.01),GSK-3β、PPARγ蛋白表达水平均显著升高(P<0.01)。结果见图4、图5。
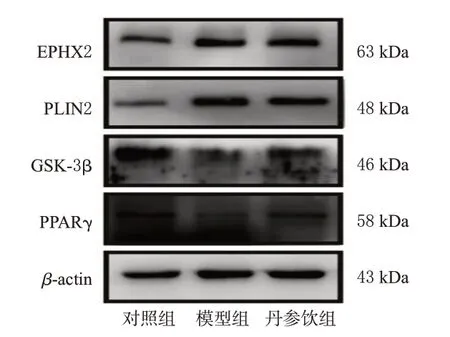
图4 各组大鼠肝脏组织中关键差异蛋白表达的电泳图

图5 各组大鼠肝脏组织中关键差异蛋白表达水平柱状图(n=3)
4 讨论
本研究发现模型大鼠血浆中TC、TG、HDL-C、LDLC水平均发生显著改变,大鼠肝脏病理形态学发生显著改变,有大量脂肪滴改变,说明高脂饲料喂养引起了模型大鼠血脂水平异常和肝细胞脂肪性改变,通过高脂饲料喂养复制的模型比较成功。通过丹参饮治疗后模型大鼠的血脂水平和肝脏组织细胞发生显著改善,说明丹参饮对高脂血症有显著的治疗作用。
为了进一步探究丹参饮对高脂血症的作用机制,笔者对各组大鼠的肝脏组织进行了蛋白质组学研究,结果显示,模型组和空白组相比较,鉴定到的差异蛋白数量最多,其中EPHX2差异倍数为2.5倍,是最显著的差异蛋白;丹参饮组与模型组比较,PLIN2和GSK-3β亦是较为显著的差异蛋白;丹参饮组和模型组差异蛋白的富集信号通路中,PPAR信号通路是与脂质代谢密切相关的信号通路。因此,本研究对以上较为显著差异蛋白EPHX2、PLIN2、GSK-3β和PPAR信号通路中关键蛋白PPARγ进行了蛋白验证。
EPHX2参与PPARγ信号通路和花生四烯酸代谢信号通路[10]。有研究发现,EPHX2在肥胖人群中高表达,其抑制剂能够显著预防高脂饮食引起的脂质代谢紊乱;EPHX2低表达可以缓解肥胖引起的肝脂肪变性、代谢综合征等疾病;EPHX2能够降解花生四烯酸,减少体内花生四烯酸浓度,加重冠状动脉粥样硬化患者的临床症状[11]。本研究蛋白质组学研究发现,模型组中差异蛋白COX1、COX2属于环氧化物,均处于低表达,这可能与EPHX2高表达、水解作用增强有关。通过对各组大鼠肝脏组织中关键差异蛋白表达水平验证发现,模型组大鼠肝脏组织中EPHX2相对高表达,说明高脂饮食复制的高脂血症模型大鼠的血脂水平异常可能与EPHX2高表达有关,而丹参饮的治疗作用可能与下调EPHX2表达有关。
GSK-3β在组织中分布广泛,在调节脂质方面发挥着一定作用。GSK-3β的激活受磷脂酰肌醇3激酶的调节,是蛋白激酶B的下游底物,激活后能够影响糖原合成和糖异生,影响胰岛素分泌,进一步改变脂肪代谢[12]。本研究发现,GSK-3β在空白组和模型组大鼠肝脏组织中表达水平发生显著改变,说明模型大鼠也发生了糖代谢异常,在后续研究中将进一步探究。
PLIN2参与PPAR信号通路,是脂肪细胞分化的关键蛋白。PPARγ在脂肪细胞分化过程中起重要作用,同时影响脂肪氧化和脂肪代谢。PLIN2可以通过上调凝集素样氧化低密度脂蛋白受体1的表达促进细胞内脂质积聚,参与动脉粥样硬化;PPARγ抑制剂可以上调PLIN2蛋白表达,并上调涉及脂质摄取、运输和储存及脂肪酸合成的多个基因,提高脂肪生成并增加TG水平[13]。本研究中蛋白质组学和Western blot研究均发现,与模型组比较,丹参饮组大鼠肝脏组织中PPARγ表达上调,PLIN2表达下调,说明丹参饮的降脂作用可能与激活PPARγ信号通路并抑制PLIN2表达有关。
综上所述,丹参饮对高脂血症模型大鼠血脂水平和肝脏病理形态学均有显著的改善作用,其调节机制可能与上调PPARγ、GSK-3β表达和下调EPHX2、PLIN2表达有关,涉及的信号通路可能包括PPARγ信号通路。本研究仍存在一定不足:仅对肝脏蛋白质组学表达情况和显著差异蛋白进行了验证研究,未对重点的信号通路进行激活或抑制验证。在后续的研究中,本课题组将开展体外和体内实验验证,进一步研究相关信号通路的激活和抑制机制。
