circLRP6调节miR-31-5p/HMGA1轴对高糖诱导的肾小管上皮细胞损伤的影响
2024-04-29许峥嵘任卫东谷君张志英邓文娟左丽娟
许峥嵘,任卫东,谷君,张志英,邓文娟,左丽娟
(河北北方学院附属第一医院内分泌科,河北 张家口 075000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病控制不佳导致蛋白尿与肾小球滤过率进行性降低,是糖尿病的严重合并症[1]。随着社会的进步、饮食结构的改变,DN已成为我国终末期肾病的第2位原因。DN的发病机制是DN的研究重点,有助于临床控制DN肾脏损伤。微RNA(mciroRNA,miRNA)可能通过影响肾小管上皮细胞的凋亡参与DN的发展[2]。研究[3]报道,miR-31-5p升高可抑制高糖诱导的人系膜细胞生长、炎症、细胞外积累以及氧化应激。高迁移率族蛋白A1(high mobility group protein A1,HMGA1)在DN中发挥重要作用,可调节DN小鼠肾小管上皮-间充质转化[4]。生物信息学分析显示,miR-31-5p与HMGA1存在结合位点,miR-31-5p/HMGA1可能是调控DN的一个方向。环状RNA(circular RNA,circRNA)主要通过与miRNA竞争性结合调控靶基因发挥作用,并参与DN的进展。circLRP6在DN中表达异常,且生物信息学分析显示circLRP6与miR-31-5p存在结合位点。因此,本研究以高糖诱导的肾小管上皮细胞损伤模拟体内DN损伤,分析circLRP6对高糖诱导的肾小管上皮细胞损伤的影响,并分析其潜在机制。
1 材料与方法
1.1 细胞与主要试剂
人肾小管上皮细胞HK-2,购自美国ATCC细胞库;白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒,购自上海酶联生物科技有限公司;丙二醛(malondialdehyde,MDA)、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒,购自上海碧云天生物技术有限公司;HMGA1、Bax、Bcl-2、GAPDH兔抗、羊抗兔IgG二抗,购自英国Abcam公司。
1.2 实验方法
1.2.1 分组:体外培养HK-2细胞,常规传代,取对数生长期HK-2细胞,分为对照组、高糖组、高糖+si-NC组、高糖+si-circLRP6组、高糖+si-circLRP6+miR-NC组、高糖+si-circLRP6+miR-31-5p inhibitor组、高糖+si-circLRP6+miR-31-5p inhibitor+si-NC组、高糖+sicircLRP6+miR-31-5p inhibitor+si-HMGA1组。对照组置于含5.5 mmol/L葡萄糖的DMEM培养基内培养,其余各组置于含25 mmol/L葡萄糖的DMEM培养基内培养,并通过Lipofectamine 2000将相应质粒转染至HK-2细胞内,培养基内培养。
1.2.2 HK-2细胞circLRP6、miR-31-5p、HMGA1mRNA水平检测:采用TRIzol法提取各组细胞中总RNA,反转录后进行cDNA扩增,程序设定为95℃,30 s(预变性);95℃,5 s(变性),55℃,10 s(退火),72℃,15 s(延伸),共40个循环。采用2-ΔΔCt法分析circLRP6、miR-31-5p、HMGA1mRNA表达情况,以GAPDH作为circLRP6、HMGA1mRNA的内参,以U6作为miR-31-5p的内参。引物序列:circLRP6,正向5’-CAAGATTGA GGCAGGCAGTG-3’,反向5’-GCTCCAGTCAGTCCA GTACA-3’;HMGA1,正向5’-ATGAACTCCGAAGGC CAGCC-3’,反向5’-CCTTCCTAGGTCTGCCTCTTG G-3’;GAPDH,正向5’-TGTTCGTCATGGGTGTGAA C-3’,反向5’-ATGGCATGGACTGTGGTCAT-3’;miR-31-5p,正向5’-CCCTCGAGACATTTGAAAGCCATTA GACT-3’,反向5’-GCGTCGACAGGTTGAGCGAGCG AAG-3’;U6,正向5’-TGCGGGTGCTCGCTTCGGCAG C-3’,反向5’-CCAGTGCAGGGTCCGAGGT-3’。
1.2.3 细胞上清液IL-6水平、TNF-α水平、LDH活性、MDA含量测定:收集各组细胞培养上清液,按照ELISA试剂盒说明书检测IL-6、TNF-α水平;硫代巴比妥酸法检测MDA含量;LDH试剂盒检测LDH活性。
1.2.4 细胞凋亡率的测定:收集各组细胞,胰酶消化后,以5×105/mL的浓度重悬于500 μL 1×膜联蛋白结合缓冲液中,加入Annexin V-FITC(5 μL)和碘化丙啶(10 μL)避光孵育15 min,流式细胞仪观察细胞凋亡情况。
1.2.5 Western blotting检测蛋白水平:用RIPA裂解液裂解各组HK-2细胞后,BCA法测定总蛋白浓度,SDS-PAGE分离并转膜,脱脂牛奶封闭1 h后,加入兔抗GAPDH(1∶5 000)、HMGA1(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)一抗孵育(4℃)过夜,隔日加入羊抗兔二抗(1∶4 000)孵育2 h,用蛋白凝胶成像仪定量分析蛋白含量。
1.2.6 双荧光素酶报告基因实验:Starbase网站(https://rnasysu.com/encori/)预测miR-31-5p与circ-LRP6、HMGA1的结合位点。构建circLRP6野生型(circLRP6 WT)和突变型质粒(circLRP6 MUT)以及HMGA1野生型(HMGA1 WT)和突变型质粒(HMGA1 MUT),分别与mimic NC、miR-31-5p mimic共转染至HK-2细胞,分为mimic NC+circLRP6 WT组(circLRP6 WT与mimic NC共转染)、miR-31-5p mimic+circLRP6 WT组(circLRP6 WT与miR-31-5p mimic共转染)、mimic NC+circLRP6 MUT组(circLRP6 MUT与mimic NC共转染)、miR-31-5p mimic+circLRP6 MUT组(circ-LRP6 MUT与miR-31-5p mimic共转染)、mimic NC+HMGA1 WT组(HMGA1 WT与mimic NC共转染)、miR-31-5p mimic+HMGA1 WT组(HMGA1 WT与miR-31-5p mimic共转染)、mimic NC+HMGA1 MUT组(HMGA1 MUT与mimic NC共转染)、miR-31-5p mimic+HMGA1 MUT组(HMGA1 MUT与miR-31-5p mimic共转染),48 h后测定荧光素酶活性。实时定量PCR测定沉默si-circ-LRP6后circLRP6与miR-31-5p水平(si-NC组、si-circ-LRP6组),实时定量PCR和Western blotting测定miR-31-5p过表达对HMGA1mRNA和蛋白表达的影响(mimic NC组、miR-31-5p mimic组)。
1.3 统计学分析
采用SPSS 21.0软件进行统计分析,计量资料用±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 circLRP6在高糖诱导的HK-2细胞中的表达
与对照组相比,高糖组HK-2细胞中circLRP6表达水平升高(1.01±0.09和1.97±0.21,P<0.05)。
2.2 各组HK-2细胞增殖抑制率、炎性细胞因子水平、LDH活性和MDA含量的比较
与对照组相比,高糖组HK-2细胞增殖抑制率、细胞上清液IL-6水平、TNF-α水平、LDH活性、MDA含量均升高(P<0.05);与高糖组相比,高糖+si-circ-LRP6组HK-2细胞增殖抑制率、细胞上清液IL-6水平、TNF-α水平、LDH活性、MDA含量均降低(P<0.05);与高糖+si-circLRP6组相比,高糖+si-circLRP6+miR-31-5p inhibitor组HK-2细胞增殖抑制率、细胞上清液IL-6水平、TNF-α水平、LDH活性、MDA含量均升高(P<0.05);与高糖+si-circLRP6+miR-31-5p inhibitor组相比,高糖+si-circLRP6+miR-31-5p inhibitor+si-HMGA1组HK-2细胞增殖抑制率、细胞上清液IL-6水平、TNF-α水平、LDH活性、MDA含量均降低(P<0.05),见表1。
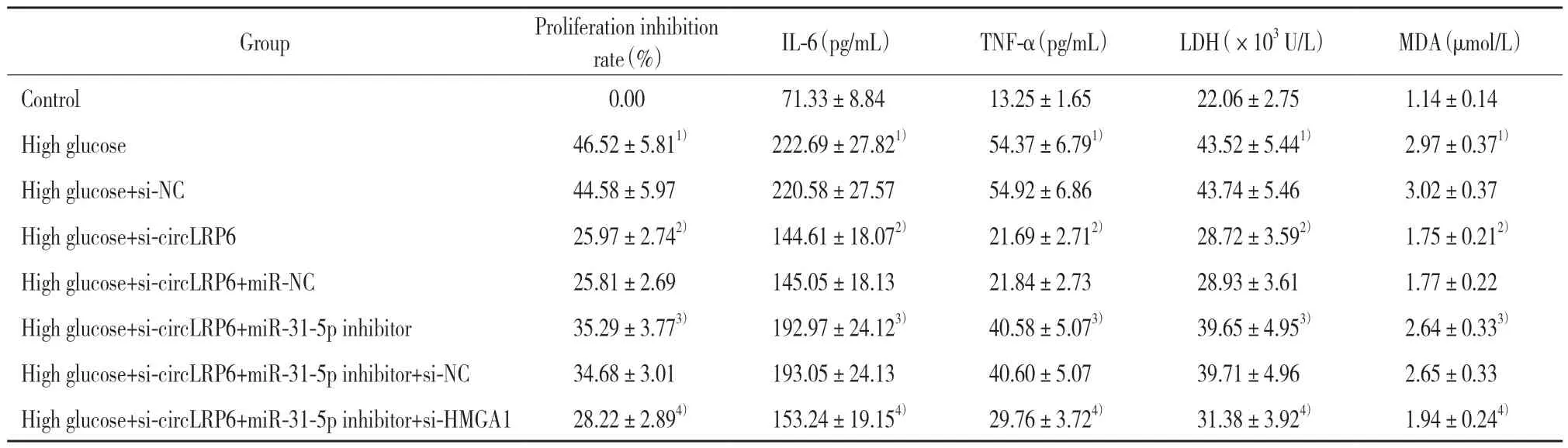
表1 各组HK-2细胞增殖抑制率、LDH活性、IL-6和TNF-α水平以及MDA含量的比较Tab.1 Inhibition rate of HK-2 cell proliferation;lactate dehydrogenase(LDH)activity;interleukin(IL)-6 and tumor necrosis factor(TNF)-α levels;and malondialdehyde(MDA)content in each group
2.3 各组HK-2细胞凋亡情况
与对照组相比,高糖组HK-2细胞凋亡率、Bax蛋白表达升高,Bcl-2蛋白表达降低(P<0.05);与高糖组相比,高糖+si-circLRP6组HK-2细胞凋亡率、Bax蛋白表达降低,Bcl-2蛋白表达升高(P<0.05);与高糖+si-circLRP6组相比,高糖+si-circLRP6+miR-31-5p inhibitor组HK-2细胞凋亡率、Bax蛋白表达升高,Bcl-2蛋白表达降低(P<0.05);与高糖+si-circ-LRP6+miR-31-5p inhibitor组相比,高糖+si-circLRP6+miR-31-5p inhibitor+si-HMGA1组HK-2细胞凋亡率、Bax蛋白表达降低,Bcl-2蛋白表达升高(P<0.05),见表2、图1。

1,control group;2,high glucose group;3,high glucose+si-NC group;4,high glucose+si-circLRP6 group;5,high glucose+si-circLRP6+miR-NC group;6,high glucose+si-circLRP6+miR-31-5p inhibitor group;7,high glucose+si-circLRP6+miR-31-5p inhibitor+si-NC group;8,high glucose+si-circ-LRP6+miR-31-5p inhibitor+si-HMGA1 group.图1 各组HK-2细胞中Bax和Bcl-2蛋白的表达情况Fig.1 Bax and Bcl-2 protein expression in HK-2 cells of each group
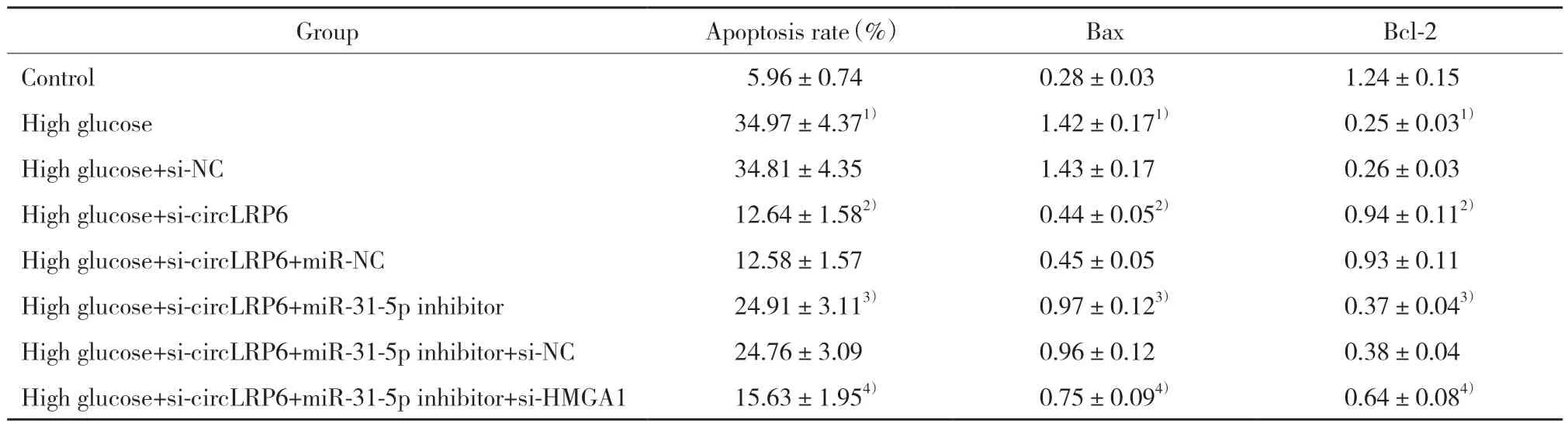
表2 各组HK-2细胞凋亡情况的比较Tab.2 Comparison of apoptosis of HK-2 cells in each group
2.4 miR-31-5p与circLRP6的靶向关系
Starbase网站预测显示,miR-31-5p与circLRP6存在结合位点(图2)。miR-31-5p mimic+circLRP6 WT组荧光素酶活性较mimic NC+circLRP6 WT组低(0.35±0.02和1.02±0.09,P<0.05),mimic NC+circ-LRP6 MUT组与miR-31-5p mimic+circLRP6 MUT组比较,荧光素酶活性的差异无统计学意义(1.02±0.10和1.03±0.10,P>0.05)。与si-NC组相比,circLRP6组circLRP6表达降低(0.33±0.04和1.01±0.12,P<0.05),miR-31-5p表达升高(2.96±0.37和1.02±0.12,P<0.05)。
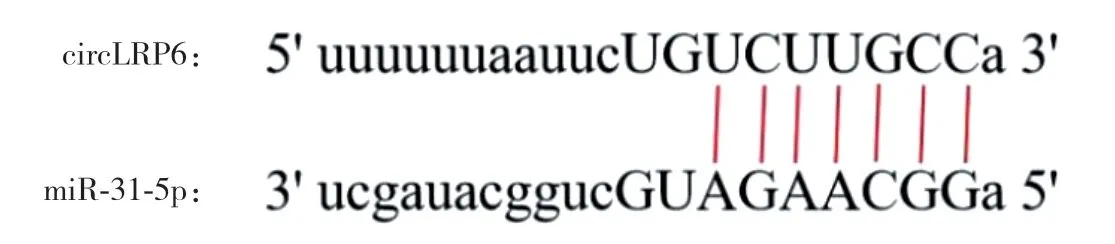
图2 Starbase网站预测miR-31-5p与circLRP6结合位点Fig.2 miR-31-5p and circLRP6 binding sites predicted by the Starbase website
2.5 miR-31-5p与HMGA1的靶向关系
Starbase网站预测显示,miR-31-5p与HMGA1存在结合位点(图3)。miR-31-5p mimic+HMGA1 WT组荧光素酶活性较mimic NC+HMGA1 WT组低(0.32±0.05和1.13±0.21,P<0.05),mimic NC+HMGA1 MUT组与miR-31-5p mimic+HMGA1 MUT组比较,荧光素酶活性的差异无统计学意义(1.10±0.10和1.08±0.19,P>0.05)。与mimic NC组相比,miR-31-5p mimic组HMGA1mRNA水平(0.40±0.05和1.01±0.12,P<0.05)和蛋白表达水平(0.37±0.04和0.89±0.11,P<0.05)降低。见图4。
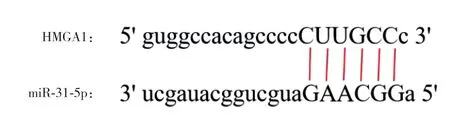
图3 Starbase网站预测miR-31-5p与HMGA1结合位点Fig.3 miR-31-5p and HMGA1 binding sites predicted by the Starbase website
3 讨论
DN与肾小管病变和肾功能损伤关系密切,肾小管上皮细胞丢失是肾小管病变的原因之一[5]。在糖尿病中,长期的高糖刺激会诱导肾小管上皮细胞损伤,导致肾功能障碍。用高糖处理肾小管上皮细胞能模拟体内高糖诱导的肾小管损伤环境[6]。本研究中,高糖处理后HK-2细胞的增殖抑制率、凋亡率升高,证明成功构建HK-2细胞损伤模型。
circRNA可作为miRNA海绵介导下游基因表达,参与DN的发生、发展。研究[7]报道,circLRP6在高糖诱导的系膜细胞中上调。本研究中,高糖诱导的HK-2细胞中circLRP6水平升高,下调circLRP6表达后,HK-2细胞的增殖抑制率、凋亡率降低,提示circ-LRP6可能为肾小管上皮细胞的有害因子,可能是DN治疗的靶点之一。DN患者中肾小管上皮细胞损伤与炎症和氧化应激有关。炎症在DN的肾小管上皮细胞损伤中占据重要地位,IL-6、TNF-α等炎性因子的产生会进一步诱导细胞凋亡的发生。此外,细胞内氧自由基累积增加时会引发细胞膜脂质过氧化,细胞膜完整性被破坏,细胞内LDH等毒性物质流出,MDA作为脂质过氧化产物可反映细胞氧化应激损伤程度[8]。本研究中,circLRP6沉默可降低HK-2细胞上清液中IL-6、TNF-α、LDH、MDA水平,提示circ-LRP6沉默可能通过抑制氧化应激和炎症反应,减轻高糖诱导的HK-2细胞损伤。
研究[9]显示,miR-31-5p在DN患者体内表达降低。在高糖诱导的足细胞损伤模型中,miR-31-5p低表达[10]。此外,miR-31-5p在高糖诱导的系膜细胞损伤中低表达,上调miR-31-5p表达可抑制高糖诱导的系膜细胞增殖、炎症和氧化应激[5]。以上研究表明,miR-31-5p在DN中发挥保护作用。本研究中,miR-31-5p抑制剂可减弱circLRP6沉默对高糖诱导的HK-2细胞损伤的保护作用,且双荧光素酶报告基因实验证实circLRP6与miR-31-5p存在靶向调控关系,提示circLRP6沉默可能通过上调miR-31-5p表达发挥对HK-2的保护作用。
HMGA1是广泛分布于细胞核内的非组蛋白,广泛调节DNA复制、转录、基因表达调控等[11-12]。研究[13]报道,HMGA1是胰岛素受体基因的重要调节因子,也是2型糖尿病发展的危险因素,在链脲佐菌素诱导的糖尿病大鼠中,主动脉组织中HMGA1水平显著上调和积累,在体外,高糖会增加HMGA1的表达并促进血管平滑肌细胞增殖。WU等[14]的研究显示,HMGA1在糖尿病小鼠心脏和高糖刺激的心肌细胞中上调,其过表达加速了高糖诱导的心肌细胞炎症和细胞凋亡,并加重了糖尿病小鼠心脏功能障碍,而HMGA1敲低可减轻心肌细胞对高糖诱导的炎症和细胞凋亡的反应。在本研究中,双荧光素酶报告基因实验证实miR-31-5p与HMGA1存在靶向结合,且miR-31-5p过表达可显著降低HMGA1mRNA和蛋白表达,提示circLRP6沉默可能通过miR-31-5p/HMGA1发挥对HK-2的保护作用。下调HMGA1表达恢复了miR-31-5p抑制剂对circLRP6沉默在高糖诱导的HK-2细胞损伤中的逆转作用。
综上所述,沉默circLRP6可能通过上调miR-31-5p、抑制HMGA1表达对高糖诱导的肾小管上皮细胞损伤发挥保护作用。本研究为DN药物的研发及基因靶向治疗提供了一定参考。但是,在高糖诱导的HK-2细胞损伤中circLRP6上调的分子机制尚不明确,有待后续进行进一步研究。
