猪CD1d蛋白多克隆抗体的制备及应用
2024-04-24刘传霞陈欣王晓李雪雯李婷婷翁长江郑君
刘传霞,陈欣,王晓,李雪雯,李婷婷,翁长江,郑君
猪CD1d蛋白多克隆抗体的制备及应用
刘传霞,陈欣,王晓,李雪雯,李婷婷,翁长江,郑君
中国农业科学院哈尔滨兽医研究所/动物疫病预防控制国家重点实验室/国家非洲猪瘟专业实验室/基础免疫创新团队,哈尔滨 150069
【目的】制备猪源CD1d的多克隆抗体,为探究猪CD1d蛋白在非洲猪瘟病毒(African swine fever virus,ASFV)感染过程中的功能奠定基础。【方法】利用PCR方法扩增了猪CD1d基因,并将其同源重组至pGEX-6p1载体中,构建了原核重组表达质粒pGEX-6p1-CD1d。将重组质粒转化BL21(DE3)并用IPTG进行诱导表达,表达的GST-CD1d重组蛋白经SDS-PAGE和Western blot(WB)方法鉴定,SDS-PAGE结果显示约50 ku处有一条明显的条带,该蛋白以包涵体形式表达。然后利用谷胱甘肽琼脂糖亲和层析方法进行蛋白纯化,将纯化的GST-CD1d蛋白与等体积的弗氏完全佐剂混合乳化后,将纯化的蛋白免疫新西兰大白兔,采用颈背部多点皮下注射,免疫剂量为200 μg/只,首免后第3周和第5周分别进行二免和三免,均采用弗氏不完全佐剂乳化,方法和剂量与首免相同。三免后第7天,通过耳缘静脉采血分离血清。首免后第7周进行第四次免疫,一周后心脏采血。该抗体经Protein G亲和层析纯化后冻存于-80 ℃冰箱。通过WB和间接免疫荧光(IFA)鉴定瞬时转染表达的外源CD1d蛋白和猪原代巨噬细胞(PAMs)表达的内源CD1d蛋白的表达与细胞定位情况。同样,制备的CD1d抗体可以将外源瞬时转染表达的CD1d通过IP拉下。为了探究CD1d在ASFV感染早期的情况,将ASFV接种于PAMs,制备ASFV感染0、15、30、60 min的样品,以CD1d为一抗,通过WB检测了CD1d蛋白的表达情况。在HEK293T细胞共转pCAGGS-HA-CD1d和pCAGGS-Flag-CD2v质粒,24 h后收取细胞裂解,加入Flag beads过夜结合蛋白,通过WB检测互作情况染,同时,质粒共转染于共聚焦小皿中的HEK293T细胞,用标签抗体对其进行孵育,选择相应的荧光二抗,通过激光共聚焦显微镜观察CD1d与CD2v在细胞中共定位情况。采用Co-IP验证CD1d与ASFV外囊膜蛋白CD2v的相互作用。【结果】原核表达的GST-CD1d蛋白以包涵体形式表达在感受态细胞中,分子质量约为35 ku;实验兔4次免疫CD1d重组蛋白后采血并分离血清,纯化的抗体经SDS-PAGE检测在45和25 ku处各出现一条特异性条带,分别为CD1d抗体的重链与轻链。以纯化的CD1d蛋白作为免疫原制备的兔抗CD1d抗体包含重链和轻链,且具有较好纯度;该抗体能够通过WB和IFA鉴定瞬时转染的外源以及PAMs内源CD1d蛋白的表达和细胞定位。进一步检测结果显示,ASFV感染PAMs后,CD1d蛋白表达水平明显增加,并且WB和IFA结果显示CD1d与ASFV编码的外囊膜蛋白CD2v存在相互作用和共定位。【结论】通过原核表达技术制备了CD1d的抗体,为进一步探究CD1d蛋白在ASFV感染过程中的生物学功能打下了基础。
CD1d蛋白;原核表达;多克隆抗体;非洲猪瘟病毒;CD2v蛋白
0 引言
【研究意义】非洲猪瘟病毒(African swine fever virus,ASFV)是危害全球生猪产业的“头号杀手”之一,目前还没有商品化的药物或疫苗能够控制该病毒的传播,其中一个主要原因是人们对其感染与免疫逃逸机制认知不足[1]。【前人研究进展】ASFV病毒颗粒由核酸、核壳、内膜和衣壳4个同心结构组成[2],成熟的病毒粒子在通过细胞质膜出芽时获得病毒的外囊膜,由ASFV EP402R基因编码的CD2v蛋白是已知的病毒外囊膜上的唯一标记分子[2-4]。CD2v基因全长为1 083 bp,预测的蛋白质大小为41 kDa,由402个氨基酸构成,是一个高度糖基化的囊膜蛋白[4-5]。因编码蛋白的胞外区氨基酸序列与宿主细胞的CD2非常相似,所以命名为CD2v,该蛋白在促进病毒复制与传播、病毒免疫逃逸等方面发挥着重要作用[2]。CD2v也具有良好的免疫原性,可应用在减毒活疫苗、亚单位疫苗等研究中。有研究显示泛素化的CD2v蛋白很可能参与了MHC-I类分子抗原递呈途径,从而激活特异性T细胞免疫[6]。MINMA等[7]的研究使用计算机模拟方法鉴定CD2v 蛋白胞外区包含4个B细胞表位和5个T细胞表位。BURMAKINA等[8]的研究鉴定结果显示了4个T细胞表位能够出现T细胞应答。CD1d分子是CD1家族的成员之一,是一种与MHC-I类分子类似的蛋白[9-10],主要来源于单核细胞、树突状细胞及巨噬细胞等。CD1d的分子结构包含胞外功能区(a1、a2、a3区)、跨膜区和胞内区。其中a1和a2区构成抗原结合域,它是由疏水性氨基酸组成的利于糖脂类分子与之结合的空穴样结构[11]。CD1d分子的组成包括非糖基化和糖基化两种,后者是由β2微球蛋白(β2m)与CD1d分子以非共价键形成的二聚体。CD1d能够识别并递呈糖脂类抗原给T细胞,通过特异性激活自然杀伤T(NKT)细胞,发挥抗病毒感染的免疫功能[12]。CD1d分子与β2-微球蛋白结合后,通过内质网-高尔基体的分泌途径到达质膜,进而特异性地将抗原提呈给NKT细胞,使其活化并分泌多种细胞因子,直接或间接参与机体免疫应答[13]。CD1d分子提呈糖脂抗原[14],在抗原装载、胞内运输和其加工处理等方面,具有独特特征,从而在抗肿瘤、抗感染和抑制自身免疫中发挥重要作用[15-17]。CD1d主要表达在抗原提呈细胞等细胞表面,髓系细胞通常低表达CD1d,这有助于避免激活自身反应性NKT细胞。自身免疫病患者外周血中CD1d的表达呈上调状态,促进了对机体自身糖脂类抗原的提呈,从而导致了病理性的免疫应答。类风湿性关节炎患者体内检测出低水平的可溶性CD1d[18],而正常人体的CD1d分子是以跨膜蛋白的形式存在,可溶性CD1d在自身免疫性疾病中作用尚不清楚,有待进一步揭示。【本研究切入点】柯萨奇病毒感染心肌细胞后,CD1d出现明显表达升高的现象[19]。HBV或HCV感染者的肝脏组织中CD1d表达出现上调的现象[20]。这些都提示了CD1d能够介导产生抗病毒感染的作用。【拟解决的关键问题】由于商品化的其他物种CD1d抗体不能很好识别猪CD1d蛋白,本研究利用原核表达系统制备了猪源CD1d重组蛋白,通过免疫新西兰大白兔制备了CD1d多克隆抗体,进而将其应用于WB、IFA和Co-IP等试验,鉴定了ASFV感染后CD1d蛋白的表达变化,验证了CD1d与CD2v蛋白的相互作用,为研究CD1d在ASFV感染过程中的生物学功能以及抗原提呈机制奠定了基础。
1 材料与方法
1.1 试验材料及实验动物
HEK293T细胞由哈尔滨兽医研究所基础免疫团队保存,猪肺泡巨噬细胞(PAMs)分离自30日龄ASFV阴性猪;DH5ɑ菌株、BL21(DE3)感受态细胞购自TaKaRa公司;真核表达质粒pCAGGS- HA-CD1d、pCAGGS-Flag-CD1d由哈尔滨兽医研究所基础免疫团队制备并保存[21];SPF级2月龄雌性新西兰大白兔购自辽宁长生生物技术股份有限公司。
1.2 主要试剂
Prime STAR Max DNA Polymerase 购自宝生物工程有限公司;限制性内切酶HⅠ、I购自NEB公司;同源重组试剂盒购自Vazyme公司;DMEM培养基、胎牛血清购自Gibco公司;质粒小提试剂盒、胶回收试剂盒均购自QIAGEN公司;弗氏完全佐剂和弗氏不完全剂购自Sigma公司;兔抗GST单克隆抗体(MAb)由哈尔滨兽医研究所基础免疫团队制备并制备;兔源HA标签MAb购自Zen Bioscience公司;兔源Flag标签MAb购自Sigma- Aldrich公司;红外荧光标记的山羊抗兔和抗鼠IgG购自LICOR公司。
1.3 重组质粒的构建
利用TMHMM软件分析GenBank中登录的猪CD1d蛋白的氨基酸序列,预测其跨膜区(267aa— 289aa),针对该区对应cDNA序列设计引物CD1d-F:5'-TCCAGGGGCCCCTATGCTGCATTCCCTTCCA GC-3'(下划线为HⅠ酶切位点)CD1d-R: 5'-GTCAGTCACGATTCAGATGTCCTGGTCTCCTA-3'(下划线为Ⅰ酶切位点),由库美生物科技有限公司(吉林)合成,预期PCR产物大小为834 bp。由吉林省库美生物科技有限公司合成。
1.4 重组蛋白的表达与纯化
以pCAGGS-HA-CD1d为模板,CD1d-F/CD1d-R为引物,利用PCR方法扩增CD1d对应的cDNA片段,PCR扩增体系50 μL:PrimeSTARMax Premix(2×)25 μL、上下游引物各1 μL、DNA模板50 ng,ddH2O补至50 μL。PCR反应条件:98 ℃预变性2 min;98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸20 s,共35个循环;72 ℃延伸5 min;同时,pEGX-6p1空载体经H I和I双酶切,将PCR产物和酶切产物经琼脂糖凝胶电泳鉴定后,用胶回收试剂盒纯化回收,然后二者产物经同源重组酶连接。连接产物转化感受态DH5α,并涂布于氨苄抗性LB平板,37 ℃倒置过夜培养12 h。菌液PCR鉴定正确后,送至吉林省库美生物科技有限公司测序。测序正确的重组质粒按照小提质粒试剂盒说明书提取质粒,命名为pGEX-6p1-CD1d,-20 ℃保存。正确的重组质粒命名为 pGEX-6p1- CD1d。将重组质粒pGEX-6p1-CD1d转化至大肠杆菌BL21(DE3)感受态细胞中,37 ℃ 220 r/min培养至OD600nm值为0.6—0.8,加入终浓度为1mol·L-1的IPTG,16℃220 r/min诱导20 h。收集细菌,超声破碎后离心,收集上清和沉淀后分别经SDS-PAGE检测重组蛋白的表达。获得的重组GST-CD1d蛋白可以与谷胱甘肽S转移酶融合,因此可以通过谷胱甘肽-琼脂糖亲和层析进行纯化,经BCA法测定纯化蛋白浓度后置-80℃保存。
1.5 多克隆抗体的制备
将纯化的GST-CD1d蛋白与等体积的弗氏完全佐剂混合乳化后,采用颈背部多点皮下注射,免疫剂量为200 μg/只,首免后第3周和第5周分别进行二免和三免,均采用弗氏不完全佐剂乳化,方法和剂量与首免相同。三免后第7天,通过耳缘静脉采血分离血清。首免后第7周进行第四次免疫,一周后心脏采血,分离血清利用 Protein G在4℃过夜结合后经1 mol·L-1Tris-HCl(pH8.5)洗脱液洗脱纯化并经SDS-PAGE鉴定后,进一步以兔抗 GST MAb(1﹕2 000)作为一抗,以IRDye 800CW标记的山羊抗兔IgG(1﹕10 000)作为二抗进行WB鉴定。
1.6 外源CD1d表达和定位的鉴定
将pCAGGS-HA-CD1d转染至HEK293T细胞中,24 h后收集细胞,用含1% NP-40的细胞裂解液裂解,离心后取上清,经SDS-PAGE电泳后,转印到PVDF膜,用TBST配制的5%脱脂乳封闭2 h。以制备的CD1d抗体(1﹕2 000)作为一抗,以IRDye 800CW标记的山羊抗兔IgG(1﹕10 000)作为二抗;以转染空质粒的细胞裂解液作为阴性对照,经WB鉴定CD1d抗体与真核表达CD1d蛋白的反应性,评估CD1d抗体在检测外源CD1d蛋白表达中的应用效果。然后利用多聚赖氨酸包被的共聚焦培养皿,进而接种HEK293T细胞,将pCAGGS-HA-CD1d质粒转染HEK293T细胞24 h后,弃上清,固定、透膜后,10% FBS室温封闭1 h;分别以HA标签抗体(1﹕1 000)或CD1d抗体(1﹕100)作为一抗;以Alexa Fluor-594山羊抗兔IgG(1﹕2 000)作为二抗,室温避光孵育1 h;经DAPI染色20 min,IFA检测CD1d抗体与真核表达CD1d蛋白的反应性,鉴定猪CD1d外源蛋白在HEK293T细胞中的定位。
1.7 内源CD1d表达和定位的鉴定
将PAMs铺于6孔板中,24 h收集细胞,采用WB方法检测CD1d抗体与内源表达CD1d蛋白的反应性;以HEK293T细胞裂液作为阴性对照。评估CD1d抗体在检测内源表达CD1d蛋白中的应用。利用多聚赖氨酸包被的共聚焦培养皿,进而接种PAMs,24 h后弃上清,采用IFA方法检测CD1d抗体与内源表达CD1d蛋白的特异性反应,鉴定内源性CD1d蛋白的定位情况。
1.8 猪CD1d的抗体在IP试验中的应用
将pCAGGS-Flag-CD1d真核表达质粒转染至HEK293T细胞中,同时转染空质粒至HEK293T细胞作为对照。24 h后收集细胞样品,裂解细胞后进行IP试验:在样品中加入FLAG-Agarose beads,4℃旋转孵育至少6 h;用预冷的含1% NP-40 细胞裂解液洗涤beads 5次后煮沸,将制备的样品经SDS-PAGE电泳,转印到PVDF膜,以制备的CD1d抗体(1﹕1 000)作为一抗,以IRDye 800CW标记的山羊抗兔IgG(1﹕10 000)作为二抗,检测免疫沉淀中的CD1d蛋白,评估CD1d抗体在IP试验中的应用效果。
1.9 ASFV感染对猪CD1d表达水平的影响
将PAMs铺于6孔板中,24 h后接种ASFV(1 MOI),分别于0、15、30、60 min收集细胞并裂解,以不接种ASFV的细胞裂解液作为对照。以制备的CD1d抗体(1﹕1 000)作为一抗,以IRDye 800CW标记的山羊抗兔IgG(1﹕10 000)作为二抗,经WB检测PAMs中CD1d蛋白的表达水平变化。
1.10 CD1d与CD2v相互作用的鉴定
将pCAGGS-HA-CD1d和pCAGGS-Flag-CD2v各2 μg共转染共聚焦培养皿和六孔板中的HEK293T细胞,对照细胞不作任何处理。24 h后弃去培养基,4%多聚甲醛室温固定共聚焦培养皿中的细胞30 min,分别以CD1d抗体(1﹕500)、HA和Flag标签抗体(1﹕500)为一抗,以Alexa Fluor-594 山羊抗鼠IgG(1﹕2 000)和Alexa Fluor-633山羊抗兔IgG(1﹕2 000)为二抗,通过激光共聚焦显微镜观察CD1d与CD2v的共定位情况;六孔板中的HEK293T细胞,转染质粒24 h后使用FLAG beads进行Co-IP试验,以验证CD1d与CD2v的相互作用。
2 结果
2.1 CD1d蛋白的表达及纯化
以pCAGGS-HA-CD1d质粒为模板,PCR扩增出的CD1d片段与预测大小相符(834 bp)。将获得的猪CD1d片段克隆至pGEX-6p1原核表达载体,获得的重组表达质粒经限制性内切酶HⅠ和Ⅰ双酶切鉴定及测序鉴定,结果表明重组质粒pGEX-6p1-CD1d构建正确。将重组质粒转化BL21(DE3)并诱导表达,SDS-PAGE结果显示约50 ku处有一条明显的条带,该蛋白以包涵体形式表达(图1-A)。WB结果显示,此条带为CD1d蛋白特异性条带,其大小与预期结果一致,且经过纯化的蛋白较为纯净(图1-B)。以上结果说明得到了纯度较高的CD1d重组蛋白,经BCA法测定后的蛋白浓度为58 mg·mL-1。
2.2 猪CD1d多克隆抗体的纯化
试验兔4次免疫CD1d重组蛋白后采血并分离血清,通过Protein G纯化的抗体经SDS-PAGE检测,结果显示,在45和25 ku处各出现一条特异性条带,分别为CD1d抗体的重链与轻链(图2)。结果表明,猪CD1d多克隆抗体被成功制备和纯化。
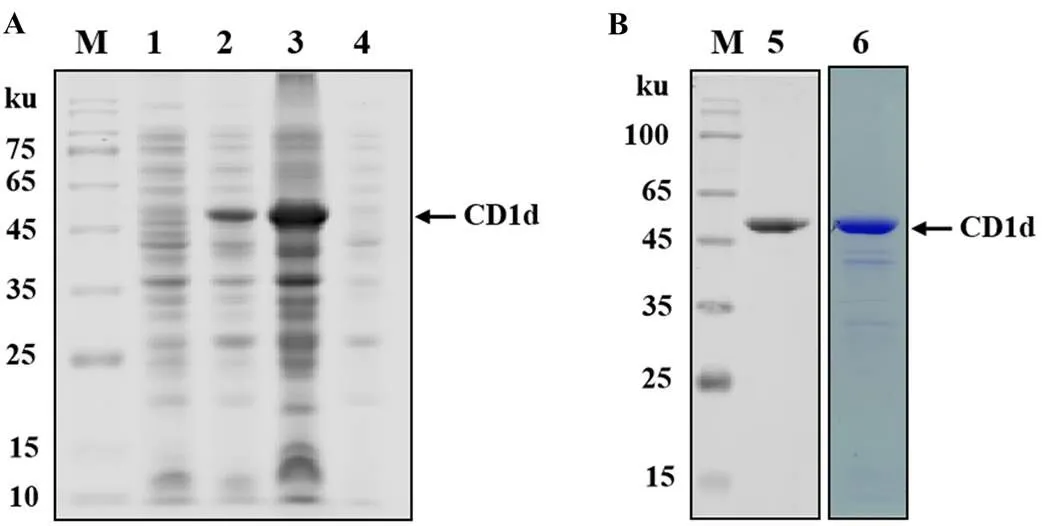
A:SDS-PAGE的鉴定结果;B:WB的鉴定结果。M:蛋白分子质量标准;1:未诱导的菌液;2-4:IPTG诱导的重组菌菌液、超声后沉淀、超声后上清;5:WB鉴定纯化的CD1d蛋白; 6: SDS-PAGE鉴定纯化的CD1d蛋白
2.3 外源CD1d蛋白的表达与定位
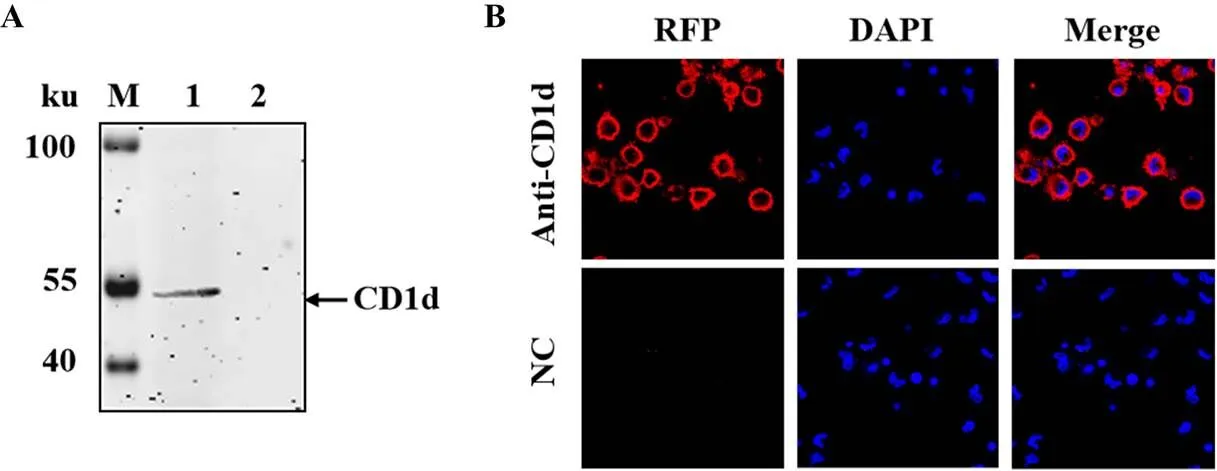
将pCAGGS-Flag-CD1d转染HEK293T细胞,24 h后收集细胞,分别经WB和IFA检测。WB结果显示,纯化的CD1d抗体可以识别外源表达的Flag-CD1d蛋白,其大小近35 ku,结果中显示出了两条特异性条带,推测可能是由于猪源的Flag-CD1d蛋白在HEK293T细胞中表达存在一定的修饰造成的(图3-A)。质粒pCAGGS-HA-CD1d转染的细胞分别用HA标签抗体及CD1d抗体作为一抗,通过IFA检测,结果显示,均可检测到特异性的荧光,其位于细胞的胞质内(图3-B)。这些结果说明制备的CD1d抗体可以用于WB及IFA检测外源表达的猪CD1d蛋白。

M:蛋白质分子质量标准;1-4:纯化的不同浓度CD1d抗体

A:WB分析外源CD1d蛋白在HEK293T细胞中的表达;B:IFA鉴定外源CD1d蛋白在HEK293T细胞中的定位。M:蛋白质分子质量标准;1:转染pCAGGS-HA-CD1d的 HEK293T细胞裂解液;2:转染pCAGGS-HA的HEK293T细胞裂解液
2.4 内源CD1d蛋白的表达与定位
铺于6孔板中的PAMs裂解后分别经WB和IFA鉴定。WB结果显示,制备的CD1d抗体能够与PAMs中的内源CD1d蛋白反应,产生一条近55 ku的特异性条带(图4-A);以CD1d抗体作为一抗,IFA结果显示,PAMs中出现特异性红色荧光,位于细胞膜和细胞质,而对照无荧光(图4-B),表明CD1d定位于PAMs的胞质内。这些结果说明制备的抗体可以用于检测内源表达的猪CD1d蛋白。
A:WB分析PAMs中CD1d的表达;B:IFA鉴定CD1d在PAMs中的定位。M:蛋白质分子质量标准;1:PAMs裂解液;2:MA104细胞裂解液
2.5 猪CD1d抗体在IP试验中的应用
将pCAGGS-Flag-CD1d转染至HEK293T细胞中,24 h后收集细胞样品,经IP试验检测,结果显示,CD1d抗体可以将Flag-CD1d蛋白沉淀下来(图5)。
2.6 ASFV感染对猪CD1d表达水平的影响
将ASFV(1 MOI)接种6孔板中的PAMs,分别在不同时间收集并裂解细胞,通过WB检测病毒感染不同时间PAMs中CD1d的表达水平。结果显示,随着ASFV感染时间的增加,CD1d蛋白的表达水平逐渐升高(图6-A),通过Image J软件对图6-A的结果进行灰度值分析,结果显示,在ASFV感染60 min时CD1d的表达水平增加了近3倍(图6-B)。结果表明,ASFV感染促进了PAMs中CD1d蛋白的表达水平。
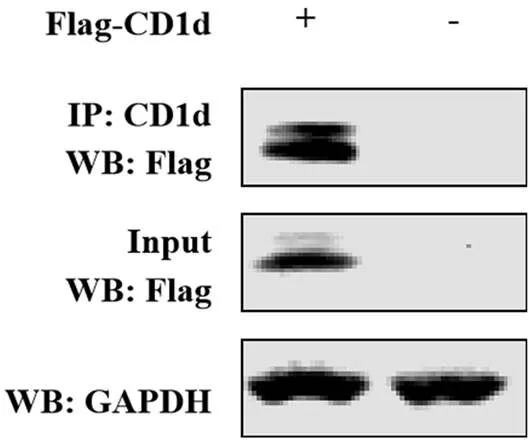
图5 CD1d抗体用于IP试验
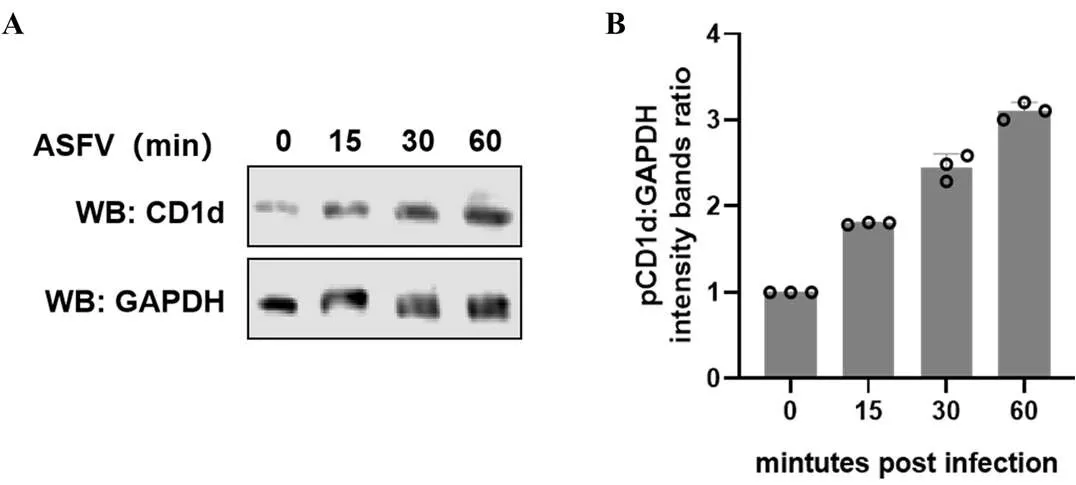
A:WB分析ASFV感染不同时间CD1d的表达情况;B:对A图的灰度值进行比较分析。纵坐标显示的是CD1d与GAPDH的灰度比值
2.7 CD1d与CD2v相互作用的鉴定
将pCAGGS-Flag-pCD2v与pCAGGS-HA-CD1d转染HEK293T细胞,24 h后分别利用CD1d和HA标签抗体作为一抗,相应荧光二抗孵育后经激光共聚焦显微镜下观察(图7-A);将CD1d和CD2v质粒转染HEK293T细胞中,24 h后收集细胞,样品经IP试验检测与相互作用(图7-B)。结果显示,宿主蛋白CD1d与非洲猪瘟外囊膜蛋白CD2v存在相互作用。

A:IFA鉴定CD1d与CD2v的共定位;B:Co-IP鉴定CD1d与CD2v的相互作用
3 讨论
3.1 非洲猪瘟的危害
非洲猪瘟(African swine fever virus,ASF)是由ASFV感染家猪和野猪而引起的急性、烈性、高度接触性传染病。对中国甚至全世界造成严重的经济损失。非洲猪瘟的传播方式众多, 发病猪及感染猪的排泄物、分泌物、猪肉及其制品以及污染的运输车辆、饲料、人员、衣物、鞋子等均为重要的传染源, 特别是感染猪的调运会加速疫情的传播[22]。在ASFV感染的巨噬细胞或其他细胞系中表达了超过150种病毒蛋白,这些蛋白不仅参与病毒进入、复制、病毒粒子组装和排出,还调节宿主抗病毒先天免疫应答[23-28]。由于ASFV病毒粒子的结构和逃避先天免疫应答的复杂机制,目前还没有现有的治疗药物或有效的疫苗。
3.2 CD1d蛋白的结构与表达形式
CD1家族蛋白为非经典的MHC-I类分子,主要与脂类或糖脂类抗原形成复合物,从而将抗原提呈给NKT细胞。CD1d与抗原结合的结构域主要位于其胞外功能区顶端的a1和a2区,它是由疏水性氨基酸组成的利于脂类分子与之结合的空穴样结构,这便导致CD1d的疏水性较强,因此在通过原核表达CD1d蛋白时呈现出不可溶的包涵体形式。然而其抗原表位仍有很大几率暴露在外侧,通过免疫兔子制备的抗体也呈现出较好的反应原性,说明通过包涵体来制备猪CD1d的特异性抗体切实可行。
3.3 CD1d参与多种病毒感染过程
CD1d 的表达对于激活NKT 细胞是必要的,这一表达在病原感染时被调节。HCV在感染时,肝脏的CD1d表达明显增多,进而被NKT细胞识别其递呈的脂质抗原,从而正向或负向调节炎症应答反应[15]。巨细胞病毒(MCMV)或淋巴细胞脉络丛脑膜炎病毒(LCMV)感染小鼠时,控制NKT细胞的激活和CD1d抗原提呈,结果增强了对病毒的清除作用[16]。牛痘病毒(VV)或水疱性口炎病毒(VSV)感染后,CD1d分子被分离到细胞的一边,这也伴随着细胞信号通路的改变[17]。单纯疱疹病毒-1(HSV-1)改变了人类CD1d的黏附力,致使CD1d介导的抗原提呈受到损伤,进而抑制了NKT细胞的活化[18]。
3.4 CD1d与ASFV感染相关联
早期对CD1d的研究主要集中认为CD1d只能识别脂类抗原。但随着对α-半乳糖基神经酰胺研究的深入,发现CD1d分子还能够特异性结合外源性糖脂类抗原[29]。但糖脂类抗原在未经CD1d 加工处理不能被NKT 细胞所识别[30]。本研究结果显示,CD1d蛋白存在于细胞膜和细胞质中,在ASFV感染初期,CD1d的表达水平呈现逐渐增高的趋势。此外,猪CD1d能够与ASFV编码的外囊膜蛋白CD2v相互作用,这些结果说明CD1d可能与介导病毒入侵相关,也可能是细胞的免疫调节反应,从而促进CD1d的病毒抗原提呈作用。这种结合是否符合CD1d的抗原装载过程,又是否能够提呈CD2v抗原还有待进一步鉴定。
4 结论
本研究利用原核表达的猪CD1d蛋白成功制备了特异性多克隆抗体,该抗体能够有效识别内源性的猪CD1d抗原。通过使用该抗体,发现ASFV感染能够促进CD1d的表达水平,且CD1d与CD2v存在相互作用,这为进一步鉴定CD1d在ASFV感染过程中的功能研究打下了基础。
[1] DIXON L K, SUN H, ROBERTS H. African swine fever. Antiviral Research, 2019, 165: 34-41.
[2] ALEJO A, MATAMOROS T, GUERRA M, ANDRÉS G. A proteomic atlas of the African swine fever virus particle. Journal of Virology, 2018, 92(23): e01293-18.
[3] WANG G G, XIE M J, WU W, CHEN Z Z. Structures and functional diversities of ASFV proteins. Viruses, 2021, 13(11): 2124.
[4] WANG N, ZHAO D M, WANG J L, ZHANG Y L, WANG M, GAO Y, LI F, WANG J F, BU Z G, RAO Z H, WANG X X. Architecture of African swine fever virus and implications for viral assembly. Science, 2019, 366(6465): 640-644.
[5] DIXON L K, CHAPMAN D A G, NETHERTON C L, UPTON C. African swine fever virus replication and genomics. Virus Research, 2013, 173(1): 3-14.
[6] 王曼, 沈宇清. 非洲猪瘟病毒结构蛋白CD2v的功能研究进展. 中国免疫学杂志, 2021, 37(22): 2734-2737, 2744.
WANG M, SHEN Y Q. Research progress in function of ASFV structural protein CD2v. Chinese Journal of Immunology, 2021, 37(22): 2734-2737, 2744. (in Chinese)
[7] MINMA K A, KATORKINA E I, KATORKIN S A, TSYBANOV S Z, MALOGOLOVKIN A S. In silico prediction of B- and T-cell epitopes in the CD2v protein of African swine fever virus (African Swine Fever Virus, Asfivirus, Asfarviridae). Problems of Virology, 2020, 65(2): 103-112.
[8] BURMAKINA G, MALOGOLOVKIN A, TULMAN E R, XU W D, DELHON G, KOLBASOV D, ROCK D L. Identification of T-cell epitopes in African swine fever virus CD2v and C-type lectin proteins. Journal of General Virology, 2019, 100(2): 259-265.
[9] FOWLKES B J, KRUISBEEK A M, TON-THAT H, WESTON M A, COLIGAN J E, SCHWARTZ R H, PARDOLL D M. A novel population of T-cell receptor αβ-bearing thymocytes which predominantly expresses a single Vβ gene family. Nature, 1987, 329(6136): 251-254.
[10] MAKINO Y, KANNO R, ITO T, HIGASHINO K, TANIGUCHI M. Predominant expression of invariant Vα14+TCR α chain in NK1.1+T cell populations. International Immunology, 1995, 7(7): 1157-1161.
[11] GODFREY D I, MACDONALD H R, KRONENBERG M, SMYTH M J, VAN KAER L. NKT cells: what’s in a Name? Nature Reviews Immunology, 2004, 4: 231-237.
[12] 陆田田, 黄震, 陈章权. CD1d分子的结构与功能. 生命的化学, 2008, 28(2): 159-161.
LU T T, HUANG Z, CHEN Z Q. Structure and Function of CD1d Molecule. Chemistry of Life, 2008, 28(2): 159-161. (in Chinese)
[13] KANG S J, CRESSWELL P. Calnexin, calreticulin, and ERp57 cooperate in disulfide bond formation in human CD1d heavy chain. Journal of Biological Chemistry, 2002, 277(47): 44838-44844.
[14] 师义, 王昆华, 刘为军, 徐玉. CD1d分子研究进展. 广东医学, 2012, 33(11): 1678-1680.
SHI Y, WANG K H, LIU W J, XU Y. Research Progress of CD1d Molecular. Guangdong Medical Journal, 2012, 33(11): 1678-1680. (in Chinese)
[15] ARGILAGUET J M, PÉREZ-MARTÍN E, NOFRARÍAS M, GALLARDO C, ACCENSI F, LACASTA A, MORA M, BALLESTER M, GALINDO-CARDIEL I, LÓPEZ-SORIA S, ESCRIBANO J M, RECHE P A, RODRÍGUEZ F. DNA vaccination partially protects against African swine fever virus lethal challenge in the absence of antibodies. PLoS ONE, 2012, 7(9): e40942.
[16] DURANTE-MANGONI E, WANG R J, SHAULOV A, HE Q, NASSER I, AFDHAL N, KOZIEL M J, EXLEY M A. Hepatic CD1d expression in hepatitis C virus infection and recognition by resident proinflammatory CD1d-reactive T cells. The Journal of Immunology, 2004, 173(3): 2159-2166.
[17] RENUKARADHYA G J, WEBB T J R, KHAN M A, LIN Y L, DU W J, GERVAY-HAGUE J, BRUTKIEWICZ R R. Virus-induced inhibition of CD1d1-mediated antigen presentation: reciprocal regulation by p38 and ERK. The Journal of Immunology, 2005, 175(7): 4301-4308.
[18] WEBB T J, CAREY G B, EAST J E, SUN W J, BOLLINO D R, KIMBALL A S, BRUTKIEWICZ R R. Alterations in cellular metabolism modulate CD1d-mediated NKT-cell responses. Pathogens and Disease, 2016, 74(6): ftw055.
[19] YANG J Q, CHUN T, LIU H Z, HONG S, BUI H, VAN KAER L, WANG C R, SINGH R. CD1d deficiency exacerbates inflammatory dermatitis in MRL-mice. European Journal of Immunology, 2004, 34(6): 1723-1732.
[20] 陈建勇, 沈学文, 张吉翔. CD1d/NKT在抗HBV和HCV中的作用. 生命的化学, 2007, 27(3): 246-248.
CHEN J Y, SHEN X W, ZHANG J X. Protection of CD1d/NKT against HBV and HCV. Chemistry of Life, 2007, 27(3): 246-248. (in Chinese)
[21] CHEN X, ZHENG J, LIU C X, LI T T, WANG X, LI X W, BAO M F, LI J N, HUANG L, ZHANG Z X, BU Z G, WENG C J. CD1d facilitates African swine fever virus entry into the host cells via clathrin-mediated endocytosis. Emerging Microbes & Infections, 2023, 12(2): 2220575.
[22] 罗玉子, 孙元, 王涛, 仇华吉. 非洲猪瘟: 我国养猪业的重大威胁. 中国农业科学, 2018, 51(21): 4177-4187.
LUO Y Z, SUN Y, WANG T, QIU H J. African swine fever: a major threat to the Chinese swine industry. Scientia Agricultura Sinica, 2018, 51(21): 4177-4187. (in Chinese)
[23] MATAMOROS T, ALEJO A, RODRÍGUEZ J M, HERNÁEZ B, GUERRA M, FRAILE-RAMOS A, ANDRÉS G. African swine fever virus protein pE199L mediates virus entry by enabling membrane fusion and core penetration. mBio, 2020, 11(4): e00789-20.
[24] ANDRÉS G, GARCı́A-ESCUDERO R, VIÑUELA E, SALAS M L, RODRı́GUEZ J M. African swine fever virus structural protein pE120R is essential for virus transport from assembly sites to plasma membrane but not for infectivity. Journal of Virology, 2001, 75(15): 6758-6768.
[25] SÁNCHEZ E G, PÉREZ-NÚÑEZ D, REVILLA Y. Mechanisms of entry and endosomal pathway of African swine fever virus. Vaccines, 2017, 5(4): 42.
[26] CUESTA-GEIJO M Á, GARCÍA-DORIVAL I, DEL PUERTO A, URQUIZA J, GALINDO I, BARRADO-GIL L, LASALA F, CAYUELA A, SORZANO C O S, GIL C, DELGADO R, ALONSO C. New insights into the role of endosomal proteins for African swine fever virus infection. PLoS Pathogens, 2022, 18(1): e1009784.
[27] HERNAEZ B, ALONSO C. Dynamin- and clathrin-dependent endocytosis in African swine fever virus entry. Journal of Virology, 2010, 84(4): 2100-2109.
[28] LIU J Y, GALLO R M, DUFFY C, BRUTKIEWICZ R R. A VP22-null HSV-1 is impaired in inhibiting CD1d-mediated antigen presentation. Viral Immunology, 2016, 29(7): 409-416.
[29] LEE A, FARRAND K J, DICKGREBER N, HAYMAN C M, JÜRS S, HERMANS I F, PAINTER G F. Novel synthesis of α-galactosyl- ceramides and confirmation of their powerful NKT cell agonist activity. Carbohydrate Research, 2006, 341(17): 2785-2798.
[30] PRIGOZY T I, NAIDENKO O, QASBA P, ELEWAUT D, BROSSAY L, KHURANA A, NATORI T, KOEZUKA Y, KULKARNI A, KRONENBERG M. Glycolipid antigen processing for presentation by CD1d molecules. Science, 2001, 291(5504): 664-667.
Preparation and Application of Polyclonal Antibodies Against Pig CD1d Protein
LIU ChuanXia, CHEN Xin, WANG Xiao, LI XueWen, LI TingTing, WENG ChangJiang, ZHENG Jun
Division of Fundamental Immunology, National African Swine Fever Para-Reference Laboratory, State Key Laboratory for Animal Disease Control and Prevention/Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069
【Objective】 The aim of this study was to prepare polyclonal antibodies against porcine CD1d protein, so as to lay the foundation for exploring the function of porcine CD1d protein in the process of African swine fever virus (ASFV) infection. 【Method】 In this study, the pig CD1d gene was amplified using PCR and homologously recombined into the pGEX-6p1 vector, constructing a prokaryotic recombinant expression plasmid pGEX-6p1-CD1d. The recombinant plasmidBL21 (DE3) was transformed and induced for expression using IPTG. The expressed GST CD1d recombinant protein was identified by SDS-PAGE and Western blot (WB) methods. The SDS-PAGE results showed a clear band at approximately 50 ku, which was expressed in the form of an inclusion body. Then, protein purification was performed using glutathione agarose affinity chromatography. The purified GST-CD1d protein was mixed and emulsified with an equal volume of Freund's complete adjuvant. The purified protein was immunized in New Zealand white rabbits and administered subcutaneously at multiple points on the neck and back, with an immune dose of 200 μG/piece, and then second and third immunizations were performed at the 3rd and 5th weeks after the first immunization, respectively, using Freund's incomplete adjuvant emulsification, with the same method and dosage as the first immunization. On the 7th day after the third immunization, the blood was collected from the ear vein to isolate the serum. The fourth immunization was conducted at the 7 weeks after the first immunization, and the blood was collected from the heart one week later. The antibody was purified by Protein G affinity chromatography and frozen at -80 ℃. The expression and cellular localization of endogenous CD1d protein expressed by transient transfection of exogenous and porcine primary macrophages (PAMs) were indentified by using WB and indirect immunofluorescence (IFA). Similarly, the prepared CD1d antibody could pull down CD1d expressed by transient exogenous transfection through IP. In order to investigate the early stage of ASFV infection, ASFV was inoculated into PAMs and samples of ASFV infection for 0, 15, 30, and 60 minutes were prepared, respectively. CD1d was used as the primary antibody and the expression of CD1d protein was detected by WB. Plasmids pCAGGS-HA-CD1d and pCAGGS-Flag-CD2v were co transfected into HEK293T cells. After 24 hours, the cells were collected for lysis, and Flag beads overnight binding protein was added. The interaction was detected by WB staining. At the same time, the plasmids were cotransfected into HEK293T cells in a confocal dish, incubated with labeled antibodies, and corresponding fluorescent secondary antibodies were selected. The co localization of CD1d and CD2v was observed under a laser confocal microscope. Verification of Co-IP interaction between CD1d and ASFV outer capsule protein CD2v was verified.【Result】 The GST-CD1d protein expressed in prokaryotic cells was expressed in the form of inclusion bodies, with a molecular weight of approximately 35 ku; After four rounds of immunization with CD1d recombinant protein in experimental rabbits, blood was collected and serum was separated. The purified antibody was detected by SDS-PAGE and showed a specific band at 45 and 25 ku, respectively, representing the heavy and light chains of the CD1d antibody. The rabbit anti CD1d antibody prepared using purified CD1d protein as immunogen contained both heavy and light chains, and had good purity; This antibody could identify the expression and cellular localization of transient transfected exogenous and PAMs endogenous CD1d proteins through WB and IFA. Further testing results showed that after ASFV infection with PAMs, the expression level of CD1d protein significantly increased, and WB and IFA results showed that CD1d interacted and co localized with the outer capsule protein CD2v encoded by ASFV. 【Conclusion】 This study prepared antibodies against CD1d through prokaryotic expression technology, laying the foundation for further exploration of the biological function of CD1d protein in ASFV infection process.
CD1d protein; prokaryotic expression; polyclonal antibody; African swine fever virus; CD2v protein

10.3864/j.issn.0578-1752.2024.08.015
2022-11-17;
2024-03-01
十四五国家重点研发计划(2021YFD1800100)、国家自然科学基金(32172874)
刘传霞,E-mail:18264110178@163.com。通信作者郑君,E-mail:zhengjun01@caas.cn
(责任编辑 林鉴非)
