基于NOD2介导的AMPK/mTOR信号通路探讨宫颈癌细胞恶性行为的机制
2024-03-27杜瑞亭伍东月郭清民靳冬梅
杜瑞亭,伍东月,郭清民,靳冬梅
宫颈癌(cervical cancer,CC)是女性癌症相关死亡的主要原因,每年估计有530 000例新病例和270 000例死亡[1]。由于转移和复发,CC患者预后不良,生存率低[2]。因此,寻找CC的分子标志物进行早期诊断和靶向治疗对于提高生存率至关重要。模式识别受体(pattern recognition receptors,PRRs)是检测病原体特异性分子的宿主传感器,是抵御感染的第一道防线[3]。核苷酸结合寡聚化结构域受体2(nucleotide-binding oligomerization domain receptor 2,NOD2)是细胞上/细胞中表达的主要PRRs,能识别入侵的病原体并介导致癌作用[4-5]。研究[6]证实NOD2上调通过正调节人类鳞状宫颈癌的致瘤性和转移促进癌症进展。然而,NOD2在CC中的功能在很大程度上是未知的。自噬是一种溶酶体依赖的分解代谢途径,通过该途径清除受损或衰老的细胞器[7]。证据[7]表明,自噬可以增强化疗期间癌细胞的获得性耐药性。NOD2作为自噬的诱导因子[8],是否介导CC的病理机制仍不清楚。该研究探讨了NOD2对CC细胞生物行为和相关信号通路及自噬的影响。
1 材料与方法
1.1 基因表达谱交互式分析(GEPIA)在线数据库分析对GEPIA在线数据库(http://gepia.cancer-pku.cn/)的CC组织中NOD2的相对mRNA水平进行分析,包括306例CC患者和13例非癌患者。对NOD2的mRNA表达水平进行Log2转换,将CESC患者分为NOD2高表达和低表达两组,建立总体生存期的Kaplan-Meier生存曲线分析。
1.2 细胞系与培养人CC细胞(HeLa、SiHa、CaSki和ME-180)和人宫颈上皮细胞系Ect1/E6E7来自中国科学院细胞库。Ect1/E6E7细胞在补充有10%胎牛血清的McCoy’s 5A培养基(美国Gibco公司)中培养,HeLa、SiHa、CaSki和ME-180细胞在RPMI 1640培养基(美国Gibco公司)中培养。
1.3 细胞转染由上海吉玛制药技术有限公司设计并合成了靶向NOD2(shNOD2)和shRNAs阴性对照(shNC)。细胞培养至30%~50%汇合,用siLentFect脂质试剂(美国Bio-Rad公司)转染shRNAs。将NOD2的全长序列克隆到pcDNA3.1载体(美国Invitrogen公司)中,构建NOD2过表达(简称为:NOD2)质粒,同时将空载体用作阴性对照(Vec)。当细胞达到大约90%汇合时,用Lipofectamine 2000(美国Invitrogen公司)转染质粒。48 h后收获转染的细胞用于随后的实验。
1.4 CCK-8增殖试验用CCK-8法(美国APExBIO公司)测定CC细胞的增殖能力。将对数生长期的细胞以1 000个/孔接种到96孔板中,并将10 μl细胞CCK-8溶液添加到每个孔中,然后在37 ℃下孵育2 h。用分光光度计计算450 nm波长处的吸光度,共3次。
1.5 集落形成试验收集CC细胞,将1×103个细胞接种到6孔板中,并在37 ℃下孵育10 d。去除培养基后,用甲醇固定细胞,并用0.1%结晶紫染色。然后计数并记录集落数。
1.6 细胞迁移和侵袭分析使用Transwell测定评估细胞迁移和侵袭。将转染后的HeLa、SiHa细胞重悬于不含FBS的培养基中并调整细胞密度至2×105个/200 μl。然后,将100 μl细胞悬浮液加入Matrigel基质胶包被或未包被的Transwell上室(美国BD Biosciences公司)中,并将含有10%血清的500 μl培养基加入到下室中。在37 ℃孵育48 h后,Transwell小室用PBS洗涤3次,细胞用4%多聚甲醛室温固定30 min,然后用结晶紫染色30 min,用棉签轻轻去除室上表面的基质胶和细胞。在显微镜下计数渗入Transwell室膜的肿瘤细胞数。
1.7 5-乙炔基-2′-脱氧尿苷(5-ethynyl-2′-deoxyuridine,EdU)分析将HeLa细胞或SiHa细胞接种到6孔板中,培养24 h。加入EdU溶液(瑞士Roche公司),将细胞培养2 h。用多聚甲醛固定细胞30 min,加入甘氨酸溶液5 min。加入DAPI对细胞核进行染色。将细胞固定并在荧光显微镜下拍照。
1.8 Western blot试验用冷PBS洗涤细胞,然后在冰上用裂解缓冲液孵育30 min,将细胞刮下并收获。离心后,收集含有裂解物的上清液并于-80 ℃下储存。通过BCA检测试剂盒(美国Bio-Rad公司)测定蛋白质浓度。将蛋白质样品变性,随后通过SDS-PAGE分离,并转移到PVDF膜(瑞士Roche Life Sciences公司)上。在脱脂牛奶中孵育1 h后,使用以下一抗(美国Cell Signaling Technology公司)在4 ℃下处理膜过夜:NOD2、AMPK、p-AMPK(Thr172)、mTOR、p-mTOR(Ser2448)、LC3、p62和GAPDH(均1 ∶1 000)。洗涤3次后,将膜与山羊抗小鼠或抗兔HRP偶联二抗(1 ∶2 000,美国Cell Signaling Technology公司)一起孵育。通过ECL检测试剂盒(美国Pierce Biotechnology公司)检测信号。
1.9 RNA测序(RNA sequence,RNA-Seq)由上海其明信息技术有限公司进行RNA-Seq分析。提取来自用shNC和shNOD2转染的HeLa细胞的总RNA(n=3)。将高质量的RNA样品转化成cDNA文库。纯化后的产物经过12~15轮的PCR扩增,形成最终的cDNA文库。然后按照制造商的方案在Illumina Hiseq X Ten上对文库进行测序。倍数变化>1.5和P<0.05代表差异表达基因(differentially expressed genes,DEGs)。
1.10 GFP-mRFP-LC3检测自噬体使用GFP-mRFP-LC3慢病毒[和元生物技术(上海)股份有限公司]评估自噬体。然后在LSM710共聚焦显微镜(德国Zeiss公司)下观察自噬体的定位和定量。自噬体被标记为红色和绿色(黄色荧光),而自噬溶酶体被标记为红色。
1.11 动物实验24只雌性BALB/c裸鼠(6~8周龄,18~20 g)由北京维通利华实验动物技术有限公司提供,并在无特定病原体条件下饲养。将小鼠随机分为4组,每组6只:载体组(Vec组)、NOD2过表达组(NOD2组)、shNC组和shNOD2组。Vec组和NOD2组小鼠尾静脉注射转染Vec或NOD2的SiHa细胞(1×106个细胞),shNC组和shNOD2组小鼠尾静脉注射转染shNC和shNOD2的HeLa细胞(1×106个细胞),以构建远处转移模型。通过Xenogen IVIS光谱体内成像系统(美国PerkinElmer公司)监测肺转移的荧光强度。8周后,解剖裸鼠的肺,计数肉眼可见的转移结节的数量。

2 结果
2.1 NOD2与宫颈癌的不良结局相关采用基因表达谱交互式分析(GEPIA,http://gepia.cancer-pku.cn/)结合了基因型-组织表达(GTEx)数据集,包括306例宫颈癌患者和13例非癌患者,用于检测NOD2的mRNA表达,并证明NOD2在CC组织中表达明显高于正常组织,并且不同分期的CC中NOD2的mRNA表达差异有统计学意义(P<0.05)(图1A、B)。使用TCGA数据集对生存数据的分析揭示,在宫颈鳞状细胞癌和宫颈腺癌(cervical squamous cell carcinoma,CESC)中,NOD2的高表达与较差的总生存期和无病生存期相关(图1C、D)。为了确定NOD2的功能作用,课题组检测了NOD2在CC细胞(HeLa、SiHa、CaSki和ME-180)和人宫颈上皮细胞系Ect1/E6E7中的表达,结果显示NOD2在CC细胞中表达显著上调,其中与Ect1/E6E7细胞相比,NOD2在HeLa细胞中表达相对较高,在SiHa细胞中表达相对较低(图1E)。
2.2 NOD2正向调节CC细胞增殖根据NOD2在CC细胞系中的表达谱,将NOD2高表达的HeLa细胞用于沉默NOD2,和低NOD2表达的SiHa细胞中稳定过表达NOD2(图2A)。增殖分析结果表明,与shNC组相比,shNOD2组HeLa细胞活力(F=9.14,P<0.01)、集落数、EdU阳性细胞率均显著降低(t=8.77、10.32,均P<0.01)(图2B~D);与Vec组相比,NOD2组SiHa细胞活力(F=11.29,P<0.01)、集落数、EdU阳性细胞率均增加(t=4.81、4.61,均P<0.01)(图2E~G)。

图2 NOD2正向调节CC细胞增殖 ×50
2.3 NOD2对CC细胞体内外转移的抑制作用Transwell侵袭试验显示,与shNC组相比,shNOD2组HeLa细胞迁移和侵袭数均降低(t=4.70、5.54,P=0.003、<0.01)(图3A);与Vec组相比,NOD2组SiHa细胞迁移和侵袭数均增加(t=4.66、4.73,P=0.003、0.003)(图3B)。为了评估NOD2在CC细胞体内转移中的功能作用,通过尾静脉将稳定转染的CC细胞注射到裸鼠中以产生肺转移模型。8周后,与shNC组相比,shNOD2组中HeLa细胞的肺定殖、肺转移灶减少(t=4.36、4.52,P=0.009、0.007)(图3C、D);与Vec组相比,NOD2组中SiHa细胞的肺定殖、肺转移灶增加(t=4.38、3.81,P=0.009、0.015)(图3E、F)。

图3 NOD2对CC细胞体内外转移的抑制作用
2.4 NOD2调控AMPK/mTOR信号通路为进一步探索NOD2抑制CC进展的机制,用shNC和shNOD2转染的HeLa细胞中,通过高通量RNA测序(RNA-Seq)进行转录组分析。在NOD2下调的HeLa细胞中,451个差异表达的基因(DEGs)上调,892个DEGs下调。随后,基因集合富集分析(GSEA )结果显示NOD2的表达与AMPK信号激活和mTOR信号抑制显著相关,表明NOD2在AMPK/mTOR信号中的潜在调节作用(图4A、B)。Western blot试验分析显示,与shNC组相比,shNOD2组磷酸化AMPK蛋白的表达水平降低(t=9.05,P<0.01),磷酸化mTOR蛋白的表达水平增加(t=11.59,P<0.01);与Vec组相比,NOD2组磷酸化AMPK蛋白的表达水平增加(t=4.70,P<0.01),和磷酸化mTOR蛋白的表达水平降低(t=9.36,P<0.01)(图4C)。

图4 NOD2对CC细胞AMPK/mTOR信号通路的影响
2.5 NOD2通过AMPK/mTOR信号介导CC细胞的自噬激活此外,GSEA结果显示,NOD2的表达与自噬调节途径激活、自噬体形成显著相关,表明NOD2在自噬调节中的潜在调节作用(图5A、B)。因此,进一步评估NOD2在自噬调节中的功能作用。首先,用GFP-mRFP-LC3转染CC细胞以评估自噬流的形成。与shNC组相比,shNOD2组GFP-mRFP-LC3的点积累减少(t=4.78,P<0.01);与Vec组相比,NOD2的GFP-mRFP-LC3的点积累增加(t=4.52,P<0.01)(图5C、D)。此外,Western blot试验分析显示,与shNC组相比,shNOD2组LC3表达水平减少(t=7.13,P<0.01),p62表达水平增加(t=6.61,P<0.01);与Vec组相比,NOD2组LC3表达水平显著增加(t=8.43,P<0.01),p62表达水平减少(t=8.75,P<0.01)(图5E)。
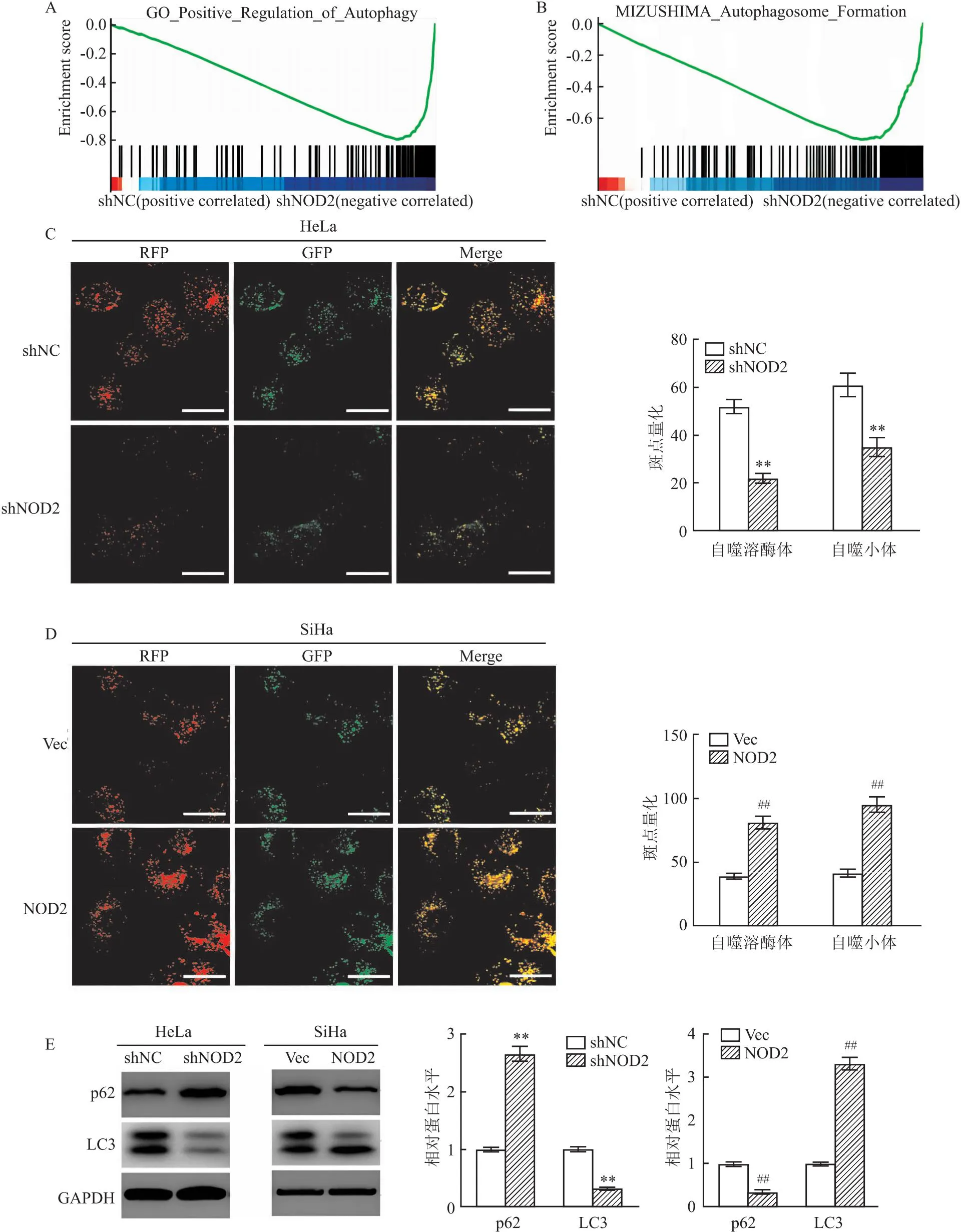
图5 NOD2通过AMPK/mTOR信号介导CC细胞的自噬激活
3 讨论
近年来,尽管CC的临床治疗取得了进展,但预后仍不令人满意[9]。因此,迫切需要确定更可靠的治疗靶点并阐明其对CC进展的影响。本研究使用一系列体外和体内功能丧失和获得实验证明了NOD2在抑制CC进展中的作用。首先,对在线数据库的分析显示NOD2在CC组织中上调,并且NOD2的表达水平与较差的预后相关。使用各种功能实验来评估NOD2在CC细胞的增殖、迁移和侵袭中的作用。NOD2显示出恶性表型。一系列功能获得实验证实NOD2在促进CC进展中的作用,显示NOD2可以通过激活AMPK/mTOR/自噬信号传导促进CC细胞进展。
转移性和复发性CC是高度难治的肿瘤,治疗具有挑战性。先前的研究[10]表明,几种PRRs与CC的发展有关。PRRs的NLR家族已在宿主免疫防御中得到鉴定,其成员NOD2广泛表达于女性生殖器官,包括子宫内膜、输卵管、子宫颈和外子宫颈[8]。NOD2在CC的发展中起重要作用,其失调推动宫颈上皮内瘤变发展为CC[11]。研究[8]中,与正常子宫颈相比,CSCC组织中检测到较高水平的NOD2,尤其在LVSI、淋巴结转移和低分化肿瘤中特别高表达,并与较差的生存率相关。本研究中,与Ect1/E6E7细胞相比,NOD2在CC细胞中表达显著上调。这与在结肠癌转移和乳腺癌细胞系中观察到的NOD2表达增加一致[12-13]。随后,体外功能获得和丧失实验强调了NOD2在促进CC细胞增殖、迁移和侵袭中的重要作用。尾静脉注射模型显示,NOD2过表达导致CC细胞体内远端器官的转移率增加。这些体内和体外结果表明,特异性靶向NOD2的shRNAs可以有效抑制CC生长和转移。然而,NOD2促进CC进展的潜在机制尚未完全研究。
为进一步探索NOD2促进CC进展的机制,在用shNC和shNOD2转染的HeLa细胞中,通过RNA-Seq进行转录组分析显示NOD2的表达与AMPK信号激活和mTOR信号抑制显著相关,表明NOD2在AMPK/mTOR信号中的潜在调节作用。研究[14]显示,AMPK/mTOR信号通路激活可诱导癌细胞自噬和自噬性死亡,从而促进肿瘤的发生和发展。例如,Liu et al[15]报道BDH2通过抑制PI3K/AKT/mTOR信号传导抑制肿瘤进展。Tang et al[16]表明沉默AMPK/mTOR信号通路抑制GBM的进展。另一项研究[17]表明,盐霉素可以通过增加活性氧的产生,从而激活PI3K/AKT/mTOR和ERK/p38 MAPK信号通路,促进细胞自噬。本研究中,NOD2的表达与AMPK信号激活和mTOR信号抑制相关,表明NOD2在AMPK/mTOR信号中的潜在调节作用。因此,癌细胞利用NOD2的细胞保护能力来创造促进癌细胞存活的微环境。
自噬是一种溶酶体依赖的分解代谢途径,通过该途径清除受损或衰老的细胞器。自噬在调节癌症进展和确定肿瘤细胞对化疗诱导的应激的反应中起重要作用[10]。然而,自噬在癌症治疗中的作用是多方面的,取决于细胞类型、微环境和肿瘤发展的阶段[18]。迄今为止,已经描述了细胞保护性和细胞毒性功能形式的自噬,其中细胞保护性自噬在对化疗的反应中更为频繁[7]。一系列证据表明,自噬通过促进癌细胞存活、细胞增殖、EMT以及耐药性,在恶性肿瘤的发生发展中发挥细胞保护作用[19]。AMPK/mTOR信号的激活已被证明与自噬激活相关[17]。本研究证实NOD2的表达与自噬调节途径、自噬体形成显著相关,表明NOD2在自噬中的潜在调节作用。
综上所述,这项研究表明,NOD2可能通过AMPK/mTOR信号促进CC增殖、迁移和侵袭,其作用机制部分涉及自噬激活。因此,靶向NOD2可能是治疗CC的有前途的治疗靶点。
