彗星实验方法的优化及影响因素的分析
2024-03-27范南英
范南英,张 鹏
彗星实验是一种基于凝胶电泳的方法,可在单细胞水平上测量DNA损伤。目前,彗星实验根据裂解液pH的高低可以分为碱性彗星实验[1]和中性彗星实验[2]。碱性彗星实验灵敏度较高,广泛用于DNA单链、双链断裂或碱不稳定位点的检测。影响彗星实验结果的因素比较多,如琼脂糖浓度、细胞密度、电压以及其他未知原因[3-5],因此实验中选择合适的阳性对照对于彗星实验结果可信度非常重要。过氧化氢(hydrogen peroxide,H2O2)是一种强氧化剂,将细胞暴露于H2O2会导致细胞DNA发生损伤[6]。有研究[7-8]通过400 μmol/L H2O2处理构建人肝癌细胞(HepG2)的损伤模型。另有研究[9-12]选用1 mmol/L H2O2处理的心肌细胞(H9c2细胞)构建损伤模型。不同细胞对H2O2的敏感性不同,因此,构建细胞损伤模型时应根据细胞类型来确定H2O2浓度。目前,体外损伤模型的建立主要集中在肝细胞或心肌细胞。对于白血病细胞HL-60损伤模型构建的研究很少。因此,该研究以H2O2为DNA损伤诱导剂,探讨影响彗星实验结果的可能因素,分析各种影响因素对彗星实验结果的可能原因,为稳定可靠的彗星实验提供理论依据。
1 材料与方法
1.1 材料IMDM基础培养基、细胞培养用血清(fetal bovine serum, FBS)、磷酸盐缓冲液(phosphate buffer solution,PBS)、100 000 U/L青链霉素均来自美国Gibco公司;6孔板和T25培养瓶购自康宁Corning公司;HL-60细胞为本实验室保存。30% H2O2来自重庆川东化工有限公司;NaOH来自天津科密欧公司;Na2EDTA、正常熔点琼脂糖来自北京索莱宝科技有限公司;月桂酰基氨酸钠、氯化钠、低熔点琼脂糖均来自德国Sigma;磨砂载玻片来自广州帆船;黏附载玻片和盖玻片来自江苏世泰。
1.2 方法
1.2.1HL-60细胞培养 HL-60细胞培养于T25的细胞培养瓶,并使用IMDM完全培养基进行培养,完全培养基组成包括20% FBS、1%青链霉素;每天观察细胞生长情况,每隔1 d进行1次半量换液,细胞生长密度约90%时进行传代培养。
1.2.2制胶方法的优化 传统的制胶流程为:向载玻片上滴加100 μl正常熔点琼脂糖,加盖盖玻片压平,4 ℃、10 min后,取下盖玻片,获得底层胶;在底胶上加入混有细胞的低熔点琼脂糖,并用盖玻片压平,4 ℃、10 min后,取下盖玻片,获得第二层胶。最后根据制备底胶的方式制备第三层胶,形成类似“三明治”式的胶层结构。Ostling et al[1]的制胶方法需要3个步骤,制备的胶层较厚,在后续实验中容易脱胶。因此,本研究对该方法进行了优化,将制胶步骤由3步改为2步,具体优化步骤如下。
① 底层胶的制备:传统方法需要向载玻片上滴加100 μl正常熔点琼脂糖,加盖盖玻片(压片法);优化方法为用镀膜法制备底胶,将洁净预热的磨砂载玻片垂直放置于盛有正常熔点琼脂糖溶液的烧杯中约1 min,然后水平放置于4 ℃的载玻片架上5 min。对不同浓度的正常熔点琼脂糖(0.8%、1%)进行筛选,观察后续实验中是否有脱胶。② 包埋细胞胶层的制备:将细胞悬液与低熔点琼脂糖凝胶混合(37 ℃),滴加100 μl于底层胶上,盖上载玻片,4 ℃、10 min。对不同浓度的低熔点琼脂糖(0.5%、0.7%、1%)进行筛选,观察后续操作中是否有脱胶。
1.2.3琼脂糖溶剂的筛选 称取相应克重的琼脂糖,加入超纯水和PBS通过微波炉溶解。
1.2.4胶层中细胞密度的筛选 收集生长状态良好的HL-60细胞,用PBS调整细胞密度为2×105和6×104个/ml,将细胞悬液与低熔点琼脂糖溶液按1 ∶3的体积比混匀,取100 μl细胞-琼脂糖混合物转移到适当的正常熔点琼脂糖包被的磨砂载玻片上。立即加盖盖玻片,注意使载玻片尽可能保持水平,4 ℃、15 min。染色后通过荧光显微镜观察凝胶中细胞密度。
1.2.5碱性裂解时间的优化 将包埋有细胞的载玻片置于染色缸中,加上碱性裂解液,4 ℃下避光、裂解。对不同裂解时间(1 h、过夜裂解)进行筛选,观察细胞在琼脂糖层中的拖尾情况。
1.2.6阳性对照实验H2O2浓度的筛选 H2O2处理HL-60细胞20 min,对不同H2O2作用浓度(0.1%、0.01%、0.001%、0.000 1%)进行筛选。
2 结果
2.1 制胶方法的优化本研究对传统制胶法进行了优化,即只包含底胶和含细胞胶层。制备底胶时,采用镀膜法,制备包埋细胞胶层时采用压片法。实验结果显示,镀膜法制备的底胶表面光滑,可以解决脱胶问题,且易于学习和操作,在后续实验中没有发生脱胶。使用浓度为0.8%和1%的正常熔点琼脂糖进行镀膜时,浓度为0.8%的正常熔点琼脂糖制胶效果佳。凝胶能较好的吸附于载玻片上,胶面光滑,在后续实验中凝胶没有发生脱落。根据实验结果,选择0.8%正常熔点琼脂糖溶液制备底胶。结果显示,采用浓度为0.5%、0.7%和1%的低熔点琼脂糖包埋细胞时,0.7%包埋效果最好。此时凝胶与正常熔点琼脂糖膜的黏附性较好,在后续实验中凝胶没有发生脱落(制片操作流程见图1)。

图1 彗星实验制片流程
2.2 琼脂糖溶剂的选择将未经H2O2诱导的HL-60细胞包埋在低熔点琼脂糖中进行实验,结果显示,当琼脂糖溶剂为超纯水时,HL-60细胞出现拖尾(图2A)。当琼脂糖溶剂为PBS时,HL-60细胞没有拖尾(图2B)。
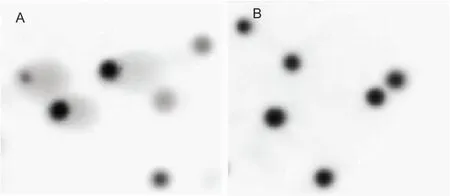
图2 琼脂糖溶剂对彗星实验结果的影响 ×20
2.3 合适细胞密度的选择在荧光显微镜下观察未经H2O2诱导的HL-60细胞电泳结果。结果显示,当凝胶中细胞密度为2×105个/ml时,视野中细胞数量较多(图3A),视野内细胞过于密集,不利于图像分析。当凝胶中细胞密度为6×104个/ml时,可观察到适量细胞,约为7个(图3B),视野中细胞数量适宜图像分析,选择6×104个/ml作为凝胶中的细胞密度。

图3 不同细胞量在视野中的显示情况 ×20
2.4 细胞裂解时间的优化将未经H2O2诱导的HL-60细胞包埋在低熔点琼脂糖中进行实验,结果显示,过夜裂解细胞,HL-60细胞DNA存在拖尾(图4A)。裂解时间为1 h,HL-60细胞DNA在电泳中没有拖尾(图4B)。
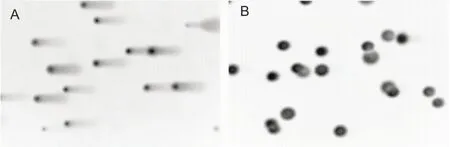
图4 裂解时间对彗星实验的影响 ×20
2.5 电泳电压的优化结果显示,电压为0.6 V/cm时,0.001% H2O2处理HL-60细胞DNA在电泳中形成刺猬状。电压为1 V/cm时,此时DNA在电泳中形成的彗星尾清晰,容易判读。电压为1.5 V/cm时,DNA在电泳中形成的彗星尾清晰度较差,不易判读。电压为1.75 V/cm时,DNA在电泳中形成的彗星尾和彗星头部已经分离。见图5。

图5 不同电压大小对彗星实验的影响 ×20
2.6 阳性对照实验的筛选本研究通过优化后的彗星实验检测不同浓度的H2O2(0.1%、0.01%、0.001%、0.000 1%)处理的HL-60细胞DNA损伤情况,验证优化后的实验体系是否可靠,并建立DNA损伤模型。结果显示,0.1%、0.01%和0.001% H2O2处理细胞DNA都出现拖尾,但0.1%和0.01% H2O2处理组DNA拖尾较大,彗星头和彗星尾已分离,不易判读。0.000 1% H2O2处理组细胞在电泳中形成刺猬状,不易观察。见图6。
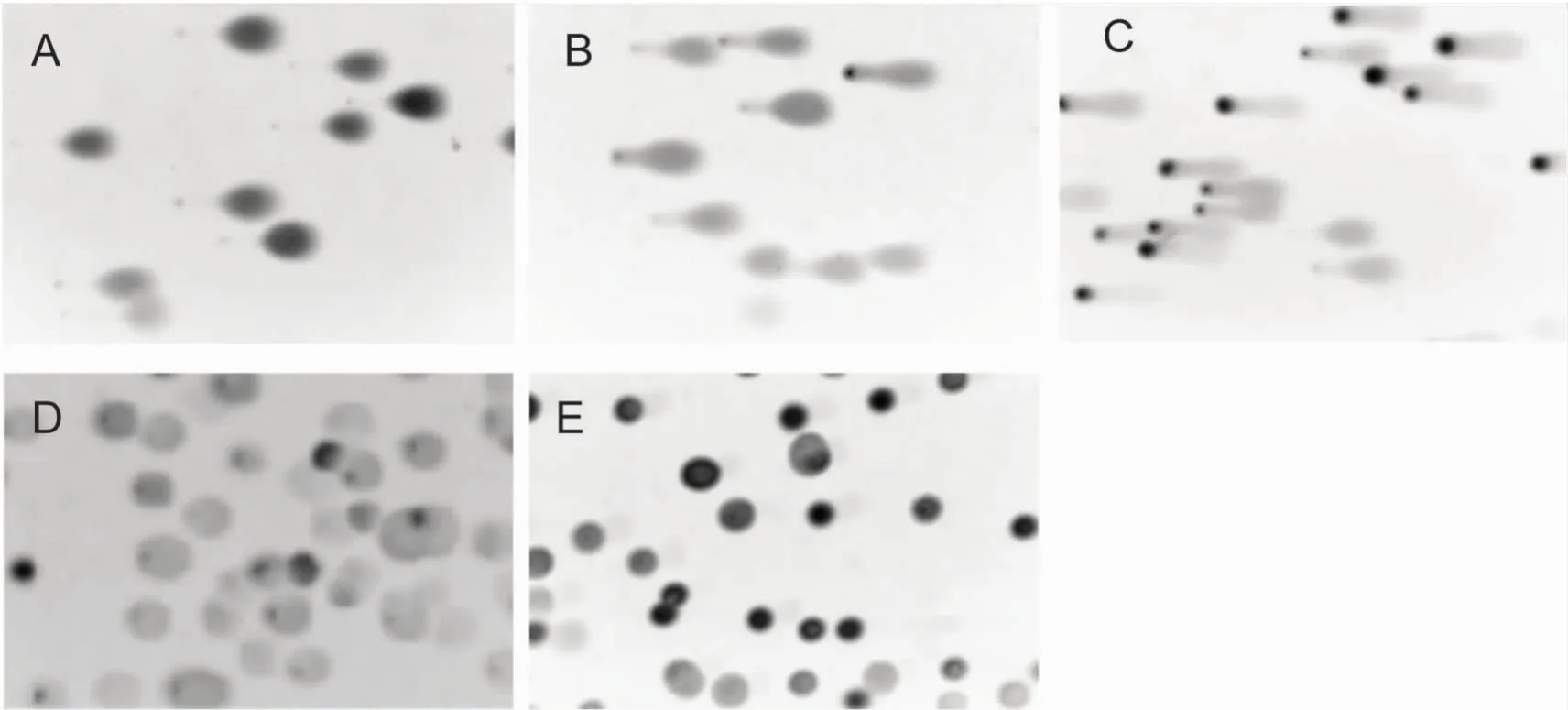
图6 不同浓度H2O2对HL-60 DNA损伤影响 ×20
3 讨论
彗星实验是一种灵敏、快速的实验方法,用于检测真核生物单个细胞中DNA双链和单链断裂以及碱不稳定位点[3]。近年来,该方法已广泛应用于遗传毒理学、环境生物监测和细胞凋亡等研究[4-5]。本研究探讨了影响彗星实验结果的可能因素,为稳定可靠的彗星实验提供理论依据。
传统彗星实验存在操作复杂,胶面不光滑和易脱胶等问题[13]。底胶不均匀和脱胶的原因主要是制备底胶时采用压片法,需要将盖玻片揭去。本研究采用镀膜法制备底胶克服了胶体不均匀和脱胶的问题。实验表明,包埋胶层的脱胶主要与低熔点琼脂糖的浓度和涂胶方式有关。若采用“三明治”法制胶,每一层胶凝固后都需移去盖玻片,极易导致脱胶。经优化后,以0.7%低熔点琼脂糖作为包埋层,采用“压片法”将其展开,这种“双层凝胶法”操作简便,较好地解决了脱胶问题。在制胶过程中确保细胞完整性也是实验成功的关键点,当溶剂为超纯水时,未经处理的HL-60细胞出现拖尾。超纯水促使细胞膜破裂,暴露的DNA与凝胶中存在的水和氧自由基(ROS,reactive oxygen species)进行水解和氧化反应,从而导致DNA损伤[14]。以PBS为溶剂,它能较好维持细胞结构和生理完整性,有助于细胞保持在其生理pH范围内,并在短期内保持细胞高活力[15]。
细胞密度也会影响彗星实验结果的判读[4],最佳的细胞密度是决定实验成败的关键因素。一个视野内的细胞数量应尽可能多,同时又不重叠,这样图像的获取快速又方便。结果表明,当细胞密度为6×104个/ml时,视野中约有7个细胞,细胞分布较好,适合凝胶中的细胞密度。同时,细胞密度也需要根据待测细胞的类型来确定[4]。当细胞DNA损伤严重时,彗星拖尾较长,应适当降低细胞密度。当细胞DNA损伤较轻时,可适当增加细胞密度。
由于电泳电压和裂解时间会对彗星实验结果产生影响,因此,每次实验的电泳条件应保持一致,以避免因电泳条件不同而出现“假阳性”结果。本实验中,电压为1 V/cm,电流为25 mA,电泳时间为25 min可以将损伤的DNA泳出。若电压太小,断裂DNA不能被泳出;电压太大,则形成的彗尾较大,不利于图像分析。因此,选择1 V/cm电压作为该实验的电泳电压。
由于彗星实验结果的影响因素繁多,因此在实验中需要设置对照来确保实验设计的合理性、实验结果的可靠性和有效性。H2O2进入细胞会产生氧自由基从而造成细胞的DNA损伤,本研究采用H2O2作为DNA损伤剂诱导HL-60细胞以建立阳性对照。实验显示,0.001% H2O2诱导HL-60形成的损伤图像清晰,彗星头清晰,彗尾长度适中,结果容易判读,根据实验结果,选择0.001% H2O2诱导作为该实验的阳性模型。高浓度H2O2(0.1% H2O2和0.01% H2O2) 诱导HL-60形成的损伤较严重,彗星头很小,结果不容易判读。同时低浓度H2O2(0.000 1%) 诱导HL-60形成的图像为刺猬状,不容易产生彗星。因此,在实际彗星实验中要针对不同细胞选择合适的H2O2作为阳性处理。
综上所述,彗星实验作为检测DNA损伤的经典方法,结果会受到多方面的因素影响,这些影响因素可能出现的原因及解决的方法如表1所示。在实验过程中通过实验流程的优化和阳性对照实验的建立才能保证准确有效彗星实验结果。

表1 彗星实验障碍及解决方法
