基于网络药理学和体内实验分析黄柏多糖治疗肝损伤的作用机制
2024-03-27莫共柔刘龙江柴慧芳
薛 娟,杨 欣,莫共柔,刘龙江,陈 彪,柴慧芳
肝脏作为人体重要的代谢和解毒器官,会受到各种因素的损害,如长期酗酒、病毒感染、药物毒性、代谢紊乱、不良情绪和免疫反应等。然而目前肝损伤的临床治疗效果不佳,病死率较高[1]。因此,探索有效的防治肝损伤的药物具有重要的意义。中医药以其多成分、多靶点的优势在防治肝损伤方面展示了广阔的开发前景。黄柏为芸香科植物黄皮树(PhellodendronamurenseSchneid.)的干燥树皮,味苦、性寒,归肾、膀胱经,具有清热燥湿、泻火除蒸、解毒疗疮之效,收载于《中国药典》[2],2021年入选贵州省道地药材目录(第一批)。现代研究[3-5]表明黄柏含有生物碱、酚酸、柠檬苦素、多糖等成分,具有抗菌、保肝、抗溃疡、抗氧化、抗痛风等多种药理活性[6-8]。与其他中药一样,黄柏化学成分复杂、作用靶点多,其保护肝脏作用的机制研究较少,有待深入探讨。该研究利用网络药理学结合小鼠免疫肝损伤实验模型,深入探讨黄柏提取物对肝损伤的保护作用及机制,为充分利用黄柏丰富的天然植物资源提供重要的科学依据。
1 材料与方法
1.1 材料
1.1.1主要试剂和仪器 黄柏药材购于贵州苗立克中药科技有限公司,批号:171101,生产许可证:黔20160079。刀豆蛋白A(Con A,货号:824V032)购于北京索莱宝科技有限公司;过氧化氢酶(catalase,CAT,货号:20211116)、超氧化物歧化酶(superoxide dismutase,SOD,货号:20211213)、丙二醛(malondialdehyde,MDA,货号:20211118)试剂盒购于南京建成生物工程研究所;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α,货号:Dec 2021)、白细胞介素(intreleukin,IL)-6、IL-1β、转化生长因子β1(transforming growth factor β1, TGF-β1)购于上海茁彩生物科技有限公司(货号均为Dec 2021);酶标分析仪购于北京普朗新技术有限公司,分析天平购于上海市卓精电子科技有限公司。
1.1.2实验动物 60只雄性BALB/c小鼠,5~6周龄,18~22 g,均购于长沙市天勤生物技术有限公司,许可证号:SCXK(湘):2019-0014。
1.2 方法
1.2.1黄柏活性成分筛选和靶点预测 借助中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com),以“黄柏”为检索词,以口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18为设定条件,筛选黄柏潜在的活性化学成分。将化学成分输入Pubchem (https: / /pubchem.ncbi.nlm.nih.gov /)数据库中下载“SDF”格式的分子结构,然后上传至Swiss target prediction平台(http://www.swisstar getprediction.ch/)筛选药物作用靶点。
1.2.2疾病靶点筛选 以“liver injury”为关键词在GeneCards(http://www.genecards.org/)、OMIM数据库(http://www.omim.org)数据库检索疾病靶点,将两个数据库靶点信息进行合并去重,获得肝损伤相关靶点。将黄柏活性成分靶点和疾病靶点导入FunRich 3.1.3软件取交集,最终获得黄柏治疗肝损伤的潜在作用靶点。
1.2.3蛋白相互作用 将获取的交集靶点导入STRING(https: //cn.string-db.org/)网站,得到蛋白互作网络(PPI)和TSV文件,再用R软件对TSV文件的靶点数据行统计和绘图分析。
1.2.4GO功能及KEGG通路富集分析 利用R软件对潜在作用靶点进行京都基因(geneontology, GO和基因组百科全书(kyoto encyclopedia of genes and gnomes, KEGG)通路分析。GO分析包括生物学过程(biological process, BP),细胞组分(cellular component, CC)和分子功能(molecular function, MF) 3个方面。GO和KEGG均选取排名前10名结果,绘制气泡图。
1.2.5分子对接 37个活性化合物从PubChem数据库下载3D结构的sdf文件并进行能量优化,再从PDB网站下载蛋白互作网络(protein protein interaction network,PPI)关联度最高的5个蛋白的蛋白质结构,存为pdb文件,后将其导入SYBYL 2.1.1软件中进行预处理,包括提取配体小分子、去除水分子、加氢等。最后利用SYBYL 2.1.1将对应的化合物与蛋白进行分子对接,利用打分函数进行评价。
1.2.6动物实验
1.2.6.1分组、给药及模型建立 雄性BALB/c小鼠,随机分成6组,每组10只:空白组、模型组、阳性药物组及黄柏多糖高、中、低剂量组。空白组和模型组以等体积生理盐水进行灌胃,阳性药物组以联苯双酯滴丸200 mg/kg的剂量进行灌胃,黄柏多糖高、中、低剂量组分别以黄柏多糖686.4、343.2、171.4 mg/kg进行灌胃(剂量依据《中国药典》中黄柏人用剂量经人/小鼠等效剂量折算后设置),每日灌胃1次,连续灌胃14 d。末次灌胃1 h后,空白组尾静脉注射生理盐水10 ml/kg,其余5组静脉注射Con A 15 mg/kg造模。禁食禁水6 h,小鼠眼球取血,室温静止后离心,血清-80 ℃保存;随后立即脱臼处死小鼠,摘取的肝脏部分于-80 ℃冰箱保存,部分常温保存,用4%多聚甲醛固定。
1.2.6.2肝组织病理观察 部分肝组织用4%多聚甲醛后,石蜡包埋切片,将切片入二甲苯,水化,苏木精-伊红(HE)染色,在光学显微镜下进行病理形态检查。
1.2.6.3小鼠血清中碱性磷酸酶(alkaline phosphatase,ALP)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平检测 小鼠血清按照试剂盒说明书检测ALP、AST水平。
1.2.6.4肝脏中SOD、CAT、MDA水平检测 取肝组织适量,生理盐水配成匀浆液,15 000 r/min离心10 min,取上清液,用BCA法测肝组织蛋白浓度,按照试剂盒说明书测定MDA、CAT水平与SOD活性。
1.2.6.5血清中TNF-α、IL-6、IL-1β、TGF-β1炎症因子含量的测定 采用ELISA法,严格按照试剂盒说明检测小鼠血清中TNF-α、IL-6、IL-1β、TGF-β1含量。
1.2.6.6qRT-PCR检测肝组织TNF-α mRNA表达 取肝脏组织提取RNA,逆转录为cDNA,以β-actin作为内参照,采用2-ΔΔCt法计算TNF-α基因mRNA表达水平。TNF-α上游引物:5′-GAGACAGATGTGGGGTGTGA-3′,下游引物5′-GTCACTCGGGGTTCGAGAAG-3′。
1.3 统计学处理数据统计分析采用SPSS 21.0软件,组间比较用单因素方差分析,LSD-t检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 黄柏活性成分靶点及疾病靶基因筛选结果最终获得37个黄柏化学成分,见表1。37个成分经Swiss target prediction平台预测获得467个靶点蛋白。基于GeneCards、OMIM数据库检索,整理得到2 607 个疾病靶点;将上述黄柏靶点蛋白与疾病靶点取交集并绘制Venn图,得到核心靶点346个,见图1。
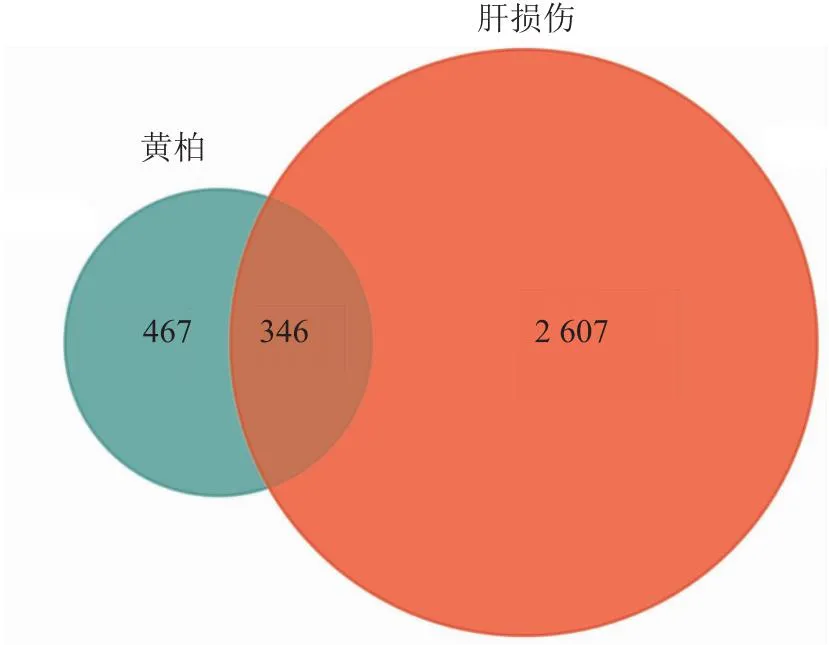
图1 中药黄柏与肝损伤交互靶点信息

表1 黄柏活性成分信息
2.2 蛋白相互作用346个靶点使用STRING进行PPI分析,利用R语言绘制蛋白质节点的条形图,见图2。Degree排名前5的节点包括TNF-α,丝氨酸/苏氨酸蛋白激酶1(serine/threonine-protein kinase 1,AKT1),信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3),表皮生长因子受体(pidermal growth factor receptor,EGFR)和半胱天蛋白酶3(caspase-3,CASP3)。
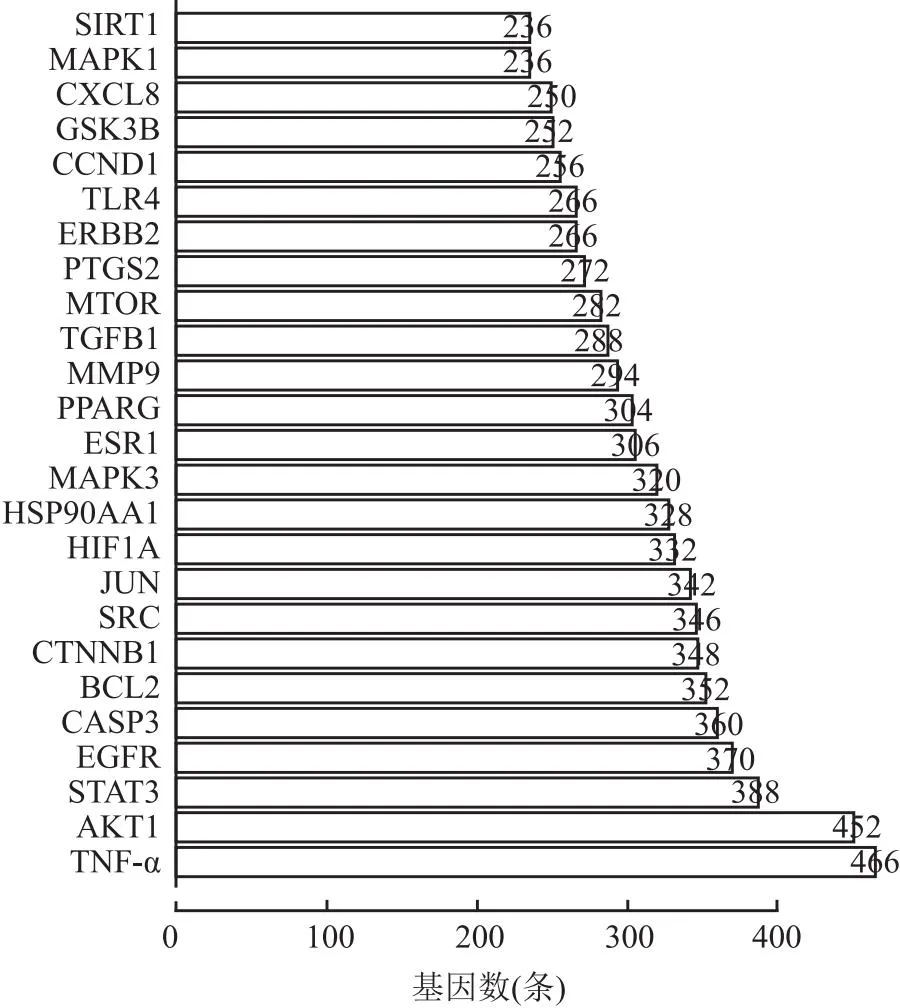
图2 PPI网络核心基因条形图
2.3 GO功能及KEGG通路富集分析使用R语言完成346个靶点的GO富集分析,输出前10项,见图3(A~C)。结果显示346个靶点参与的生物过程中主要富集于MAPK级联反应的正向调控、激酶活性的正向调节、对异种刺激的反应、氧化应激反应等;细胞组分主要涉及膜筏、膜微域、神经元细胞体、焦点粘连等;分子功能主要为蛋白丝氨酸/苏氨酸激酶活性、蛋白丝氨酸激酶活性、蛋白酪氨酸激酶活性和RNA聚合酶II-特异性DNA-结合转录因子结合等。

图3 GO功能和KEGG通路富集分析气泡图
346个靶点涉及的信号通路同样基于R语言输出前10项,见图3D。主要涉及PI3K-Akt信号通路(PI3K-Akt signaling pathway)、脂质和动脉粥样硬化(lipid and atherosclerosis)、癌症中的蛋白多糖(proteoglycans in cancer)、乙型肝炎(Hepatitis B)等。
2.4 分子对接基于SYBYL 2.1.1分子对接验证黄柏37个化学成分与5个关键靶点的结合情况,对接结果以打分函数T_score≥5为阈值,T_score≥5表示活性成分与靶标蛋白有较好的结合,分子对接结果见表2。37个成分中,22个成分能与AKT1有较好的结合,21个成分能与CASP3、TNF-α有较好的结合,17个成分能与STAT3、EGFR有较好的结合。37个成分中,9个化学成分能同时与5个靶点(TNF-α、AKT1、STAT3、EGFR、CASP3)有较好的结合(T_score≥5,图4),分别是Hericenone H、delta 7-stigmastenol、campesterol、Candletoxin A、beta-sitosterol、quercetin、phellamurin_qt、poriferast-5-en-3beta-ol、niloticin,它们可能是黄柏治疗肝损伤的关键成分,后续将进一步深入研究。
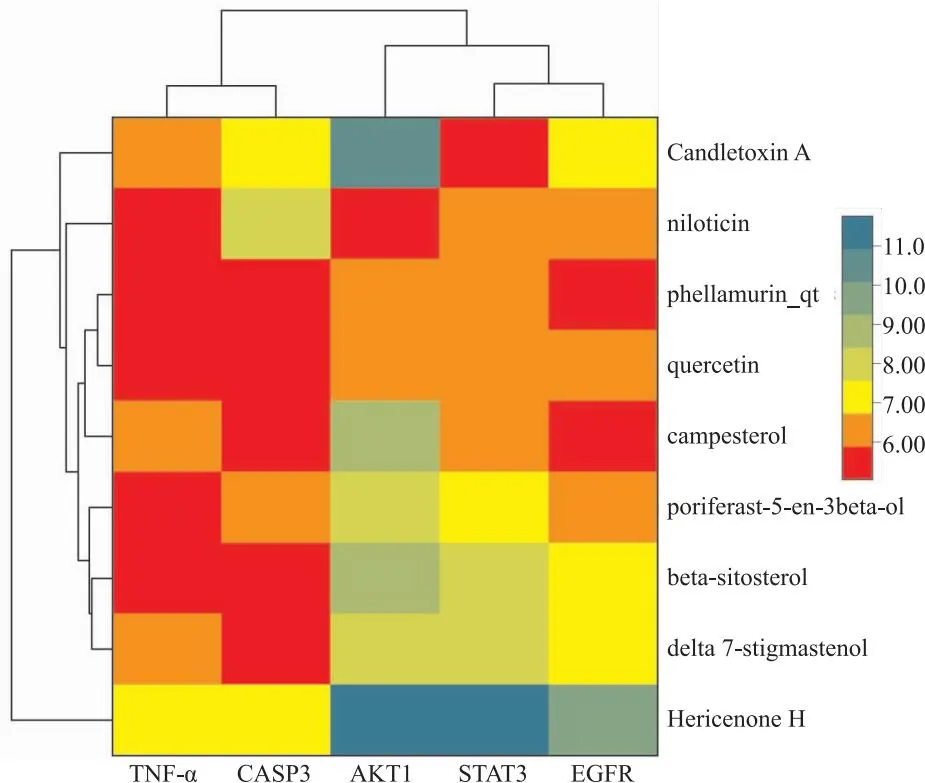
图4 分子对接热图

表2 分子对接分析
2.5 动物实验结果
2.5.1小鼠肝组织病理变化 各组小鼠肝组织HE染色结果如图5所示。空白组肝脏组织结构正常,肝细胞排列整齐、分布均匀,细胞核完整,无炎症颗粒细胞浸润。模型组肝脏组织结构明显异常,肝细胞已经紊乱,细胞核固缩,且有炎性颗粒细胞浸润。与模型组相比,阳性对照组和黄柏多糖高剂量组肝脏组织细胞结构显著改善,炎性颗粒细胞明显减少,黄柏多糖中、低剂量组也有一定改善。
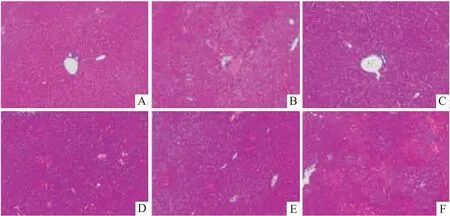
图5 黄柏多糖对Con A诱导肝损伤小鼠肝组织病理变化的影响 HE ×100
2.5.2小鼠肝功能指标AST、ALP的检测 与空白组相比,模型组小鼠血清AST、ALP水平显著升高(P<0.01),说明尾静脉注射Con A对小鼠肝组织造成了严重损伤。各给药组小鼠的ALP、AST水平与模型组相比,均下降,其中黄柏多糖高剂量组有显著差异(P<0.01),黄柏多糖中剂量组有差异(P<0.05),见表3。
表3 黄柏多糖对小鼠血清AST、ALP的影响
2.5.3肝脏中SOD、CAT、MDA的水平检测 与空白组对比,模型组小鼠肝脏中的SOD、CAT含量显著下降(P<0.01),MDA含量显著升高(P<0.01)。黄柏多糖干预后,SOD、CAT含量均有所升高,MDA含量有所降低,其中高剂量组变化最显著(P<0.01),中剂量组次之(P<0.05),低剂量组最弱,见图6。

图6 黄柏多糖对肝损伤小鼠血清SOD、CAT、MDA的影响
2.5.4血清中TNF-α、IL-6、IL-1β、TGF-β1免疫炎症因子含量的测定 各组对Con A诱导肝损伤小鼠血清炎症因子的影响结果见图7。与空白组比较,模型组小鼠血清中TNF-α、IL-6、IL-1β、TGF-β1含量显著升高(P<0.01)。给予黄柏多糖后,各组小鼠血清中TNF-α、IL-6、IL-1β、TGF-β1均有一定程度的降低,其中高剂量组变化最显著(P<0.01),中剂量组次之(P<0.05或0.01),低剂量组各因子也有所降低,但差异无统计学意义。

图7 黄柏多糖对肝损伤小鼠血清TNF-α、IL-6、IL-1β、TGF-β1细胞因子的影响
2.5.5qRT-PCR检测肝组织TNF-α mRNA表达 选取PPI网络中最重要的TNF-α基因进行实验验证。与空白组比较,模型组小鼠肝组织中TNF-α mRNA表达水平显著升高(P<0.01)。与模型组相比,黄柏多糖高、中剂量组TNF-α mRNA水平显著降低(P<0.01或0.05),黄柏多糖低剂量组也有所降低,见图8。

图8 黄柏多糖对肝损伤小鼠肝脏TNF-α mRNA表达的影响
3 讨论
中药是中华文明的瑰宝,在防治肝病方面有着悠久的用药历史,因此,以中药为着眼点,开发其药用价值并探讨作用机制有一定的创新性。网络药理学的出现为预测中药成分靶标和疾病基因提供了新的手段,它从整体角度探索药物与疾病的关联性[9]。因此通过网络药理学分析和体内实验验证黄柏抗肝损伤的作用机制、筛选其活性成分靶点有重要意义。
本研究首先于TCMSP数据库检索并筛选得到37个黄柏潜在的活性成分,主要有小檗碱、黄连碱、黄柏酮等多种化合物。研究[10]表明,黄柏提取液对D-氨基半乳糖(D-Gal N)诱导的急性肝损伤有较好的预防性保护作用,其作用机制可能与清除氧自由基,降低脂质过氧化等抗氧化作用有关。黄柏乙醇提取物对α-萘异硫氰酸酯(ANIT)诱导的黄疸型肝炎模型小鼠具有一定的预防及治疗作用。同时,对于黄药子导致的肝中毒,黄芩、黄柏及其配伍使用可显著降低大鼠血清转氨酶,其中黄芩配伍黄柏使用效果最佳。这些研究结果均表明黄柏有效成分具有保护肝损伤作用,然而,药效物质基础及作用分子机制尚不明确。
对黄柏与肝损伤疾病交集靶点进行PPI分析,结果显示TNF-α、AKT1、STAT3、EGFR和CASP3是5个度值最大的靶点。TNF-α可促白细胞活化、聚集、黏附,也可促血小板活化,加重组织炎症反应,致肝损伤[9]。AKT1参与细胞增殖、细胞生长、代谢、氧化应激、炎症等方面相关的信号通路[11]。STAT3广泛分布于各个器官,参与各胚层发育、免疫细胞分化发育、肿瘤等各种病理生理过程,是调节细胞增殖、分化、存活,以及自身免疫和炎症的关键因子,EGFR在控制炎症方面具有关键作用;经过上述分析,5个核心靶点主要与炎症、细胞凋亡、氧化应激和免疫反应等密切相关。
GO分析显示,黄柏活性成分治疗肝损伤涉及MAPK级联反应的正向调控、激酶活性的正向调节、对异种刺激的反应、氧化应激反应等,KEGG分析结果表明,黄柏可能通过PI3K-Akt信号通路、脂质和动脉粥样硬化、癌症中的蛋白多糖、乙型肝炎等通路发挥对肝脏的保护作用。其中,脂质和动脉粥样硬化通路可能是肝损伤发生发展的重要环节,KEGG分析显示TNF-α、AKT1、CASP3、STAT3等多个靶点均富集在该通路上,说明调控该通路可能是黄柏缓解临床症状、保护肝损伤的作用机制。
进一步对黄柏潜在活性成分等与关键靶点蛋白进行分子对接,发现大部分活性成分可与靶点蛋白有较好的结合作用,其中Hericenone H、delta 7-stigmastenol、campesterol、Candletoxin A、beta-sitosterol、quercetin、phellamurin_qt、poriferast-5-en-3beta-ol、niloticin 9个成分均可与5个核心靶点TNF-α、AKT1、STAT3、EGFR和CASP3结合,由此推测该9个成分可能是这些靶点蛋白的潜在抑制剂,而这5个靶点亦可能是黄柏治疗肝损伤的关键靶点。
综合考虑网络药理学以及分子对接结果,进一步进行小鼠体内实验研究。研究[12]表明,黄柏具有广谱抗炎和免疫调节活性。如黄柏水提物可通过抑制γ-干扰素(interferon-γ,IFN-γ)、IL-1、TNF-α等细胞因子的产生和分泌,从而抑制小鼠迟发型超敏反应(delayed type hypersensitivity,DTH)。由Con A引起的肝损伤是国际公认的免疫性肝损伤实验动物模型,因此本研究选择Con A建立小鼠肝损伤模型。动物实验结果显示,经黄柏多糖治疗后,Con A诱导的肝损伤小鼠转氨酶水平降低,肝脏组织中SOD、CAT水平升高,MDA水平下降,黄柏多糖干预可降低肝损伤小鼠血清中促炎因子TNF-α、IL-6、IL-1β、TGF-β1水平,明显逆转了Con A诱导的肝损伤小鼠肝脏TNF-α mRNA水平的升高。研究表明,测定血清中ALP和AST活性可反映肝细胞损伤的程度;同时,当肝细胞受到损伤后,MDA含量升高,其具有较强毒性,可导致细胞裂解和坏死,破坏蛋白和酶的结构和功能[13-14],同时,作为抗氧化酶的SOD和CAT发挥抗氧化作用,从而防止肝细胞损伤[15]。以上结果表明黄柏多糖保护肝损伤作用可能与降低体内氧化应激及调控炎症因子水平有关。
综上所述,黄柏提取物可以改善Con A诱导的小鼠免疫性肝损伤,其机制可能通过抑制氧化应激和炎症反应来实现。本研究为黄柏治疗肝损伤奠定了一定的研究基础,但仍需细胞实验进行进一步验证。
