局部晚期食管癌患者血清miR-193b、miR-330-5p水平与新辅助放化疗疗效的关系
2024-03-08胡芳方向东付江萍伍桂容殷锟鹏杜林娟
胡芳,方向东,付江萍,伍桂容,殷锟鹏,杜林娟
达州市中心医院肿瘤内科,四川达州 635000
食管癌是起源于食管上皮的恶性肿瘤,临床以进行性吞咽困难为进展期典型症状[1]。多数食管癌患者早期无明显特异性症状,确诊时已为局部晚期,仅靠单纯手术无法根治。新辅助放化疗后手术为局部晚期食管癌患者的首选治疗方案,相对于单纯手术,术前行新辅助放化疗能有效缩小肿瘤体积,提高手术效果,改善患者预后[2]。但由于受到细胞氧合、基因等因素的影响,食管癌患者对放化疗的反应存在差异[3]。因此,寻找可评估局部晚期食管癌患者新辅助放化疗疗效的血清标志物对指导临床治疗具有积极意义。微小RNA(miRNA)为内源性非编码RNA,能通过调控靶基因实现对肿瘤的调控,从而在肿瘤发生发展、转移过程及放化疗敏感性中发挥重要作用[4]。多项研究显示,miR-193b、miR-330-5p 在恶性肿瘤的发生发展、转移过程中发挥抑癌基因作用。miR-193b 是位于人16p13、12 的非编码小分子RNA,有研究显示其可抑制肿瘤细胞的增殖能力[5]。miR-330-5p 是与细胞侵袭及增殖等有关的非编码RNA,在多种组织器官的恶性生物学过程中发挥重要作用[6]。目前,关于miR-193b、miR-330-5p 对恶性肿瘤放化疗疗效影响的研究相对较少。基于此,本研究观察了血清miR-193b、miR-330-5p 水平与局部晚期食管癌患者新辅助放化疗临床疗效的关系,旨在为食管癌的临床治疗提供参考依据。
1 资料与方法
1.1 临床资料 经达州市中心医院医学伦理委员会批准(2018012),收集2018年1月—2020年3月本院收治的局部晚期食管癌患者。纳入标准:①符合《中国早期食管癌筛查及内镜诊治专家共识意见》中食管癌的诊断标准[7],且经影像学、组织病理学检查确诊为食管癌;②美国癌症联合会TNM 分期为T3~T4/N1~N2/M0;③接受新辅助放化疗;④卡氏评分≥70 分;⑤至少有一处可测量的病灶;⑥临床病理资料和随访资料完整;⑦患者及家属均签署知情同意书。排除标准:①合并重要脏器功能衰竭;②合并消化道出血、严重感染;③放化疗不耐受;④合并其他恶性肿瘤;⑤妊娠或哺乳期妇女;⑥伴食管气管瘘。共收集符合上述标准的局部晚期食管癌患者180例,其中男97 例、女83 例,年龄22~75(55.46 ±7.82)岁,病理类型鳞癌152例、腺癌28例。
1.2 血清miR-193b、miR-330-5p 检测方法 采用qRT-PCR 法。所有纳入患者放化疗前取空腹静脉血,离心分离血清。使用TRIzol 试剂盒(张家口赛诺生物科技有限公司)提取血清总RNA,微量分光光度计(上海科那美科学仪器有限公司)验证其纯度与浓度,使用反转录试剂盒合成cDNA。以cDNA 作为模板,按SYBR Premix Ex Taq 试剂盒(北京智杰方远科技有限公司)行PCR扩增,引物合成与序列测定由上海基康生物技术有限公司完成。反应条件:95 ℃ 90 s、95 ℃ 30 s、62 ℃ 30 s、72 ℃ 15 s,共循环40 次。引物序列:miR-193b 上游引物5′-ACACTCCAGCTGGGAACTGGCCCTCAAAGT-3′,下游引物5′-TGGTGTCGTGGAGTCG-3′;miR-330-5p 上游引物5′-GCCTCTCTGGGCCTGTTGTC-3′,下游引物5′-CAGTGCAGGGTCCGAGG-3′;U6 上游引物5′-CGTCGACGTGCATGCACG-3′,下游引物5′-GCTTAAGCTAGCTAGCGC-3′。以U6 为内参,按2-ΔΔCt法计算miR-193b、miR-330-5p 相对表达量。
1.3 新辅助放化疗及疗效评价方法 放疗前通过电子计算机断层扫描扫描定位,层厚为5 mm;确认靶区,计划靶体积,剂量在40~50 Gy,每次2 Gy,每周治疗5 次,期间采用医用直线加速器(美国Varian公司)进行放疗。放疗计划开始同步第1 天行新辅助化疗,顺铂联合5-氟尿嘧啶方案:第1~3 天以75 mg/m2标准的顺铂静脉滴注,第1~5 天静脉滴注500 mg/m2的5-氟尿嘧啶,21 d 为一化疗周期,患者持续化疗2 周期。新辅助放化疗4~6 周后评估分期,再针对性对患者进行手术治疗。于治疗后参考《实体瘤治疗疗效评价标准—RECIST》[8]评估放化疗疗效。所有目标病灶消失,无新病灶出现,且维持4 周以上为完全缓解(CR);所有目标病灶最长径总和下降≥30%,且维持4 周以上为部分缓解(PR);最小目标病灶最长径总和增加≥20%,或出现一个或多个新病灶为疾病进展(PD);所有目标病灶最长径总和缩小但未达到PR 或增加未达到PD 为稳定(SD)。将CR+PR 者定义为放化疗有效者,SD+PD 者定义为放化疗无效者。
1.4 统计学方法 采用SPSS25.0 统计软件。计量资料使用K-S 法进行正态性检验,符合正态分布的以表示,组间比较采用t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料以例或率表示,组间比较采用χ2检验;比较新辅助放化疗有效与无效的局部晚期食管癌患者临床资料,取有统计学差异的临床资料进一步纳入多因素Logistic 回归分析。采用多因素Logistic 回归分析局部晚期食管癌患者新辅助放化疗无效的影响因素,并通过绘制受试者工作特征(ROC)曲线分析血清miR-193b、miR-330-5p 对局部晚期食管癌患者新辅助放化疗无效的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 局部晚期食管癌患者新辅助放化疗疗效评价结果 180 例局部晚期食管癌患者行新辅助放化疗后CR 22 例、PR 62 例、SD 78 例、PD 18 例;放化疗有效者共84例、无效者共96例。
2.2 血清miR-193b、miR-330-5p 水平与局部晚期食管癌新辅助放化疗疗效的关系 新辅助放化疗有效的局部晚期食管癌患者中男48 例、女36 例,年龄(55.13 ± 7.19)岁,病理类型为鳞癌69 例、腺癌15例、肿瘤直径<5 cm 42 例、≥5 cm 42 例,肿瘤位置为颈段与胸上段47 例、胸中段与胸下段37 例,肿瘤分化程度为低分化9例、中分化12例、高分化63例,肿瘤T 分期为T3期39 例、T4期45 例,肿瘤N 分期为N1期61 例、N2期23 例,血清miR-193b 为7.48 ± 1.25,血清miR-330-5p 为2.03 ± 0.26;放化疗无效的局部晚期食管癌患者中男49 例、女47 例,年龄(55.75 ±7.44)岁,病理类型为鳞癌83 例、腺癌13 例、肿瘤直径<5 cm 40 例、≥5 cm 56 例,肿瘤位置为颈段与胸上段59 例、胸中段与胸下段37 例,肿瘤分化程度为低分化23 例、中分化25 例、高分化48 例,肿瘤T 分期为T3期37 例、T4期59 例,肿瘤N 分期为N1期38 例、N2期58 例,血清miR-193b 为1.67 ± 0.44,血清miR-330-5p 为0.30 ± 0.14。新辅助放化疗有效与无效的局部晚期食管癌患者肿瘤分化程度、肿瘤N分期、血清miR-193b、血清miR-330-5p 比较差异均有统计学意义(P均<0.05)。以上述有统计学差异的因素为自变量,以局部晚期食管癌患者新辅助放化疗是否有效为因变量,纳入多因素Logistic 回归分析。赋值:放化疗无效=1、放化疗有效=0,肿瘤高分化=0、中分化=1、低分化=2,肿瘤N 分期N1期=0、N2期=1,血清miR-193b、miR-330-5p 水平为原值连续性输入。多因素Logistic回归分析结果显示,低血清miR-193b、低血清miR-330-5p 是局部晚期食管癌患者新辅助放化疗无效的独立危险因素(P均<0.05)。见表1。

表1 局部晚期食管癌患者新辅助放化疗无效的多因素Logistic回归分析结果
2.3 血清miR-193b、miR-330-5p水平对局部晚期食管癌患者新辅助放化疗无效的预测价值 ROC曲线分析结果显示,血清miR-193b、血清miR-330-5p预测局部晚期食管癌患者新辅助放化疗无效的AUC依次为0.752、0.777,两项指标联合预测局部晚期食管癌患者新辅助放化疗无效的AUC为0.829。见表2。
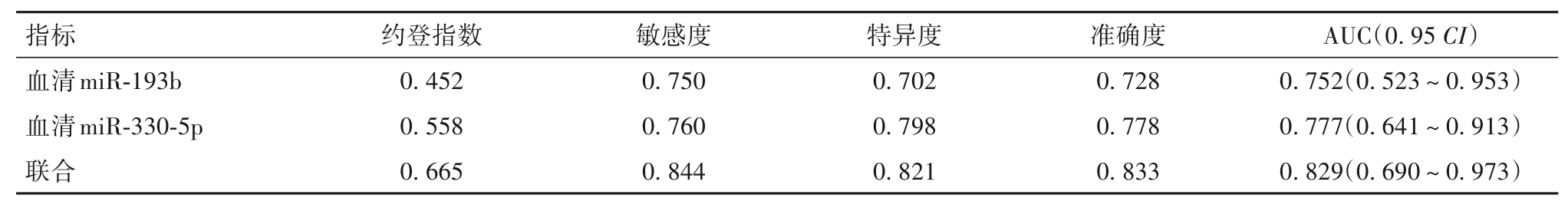
表2 血清miR-193b、miR-330-5p水平对局部晚期食管癌患者新辅助放化疗无效的预测价值
3 讨论
对局部晚期食管癌患者,新辅助放化疗后手术为首选标准治疗方案[9]。新辅助放化疗为局部晚期食管癌治疗的有效方式,术前新辅助放化疗能消除或控制潜在微小病灶,提高放射治疗的敏感性,缩短治疗时间,并能不同程度减轻肿瘤负荷与组织反应性水肿,提高手术切除率。相较于单纯手术,术前新辅助放化疗能有效改善患者生存质量,但也存在部分患者疗效不佳[10]。miRNA 普遍存在于生物体内,为高度保守的单链非编码小分子RNA,是转录、转录后基因沉默的关键调控基因,与多种生物学过程有关[11]。miRNA 可通过调控靶基因来影响肿瘤细胞对药物的吸收和代谢,进而调控化疗敏感性及放疗抵抗[12]。
miR-193b 编码基因位于人16 号染色体,参与多种病理生理过程,在多种恶性肿瘤发生发展中发挥负调控作用,是肿瘤抑制因子[13]。本研究结果显示,行新辅助放化疗有效的局部晚期食管癌患者血清miR-193b 水平高于放化疗无效患者。其原因可能为miR-193b 在食管癌中发挥抑癌基因作用,其高水平可抑制食管癌细胞增殖,而水平下调则可能激活促癌机制,导致肿瘤发生发展、侵袭转移等恶性行为,增强食管癌细胞对放化疗的敏感性[14]。miR-330-5p 为癌症相关的基因,在肺癌[15]、结直肠癌[16]、脑胶质瘤[17]、胰腺癌[18]中低表达,在恶性肿瘤中发挥抑癌作用。本研究结果显示,行新辅助放化疗有效的局部晚期食管癌患者血清miR-330-5p 水平高于放化疗无效患者,分析其原因可能为miR-330-5p 低水平能促进肿瘤组织增殖、侵袭等恶性过程,增加食管癌患者对新辅助放化疗反应性降低的风险,从而影响放化疗疗效[19]。
本研究多因素Logistic 回归分析结果显示,低血清miR-193b、低血清miR-330-5p 是局部晚期食管癌患者新辅助放化疗无效的独立危险因素;ROC曲线分析结果显示,血清miR-193b、miR-330-5p联合预测局部晚期食管癌患者新辅助放化疗无效的AUC 为0.829,敏感度与特异度分别为0.844、0.821,提示血清miR-193b、miR-330-5p 对局部晚期食管癌新辅助放化疗疗效具有一定预测价值,两者联合检测的预测效能高于单独检测。
综上所述,行新辅助放化疗有效的局部晚期食管癌患者血清miR-193b、miR-330-5p 水平高于放化疗无效的患者,血清miR-193b、血清miR-330-5p 低水平是局部晚期食管癌患者新辅助放化疗无效的独立危险因素,两者联合对局部晚期食管癌新辅助放化疗疗效具有一定预测价值,可作为新辅助放化疗疗效评估的生物学标志物。
