动力蛋白相关蛋白1 抑制剂对肠黏膜上皮细胞缺血再灌注损伤的干预作用及其机制
2024-03-08图拉妮萨喀迪尔张贻帼景祎馨廖师师罗杰丁可陈榕孟庆涛
图拉妮萨·喀迪尔,张贻帼,景祎馨,廖师师,罗杰,丁可,陈榕,孟庆涛
武汉大学人民医院麻醉科,武汉 430060
缺血再灌注损伤是由于组织长时间缺血后血流灌注恢复所致,当缺血组织恢复血流时,会加重缺血的有害影响,增强组织缺氧,激活先天免疫,增强炎症反应及细胞死亡[1]。肠缺血再灌注损伤是外科手术导致肠组织损害的重要原因,与肠扭转、肠移植、重度烧伤、创伤及休克等许多病理生理过程有关[2]。肠缺血再灌注损伤可导致肠黏膜屏障缺失,使内毒素及有害物质释放入血,严重时可引起多器官功能障碍综合征[3]。目前肠缺血再灌注损伤的具体病理生理机制仍未明确,线粒体功能障碍被认为是导致肠缺血再灌注损伤的关键因素。线粒体是一个高度动态的细胞器,能够不断进行裂变和融合,以保持其形状、分布及大小,从而应对细胞的生理需求及外部环境的变化[4]。越来越多的研究表明,有效抑制线粒体裂变可以保护各种组织免受缺血再灌注损伤等应激诱导的损伤[5]。动力蛋白相关蛋白1(Drp1)是线粒体裂变的主要介质,可以加速线粒体分裂,产生大量片段化的线粒体,在线粒体裂变的调节中起着至关重要的作用。然而,Drp1 是否能通过介导线粒体裂变在肠缺血再灌注损伤中发挥作用尚不可知。2022 年5 月—2023 年8 月,本研究通过对人大肠黏膜上皮细胞Caco-2进行缺氧复氧(H/R)处理建立体外肠缺血再灌注损伤模型,观察在体外模型中抑制Drp1 对肠缺血再灌注损伤的影响,探讨线粒体动力学在肠缺血再灌注损伤中的作用机制,以期为肠缺血再灌注损伤的治疗提供理论依据。
1 材料与方法
1.1 主要材料 人大肠黏膜上皮细胞系Caco-2 购自武汉普诺赛生命科技有限公司,线粒体膜电位检测试剂盒、CCK-8 试剂盒购自上海碧云天生物技术有限公司,线粒体超氧化物试剂盒购自美国Thermo Fisher Scientific 公司,Annexin V-EGFP/PI 凋亡试剂盒购自武汉伊莱瑞特生物科技股份有限公司,Drp1抗体购自武汉爱博泰克生物科技有限公司,线粒体融合蛋白2(Mfn2)抗体购自美国CST公司。
1.2 细胞分组及H/R 模型建立 Caco-2 细胞使用含20%胎牛血清的MEM 培养基,在37 ℃、5% CO2培养箱中培养,当细胞融合至80%时消化传代。将Caco-2 细胞分为对照组、模型组、Drp1 抑制剂组,每组6个复孔。对照组正常培养细胞,模型组、Drp1抑制剂组均采用缺氧12 h 后复氧2 h 的方法构建H/R模型,Drp1 抑制剂组在H/R 前给予Drp1 抑制剂Mdivi-1干预1 h。
1.3 细胞活力观察 采用CCK-8 法。各组进行不同处理之后继续培养24 h,每孔加入含10% CCK-8的培养基100 µL,将培养板置于培养箱中孵育2 h,使用酶标仪测定450 nm处各孔光密度(OD)值。
1.4 细胞线粒体功能观察 ①线粒体活性氧(ROS)含量:采用线粒体超氧化物指示剂法。各组进行不同处理之后继续培养24 h,使用线粒体超氧化物指示剂检测细胞内线粒体ROS 含量,按照线粒体超氧化物试剂盒说明书配置工作液,每孔加入2 mL 工作液覆盖细胞,于37 ℃避光孵育10 min,用预热的缓冲液洗涤3次,荧光显微镜下观察,采集相应的图像,Image J 软件分析ROS 平均荧光强度。②线粒体膜电位:采用JC-1 法。取分组处理后的各组细胞,用PBS 缓冲液洗涤2 次,配置JC-1 染色工作液和缓冲液,加入1 mL JC-1 染色缓冲液洗涤2 次。荧光显微镜下观察并拍照,采用Image J 软件分析各组平均荧光强度,表示线粒体膜电位大小。
1.5 细胞凋亡率测算 采用流式细胞术。取各组分组处理后培养24 h 的细胞,用不含EDTA 的胰酶消化,离心收集细胞,PBS 缓冲液洗涤2 次,加入100 µL结合液重悬,分别加入 2.5 µL FITC Annexin V及2.5 µL PI 染色液轻轻混匀,室温避光孵育15 min,加入400 µL 结合液重悬,上流式细胞仪检测细胞凋亡率,严格参照细胞凋亡检测试剂盒说明书进行操作。
1.6 细胞Drp1、Mfn2 蛋白检测 采用Western blotting法。取各组分组处理后培养24 h的细胞,PBS缓冲液清洗,加入细胞裂解液,超声、低温12 000 r/min离心,收集蛋白上清液,使用BCA 法测定蛋白浓度。100 ℃变性10 min,使用SDS-PAG 凝胶快速试剂盒制胶,电泳,转至PVDP膜,5%脱脂牛奶室温封闭2 h,加入Drp1(1∶1 000)、Mfn2(1∶1 000),β-actin(1∶1 000)一抗4 ℃孵育过夜,TBST洗涤,室温孵育相应二抗,TBST 洗涤,加入ECL 化学发光液,上机显影。采用Image J 软件分析条带灰度值,计算目的蛋白相对表达量。
1.7 统计学方法 采用GraphPad Prism 统计软件。计量资料采用K-S正态性检验,呈正态分布时以表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布时以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞活力比较 对照组、模型组、Drp1 抑制剂组细胞活力分别为98.47 ± 1.60、41.90 ±3.30、78.80 ± 2.75,细胞活力对照组>Drp1 抑制剂组>模型组(P均<0.05)。
2.2 各组细胞内线粒体ROS 含量及线粒体膜电位比较 细胞内线粒体ROS 含量模型组>Drp1 抑制剂组>对照组,线粒体膜电位对照组>Drp1 抑制剂组>模型组(P均<0.05)。见表1。
表1 各组细胞内线粒体ROS含量及线粒体膜电位比较()

表1 各组细胞内线粒体ROS含量及线粒体膜电位比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
?
2.3 各组细胞凋亡率比较 对照组、模型组、Drp1抑制剂组细胞凋亡率分别为7.38% ± 0.68%、19.63% ± 1.31%、14.22% ± 0.89%,细胞凋亡率模型组>Drp1抑制剂组>对照组(P均<0.05)。
2.4 各组细胞Drp1、Mfn2 蛋白表达比较 细胞Drp1蛋白表达模型组>Drp1抑制剂组>对照组,Mfn2蛋白表达对照组>Drp1 抑制剂组>模型组(P均<0.05)。见表2。
表2 各组细胞Drp1、Mfn2蛋白表达比较()
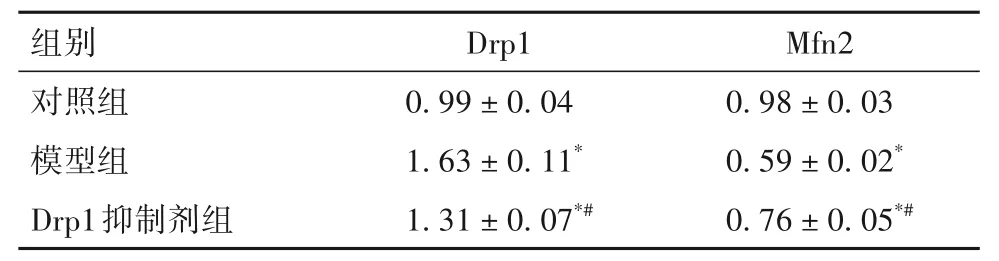
表2 各组细胞Drp1、Mfn2蛋白表达比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
?
3 讨论
肠缺血再灌注损伤是临床常见的组织器官损伤之一,往往导致肠道损伤及多个器官功能障碍,甚至危及生命[6-7]。肠缺血阶段发生线粒体功能障碍、氧化应激及代谢紊乱,可诱发肠细胞损伤,血供恢复后大量炎症因子和氧自由基释放,诱导炎症反应,引起广泛的肠上皮细胞死亡,导致肠黏膜屏障功能受损,细菌、炎症因子及内毒素释放进入循环,引起全身炎症反应综合征,进而导致多器官功能障碍[8]。肠缺血再灌注损伤机制复杂,因而目前相关机制研究尚不完善。本研究使用人大肠黏膜上皮细胞Caco-2进行H/R,体外模拟肠缺血再灌注损伤,探讨维持线粒体功能在肠缺血再灌注损伤中的作用,为肠缺血再灌注损伤的治疗提供理论依据。
线粒体质量控制对于维持细胞稳态至关重要。过度的细胞外应激会导致线粒体稳态失衡,从而引起能量代谢紊乱,最终导致细胞死亡[9]。线粒体动力学是线粒体裂变与融合的动态平衡,保持裂变与融合的稳态是维持线粒体质量最重要的环节[10]。据文献报道,线粒体动力学在多种疾病的发生发展中起到至关重要的作用[4,11]。Drp1 主要介导线粒体分裂,而Mfn2主要介导线粒体融合,Drp1、Mfn2参与调控线粒体内膜及外膜的融合与分裂过程[12]。本研究中使用Drp1 抑制剂Mdivi-1 对Caco-2 细胞进行预处理,观察了H/R 刺激下线粒体功能及线粒体分裂与融合的变化。
线粒体是细胞能量转换和新陈代谢的重要细胞器,也是氧化磷酸化合成ATP 的主要场所。线粒体膜电位是三羧酸循环相关氧化还原过程中产生的电化学势能,正常的线粒体膜电位是维持线粒体进行氧化磷酸化产生ATP 的先决条件。线粒体膜电位不仅反映了线粒体功能的完整性,同时也反映了细胞的健康状况,对细胞的生存和发展至关重要。因此,线粒体膜电位是评价线粒体功能的重要指标之一。线粒体是细胞产生ROS 的主要场所,ROS 是细胞氧化呼吸的正常代谢产物,可作为细胞内信号分子参与调节机体正常生理功能。当组织受损时,线粒体内ROS 产生大量增加,过多的ROS 会损害线粒体,导致线粒体功能异常。因此,ROS含量可在一定程度上反映线粒体功能。本研究结果显示,使用H/R刺激Caco-2 细胞可引起细胞活性降低,出现线粒体膜电位下降,ROS生成增多的线粒体功能障碍表现。而经Drp1抑制剂干预的H/R模型细胞,细胞活性升高,线粒体膜电位升高,细胞ROS 生成减少,线粒体功能明显改善。以上结果提示,抑制线粒体分裂可能通过减轻线粒体功能障碍来抑制H/R 引起的肠细胞损伤。
Drp1 不仅是线粒体分裂的重要参与者,还参与了程序性细胞死亡途径。缺血诱导激活的Drp1 可导致线粒体过度分裂,线粒体膜通透性增加,并通过诱导线粒体BAX 易位增加细胞色素C 从线粒体向细胞质的释放,并激活Caspase-3 及Caspase-9 信号通路,进而增强细胞凋亡[13-14]。本研究发现,Caco-2细胞在H/R 刺激下细胞凋亡率增加,选择性抑制Drp1 后Caco-2 细胞凋亡率少于模型组,这可能与直接抑制Drp1减弱了程序性细胞凋亡有关。
有研究显示,Drp1或Mfn2基因的调控在小鼠线粒体衰老及线粒体功能障碍中起着至关重要的作用,敲除小鼠Drp1 可加速线粒体衰老及功能障碍[15]。另有研究表明,Drp1 参与急性肾损伤、脓毒症心肌细胞损伤、缺血再灌注损伤,阿尔兹海默症等多种疾病的发生发展,在以上疾病模型中敲除Drp1或者使用Drp1 抑制剂之后均能起到保护线粒体功能、减轻损伤的治疗作用[16]。本研究发现,Caco-2细胞在H/R刺激下Drp1蛋白表达上调,呈过度分裂状态;而Mfn2蛋白表达下调,线粒体融合受到抑制,细胞处于线粒体动力学失衡状态,提示H/R 损伤的发病机制可能与细胞的线粒体动力学稳态失衡有关。而Drp1 抑制剂预干预H/R 模型细胞后,Drp1 蛋白表达降低,Mfn2 蛋白表达升高,提示H/R 刺激引起的线粒体过度分裂现象得到缓解,线粒体融合增加,线粒体分裂与融合趋于平衡。这提示在肠缺血再灌注损伤中抑制Drp1 有助于维持线粒体动力学稳定,减轻细胞线粒体功能障碍,从而减轻细胞损伤。
综上所述,Drp1 抑制剂可减轻肠黏膜上皮细胞缺血再灌注损伤,其机制可能与改善线粒体功能障碍,减少细胞凋亡有关。然而,Drp1 调控线粒体功能的具体机制仍有待进一步的研究,后续仍需要进行动物实验来验证以上结论。
