乳源外泌体对微生物的作用
2024-02-23赵紫涵谭楚敏吴希阳谢秋玲
赵紫涵,谭楚敏,吴希阳,谢秋玲
(暨南大学 广州 510632)
外泌体(Exosomes)是细胞外囊泡(EVs)的一个重要类别,其直径约30~150 nm,也称为小细胞外囊泡(sEVs)[1]。外泌体存在于乳汁及其它体液中,包括羊水、血液、恶性腹水、唾液和尿液等[2]。早在1971 年,对牛乳的脱脂乳进行超速离心时就观察到富含囊泡的分离物,其具有淡黄色可溶层的特征,位于坚硬的酪蛋白颗粒之上,被称为“绒毛层”[3]。2007 年,Admyre 等[4]首次证明人初乳和成熟乳中的囊泡分离物具有典型的外泌体特征,且具有免疫潜力。此外,外泌体还被发现存在于其它许多物种的乳汁中,包括奶牛[5]、水牛[6]、猪[7]、山羊[8]和马[9]等。乳外泌体被认为是调节母亲和哺乳期婴儿之间细胞通讯不可或缺的信号体,它通过功能性物质(如miRNA、mRNA、DNA 和蛋白质)参与细胞间的通讯,能将其物质传递给特定的受体,在细胞间的信息传递和免疫功能中发挥重要作用[10]。
1 外泌体
1.1 外泌体的形成过程
乳外泌体主要来源于乳腺上皮细胞、免疫细胞和乳腺干细胞中的不同细胞群[11-13],通过一系列调节过程而形成,这些调节过程可以概括为“内吞-融合-分泌”(图1)。最初,质膜上的小泡向内出芽(内吞作用),小囊泡相互融合形成早期内体,随后逐渐转变为成熟的晚期内体。这些晚期内体膜多处凹陷并向内出芽形成细胞腔内囊泡(Intraluminal vesicle,ILVs),富含ILVs 的内体称为多囊泡内小体(Multivesicular endosome,MVEs)。MVEs有2 个去向:一部分MVEs 与溶酶体融合,使其内容物发生降解后排出细胞外;另一部分MVEs 与细胞膜融合,释放ILVs 到细胞外,这些分泌的囊泡即为外泌体[14-15]。

图1 外泌体分泌过程[16]Fig.1 Release of exosomes[16]
1.2 外泌体组分
作为一种重要的EVs 类型,外泌体能保护不稳定的内含物免受降解,并在几乎所有组织中通过外泌体的内吞作用为物质的摄取提供一种载体[17]。乳外泌体及其内含物会因物种来源、品种、饮食和健康状况而发生改变[6,12,18-20]。根据ExoCarta外泌体数据库(http://www.exocarta.org),目前已知约有9 769 种蛋白质,3 408 种mRNA,2 838 种miRNA,以及1 116 种脂类与外泌体相关[21]。
乳外泌体蛋白质的含量和种类是高度多样的,不仅在不同物种之间,而且在同一物种的不同个体之间也存在差异。Samuel 等[19]采用非标记定量蛋白质组学技术分析了不同泌乳时期牛乳外泌体蛋白质组的变化,通过功能富集分析发现:相比成熟乳,牛初乳外泌体中富含与免疫应答和生长相关的蛋白质。猪乳外泌体含有多种蛋白质,如表皮生长因子、结缔组织生长因子、血小板衍生生长因子以及肌生长抑制素等,这些蛋白在控制细胞增殖方面发挥作用[20]。乳外泌体中还观察到具有潜在免疫调节作用的乳蛋白,如TGF-β[22-23]、酪蛋白、乳球蛋白和乳铁蛋白[9,24-25]。牛乳外泌体中就发现了参与血小板/中性粒细胞脱颗粒、抗菌肽和补体激活的蛋白质,可能调节受体的免疫系统以指导婴儿的生长,以及在修复和发育方面发挥潜在作用[19]。
早在1955 年和1993 年就发现了牛奶外泌体中RNA 的存在[26-27],其中miRNA 最受关注。miRNAs 是人类和其它哺乳动物中所有类型细胞之间的长距离基因调节因子,对健康和疾病有巨大影响,体循环中的microRNA 可以调节免疫系统,影响癌症的发生发展以及大脑的发育和功能,并为机体与肠道微生物区系的沟通建立了桥梁。首次关注牛奶microRNAs 的研究在2010 年被报道,并开启了一个关于牛奶miRNAs 研究的非常新的研究领域[5]。单位体积奶中发现了含有高浓度的miRNA[2]。本团队在牛、羊及人这3 种来源的乳汁外泌体中均检测到大量miRNA,且不同乳源外泌体miRNA 谱之间往往存在一定程度的重叠。乳miRNA 的表达与乳腺状况有关,包括感染、癌症、怀孕和哺乳状况,因此乳miRNA 可以用作疾病诊断和预后的潜在生物标志物,例如在牛奶中高度稳定的bta-miR-223,其表达水平受到乳腺状况的影响可作为监测乳腺感染状况的良好指标[22]。同时还有大量研究发现乳源外泌体中有大量与免疫调节相关的miRNA[28],例如人乳外泌体中富含能调节T 细胞的miRNA 和诱导B 细胞分化的miR-181 和miR-155[28-30],还有研究表明乳外泌体中的miR-148a 是牛乳中表达最丰富的miRNA,也是先天免疫反应、小鼠树突状细胞中抗原呈递的调节剂[31-32],同时,let-7a 能够通过下调IL-6 水平,调节Th17 细胞的分化[33]。牛乳外泌体和人乳外泌体中部分蛋白及miRNA 组成与功能分析如表1 所示[4,19,28,34-43]。
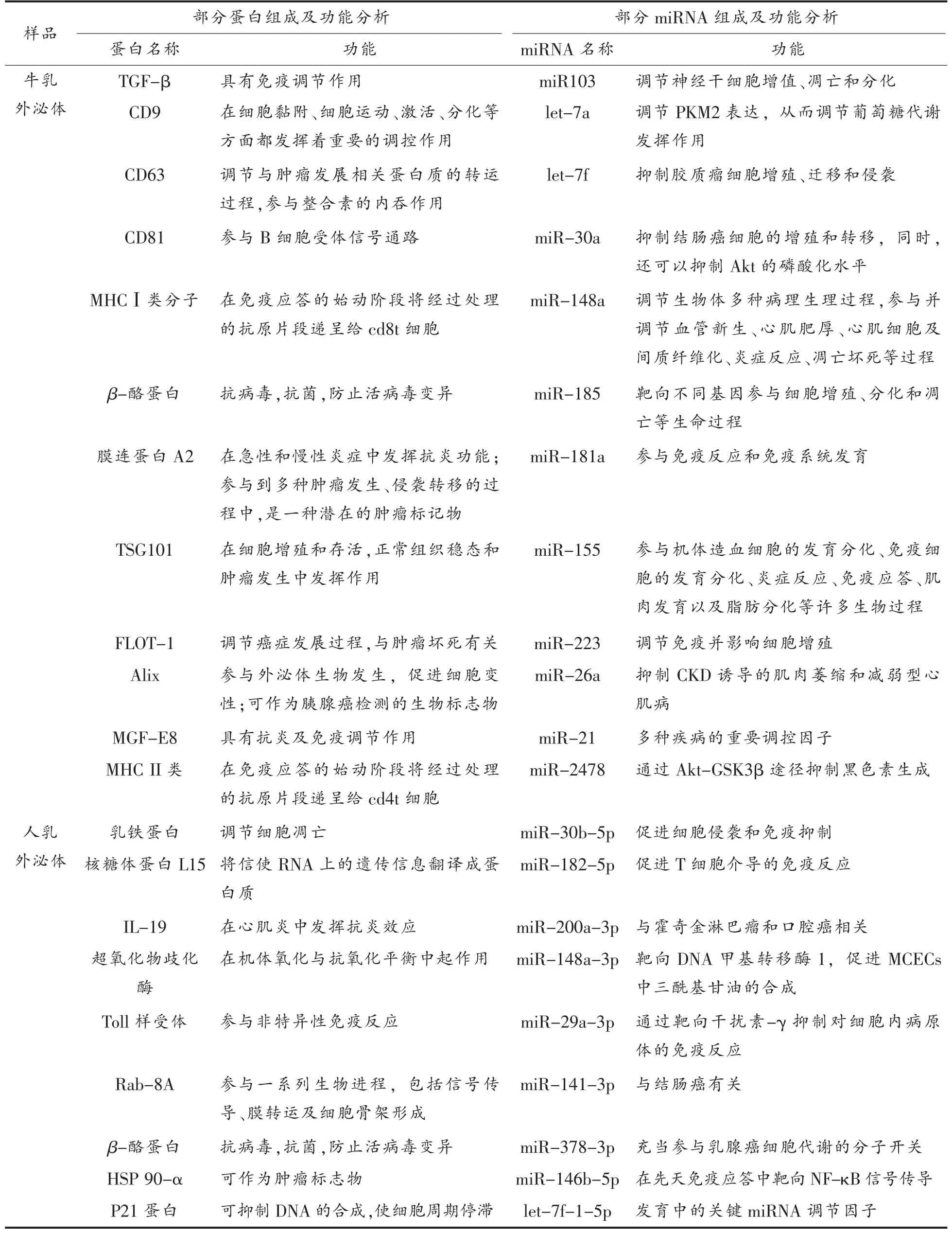
表1 牛乳和人乳外泌体中部分蛋白及miRNA 组成与功能分析Table 1 Analysis of the composition and function of some proteins and miRNAs in bovine milk and human milk exosomes
除蛋白质和miRNA 外,外泌体中还含有DNA 等核酸分子、磷脂酰胆碱和神经酰胺等脂质分子及糖分子,这些成分的存在也与外泌体的生物发生、细胞识别和受体细胞对外泌体的有效摄取有关[44-45]。外泌体的脂质组成主要有磷脂酰胆碱、磷脂酰丝氨酸、鞘磷脂和神经酰胺等物质。其中,胆固醇和鞘磷脂对膜脂筏动态结构域的形成至关重要,脂筏(Lipid raft)在外泌体与靶细胞间的信号传递中发挥重要作用。分布在外泌体膜结构上的脂质可以隔离内容物,从而提高外泌体结构的稳定性,同时也在外泌体与受体细胞的信息交流中扮演重要角色[45]。牛奶外泌体中的糖链主要以唾液酸化及岩藻糖化修饰糖链为主,这些糖链结构既可以作为外泌体的识别位点,也具有一定的抗菌作用[46]。此外,牛乳外泌体中的一种具有Lacdi NAc 结构(F0H5N8S0G0)的N-连接糖链和2 种唾液酸化N-连接糖链(F0H5N3S0G1 和F0H4N4S0G1)也可以作为牛奶来源外泌体的潜在生物标志物用来鉴别牛乳外泌体[46]。也有研究证明牛乳外泌体表面糖蛋白的半乳糖和唾液酸化半乳糖修饰对于非牛物种的外泌体摄取至关重要[47]。
乳中的蛋白质和miRNA 等功能分子被包裹在细胞外囊泡中,由于具有磷脂双分子层的保护,使得乳外泌体中的物质能抵御高温、RNase 消化[28,48-49]、低pH 值[48-49]和体外胃肠道消化[2,43,50]等恶劣条件。有研究对当前所有公开可用的来自194个物种的34 612 个miRNA 进行生物信息学分析,推断各类外源miRNA 进入人体循环的可能性,345 个饮食来源的miRNA 被预测为高度可运输序列,其中有117 个与其在人类中的同源物具有相同的序列,73 个已知与外泌体相关[51]。据报道,牛乳和猪乳中的miRNA 在人、猪和小鼠中是生物可利用的[7,51-52],商业巴氏杀菌牛奶中的乳源性miRNA 被成年人大量吸收[52]。在饮用牛乳后的人体血浆中通过miRNA 测序分析也验证出9 个牛乳来源的miRNA[51]。
乳源外泌体中的功能物质能被肠上皮细胞吸收,并通过跨上皮转运到达血液循环。体外试验表明,乳源外泌体可以抑制与肠道增殖有关的P53基因的表达[7]。研究发现乳源外泌体能够显著促进CDX2、IGF1R 和增殖细胞核抗原的表达,证明了乳源外切体可以促进肠道细胞增殖和肠道发育。牛乳源细胞外小泡(BMEV)在体外能够被小鼠巨噬细胞RAW264.7 细胞、脾细胞和肠道细胞IPEC-J2 摄取,并能降低脾细胞中血清MCP-1 和IL-6 的水平[50]。Baier 等[52]发现人类乳汁外泌体能够在消化后存活,并被肠道细胞摄取进入细胞核,可能通过外泌体miRNA 影响基因表达或进入婴儿的体循环,发挥组织特异性免疫保护和发育功能。此外,一些研究已经证明婴儿配方奶中缺乏生物活性miRNA 和乳源性EVs[53-54]。有人推测,配方奶中乳源性EVs 和相关内含物的缺乏可能会导致婴儿代谢和免疫程序受损[24,55]。
2 外泌体与病原微生物感染的关系
外泌体能够介导细菌-宿主之间的相互作用,参与传染性疾病、炎症性疾病和肿瘤等多种疾病的病理过程,从而促进健康或引起各种疾病[56]。病原菌感染可诱导宿主细胞产生外泌体,致使外泌体内的组分发生变化,包括蛋白质和核酸分子,从而影响和调节机体产生炎症反应及免疫反应。
幽门螺杆菌Hp 感染的巨噬细胞所释放的外泌体中miR-155 显著上调,这些携带miR-155 的外泌体被其它巨噬细胞摄取并内化后,可调节巨噬细胞中多种促炎介质和炎症相关蛋白的表达,如TNF-α、IL-23 和IL-6 等炎症相关因子表达上调,而炎症信号通路蛋白MyD88、NF-кB 表达下调,这表明外泌体miR-155 可通过参与炎症反应调节Hp 感染巨噬细胞的免疫反应。用荷载miR-155 的外泌体在体外培养幽门螺杆菌,幽门螺杆菌的生长受到显著抑制。体内、外试验表明,miR-155 通过调节细胞的炎症反应来促进巨噬细胞抑制或杀死幽门螺杆菌,以防止幽门螺杆菌感染引起的胃炎[57]。体内试验中,用荷载miR-155 的外泌体治疗幽门螺杆菌感染小鼠,观察到小鼠胃上皮组织的炎症反应显著降低。感染结核分枝杆菌(Mycobacterium tuberculosis,M.tb)的巨噬细胞会释放携带结核分枝杆菌病原体相关分子模式(Pathogen-associated molecular patterns,PAMPs)的外泌体,包括分枝杆菌蛋白、脂类和核酸。这些携带结核分枝杆菌PAMP 的EVs 可被受体细胞上的模式识别受体(Pattern recognition receptors,PRRs)检测到,PRRs 可以诱导和调节细胞因子的产生,以激活或减弱细胞反应,进而调控机体免疫系统:一方面,感染结核分枝杆菌的巨噬细胞释放的外泌体携带有结核分枝杆菌抗原,可以促进先天性和获得性免疫反应的激活;另一方面,外泌体作为结核分枝杆菌病原体相关分子模式(PAMPs)的携带者也可以抑制受感染细胞以外的宿主免疫反应[58-59]。
外泌体还可通过TLR2 依赖的途径调控固有免疫应答。TLR2 主要识别革兰氏阳性菌细胞壁的肽聚糖,也可识别脂蛋白和脂多糖等生物分子。TLR2 能够识别外泌体所携带的细菌特异性成分或其代谢中间产物,从而促进免疫识别和炎症反应。巨噬细胞在病原微生物感染刺激下产生的外泌体含有病原微生物脂多糖和脂蛋白等成分,可以激活TLR2,影响未感染的巨噬细胞诱导细胞因子的表达[60]。结核分枝杆菌中的RNA 可通过结核分枝杆菌SecA2 依赖的途径递送到巨噬细胞来源的EVs 中,由感染结核分枝杆菌的巨噬细胞释放的EVs 刺激宿主RIG-I/MAVS/TBK1/IRF3 RNA传感途径,导致受体细胞产生I 型干扰素。这些EVs 还通过依赖RIG-I/MAVS 的途径促进与LC3相关的结核分枝杆菌吞噬小体成熟,从而导致细菌死亡率增加[61]。
母乳外泌体中含有丰富的蛋白质,参与免疫和炎症途径的调节,能够影响局部对细菌攻击的免疫反应[34]。葡聚糖硫酸钠(DSS)诱导的结肠炎导致肠道微生物群失衡,包括致病细菌的增加和肠道微生物多样性的减少。致病菌丰度的增加激活跨膜模式识别受体如Toll 样受体(TLR),这些模式识别受体介导中枢信号级联反应的激活,包括NF-κB,Akt 和MAPK 途径。此外,微生物群(非致病菌)及微生物群代谢物(如短链脂肪酸)可以调节Treg/Th17 细胞的NF-κB 活化和动态平衡,从而防止过度炎症。在UC 小鼠模型中口服mEV 可重塑小鼠肠道微生物群以恢复肠道免疫力。相比对照组,DSS 处理组小鼠肠道菌群中肠球菌科(Enterococcaceae)和脱硫弧菌科(Desulfovibrionaceae)分类分支显著增加,在EV 处理组中这些致病细菌丰度无显著变化,而一种益生菌阿尔曼氏菌(Akkermansia)丰度显著增加。组织切片观察发现,相比DSS 处理组,口服mEV 防止了结肠缩短并有效抑制肠道炎症细胞的浸润和组织纤维化[34]。牛奶外泌体蛋白质组学的数据结果,通过GO 富集分析和KEGG 通路分析显示,牛奶EV 中所包含的大多数蛋白质作用于细胞胞内成分及参与生物反应过程,有多种蛋白质(如MHC class I antigen,HSPB1,NOD2 等)参与免疫相关反应以及炎症信号通路,包括NOD 样受体信号通路,Toll样受体信号通路和NF-κB 信号通路,而这些通路也存在于机体对细菌的免疫反应中[34]。
3 外泌体对微生物的作用
只有较少针对外泌体对微生物直接作用的研究,展示了不同来源的外泌体,如肠源性外泌体、乳源外泌体、尿液外泌体等从不同方面直接作用于微生物,调节微生物细胞内一系列生理生化活动,进而影响微生物的生长代谢及黏附等过程。例如有研究发现血清EVs 的存在对于细菌引发的免疫反应产生影响,而且可能存在菌种差异。与乳酸菌不同,双歧杆菌诱导的TLR2/6 反应在血清EV存在下会被抑制。血清EVs 可以稍稍提高DC 细胞对于乳酸菌的吞噬,而对于双歧杆菌的吞噬在缺乏EVs 时几乎全部消失。EVs 可能在细菌聚集中发挥作用,这意味着EVs 与细菌之间存在直接的相互作用,并可能是通过影响细菌的黏附和清除方式而起作用[62]。
另一项研究确定,尿外泌体作为先天免疫效应器影响致病性和共生性大肠杆菌的生长,并导致细菌溶解[63]。该研究表明,在酸性pH 条件下,尿液外泌体可导致大肠杆菌的裂解和死亡。通过深入的蛋白质组分分析证明,正常的人尿外泌体富含天然免疫蛋白,包括已知具有抑菌作用(如粘蛋白-1、纤维连接蛋白和CD14)或杀菌作用(如溶菌酶C、钙保护素和真皮杀菌素)的蛋白质,以及那些作为微生物受体或与细菌表面分子结合的蛋白质。作者还通过进一步试验证明尿液外泌体能够有效地抑制致病性和共生性大肠杆菌的生长并诱导细菌裂解。同时,该研究还证明尿液外泌体对细菌的杀灭作用必须依赖于外泌体结构的完整性。
Yu 等[64]将大肠杆菌K-12 MG1655 和植物乳杆菌WCFS1 分别与乳源外泌体M-exo(Milk-derived exosomes)、脂肪来源外泌体Asc-exo(Adipose-derived stem cell exosomes)和从椰子水中提取出的纳米颗粒(Nanoparticles extracted from coconut water)共培养,发现3 种类型胞外体颗粒都能进入细菌细胞内(图2),并影响细菌生长,同时会影响细菌生长相关基因的表达。例如已有研究表明yegH,ptsG 和rpoC 三个基因可能参与了细菌生长代谢并影响细菌的黏附和入侵[65-67]。当用M-exo 或ASC-exo 处理MG1655 时,yegH 和ptsG表达水平上调,而rpoC 表达水平下调。通过生物信息学进一步分析,yegH,ptsG 和rpoC 是某些miRNAs(包括miR-21,miR-497 和miR-395)可能的靶基因,因此推测有可能是共培养的外源EVs 通过miRNAs 的转移而改变了细菌的基因表达,进而影响细菌的生长代谢过程。
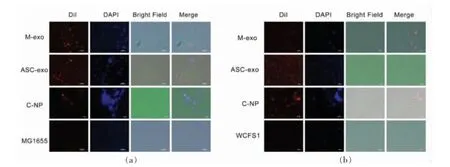
图2 细菌对胞外囊泡的摄取[64]Fig.2 Extracellular vesicles are taken up by bacteria[64]
Lei 等[68]证明了从柠檬果实中压榨得到的柠檬汁中的外泌体样纳米颗粒(LELNs)可以增强乳酸杆菌对胆汁的耐受性。Msp1 和Msp3 是鼠李糖乳杆菌(LGG)的外分泌蛋白,研究表明,LENN 通过限制Msp1 和Msp3 的表达量来增强LGG 对胆汁的耐受性。Msp1 和Msp3 都含有细胞壁肽聚糖水解酶结构域,并且Msp1 已被证明可以水解细胞壁衍生的肽聚糖,因此Msp1 和Msp3 表达量的降低,可以降低胆汁对LGG 细胞膜的可及性,使得胆汁更不易于作用于细胞膜,从而增强LGG 对胆汁的抗性。
我国学者也对牛乳外泌体对动物双歧杆菌F1-3-2 的生长影响进行了研究,发现牛乳外泌体对动物双歧杆菌的生长具有明显的促进作用,同时也能够提高动物双歧杆菌F1-3-2 对肠胃环境的耐受性和黏附性能[69]。
本团队研究了牛乳、羊乳及人乳3 种乳源外泌体对大肠杆菌生长的影响,分别用不同浓度的外泌体在体外共培养大肠杆菌,试验表明羊乳和人乳外泌体对大肠杆菌的生长均具有不同程度的抑制作用,其中人乳外泌体对大肠杆菌生长的抑制作用最为明显,羊乳外泌体次之。此外,不同浓度的外泌体对大肠杆菌生长的抑制程度也有所差异,在人乳及羊乳外泌体处理组中,均发现较高浓度的外泌体对大肠杆菌生长抑制作用更为显著。
4 外泌体对肠道菌群的作用
肠道菌群对于人体健康和疾病治疗的作用近年来受到了很大关注,研究发现肠道菌群不仅可以调节蛋白质、糖类、脂肪酸等营养物质的吸收和代谢,还有助于促进免疫系统的发育,影响肠道功能和正常发育[70]。饮食会影响到肠道菌群的种类和生长,饮食中所包含的外泌体是否也会影响到肠道菌群呢?在人乳和其它物种的乳汁中,包含丰富的与免疫相关的miRNA 和其它功能物质,因而外泌体具有免疫调节、促进肠道上皮细胞增殖等生理功能[7,28]。不仅如此,口服植物来源的外泌体被发现可以改善小鼠的肠道菌群,增强小鼠免疫力[71]。
Zhou 等[72]对C57BL/6 小鼠分别饲养牛乳外泌体缺乏(Exosome and RNA depleted,ERD)或牛乳外泌体充足(Exosome and RNA-sufficient,ERS)的日粮,通过收集小鼠盲肠内容物,对盲肠微生物菌群进行16S rRNA 高通量测序,发现菌群中3 个门、7 个科和52 个操作分类单元(Operational taxonomic units,OTUs)存在显著差异。例如,15 和47 周ERS 小鼠的软壁菌门的丰度是ERD 小鼠的3 倍,7 和47 周ERS 小鼠毛螺菌科的4 个OTUs 丰度高于ERD 小鼠的2 倍。这表明,乳外泌体可跨物种改变小鼠肠道菌群组成,参与肠道菌群与宿主间的相互作用。
溃疡性结肠炎(Ulcerative colitis)是一种常见的肠道疾病,肠道菌群失调被认为是引起结肠炎的关键因素[34,73]。给葡聚糖硫酸钠(Dextran sodium sulfate,DSS)诱导的溃疡性结肠炎的小鼠灌胃牛乳外泌体(mEVs)后发现,与对照组相比,DSS诱导的结肠炎患者肠道微生物多样性降低,而经MEVs 干预后,肠道微生物多样性有所恢复。同时发现在DSS 处理的小鼠中,表现出肠道杆菌枯竭,而变形杆菌和韦氏微生物门的相对丰度显著增加,经MEVs 干预可以部分恢复其丰度,尤其一种益生菌阿尔曼氏菌在MEVs 干预组的小鼠中显著增加。这些结果表明,MEVs 可以在DSS 诱导的结肠炎中塑造肠道微生物区系,并且MEVs 对不同菌种的作用也有所差异[34]。在类似的研究中,Benmoussa 等[74]用DSS 诱导小鼠结肠炎模型,引起小鼠粪便中毛螺菌科和瘤胃菌科丰度的下降,采用不同的离心速度获得了2 种牛乳胞外小囊泡(35 000×g 离心获得的P35K 和100 000×g 离心获得的P100K),两种胞外囊泡均能一定程度上调节肠道菌群,恢复肠道屏障和补充粘蛋白的分泌。
Tong 等[75]用不同浓度的牛乳外泌体对C57BL/6 小鼠进行为期8 周的处理,以研究牛乳外泌体对小鼠肠道微生物区系组成的影响。与对照组(PBS)相比,mEV 处理组小鼠肠道菌群在科、属、种3 个水平上均存在显著差异,证明了mEV 可以调节宿主肠道微生物群。Yang 等[76]研究了源自人胎盘间充质干细胞的外泌体(PMSC-Exos)在心肌梗死(MI)中的作用,研究过程中发现,与MI 模型组相比,PMSC-Exos 干预组通过增加拟杆菌、变形杆菌、疣状结肠炎、放线菌、拟杆菌、双歧杆菌的相对丰度以及降低厚壁菌丰度,来显著调节肠道微生物群落组成。此外,与MI 组相比,补充PMSCExos 也显著提高了肠道微生物群群落代谢物SCFAs(丁酸、异丁酸和戊酸)产量。相关性分析表明,肠道微生物群、微生物SCFAs 和MI 炎症之间存在密切关联。在关于外泌体对骨质疏松症影响的研究中发现,骨质疏松症诱导小鼠的肠道微生物群落中乳酸菌群落减少,然而通过外泌体摄入可以有效恢复肠道微生物群落组成[77]。
外泌体调节肠道微生物的机制虽尚待深入探索,但人们推测外泌体中包含的功能物质如miRNAs 可能起到重要作用。Liu 等[50]在小鼠粪便中检测到大量的miRNA,同时也发现了广泛的外泌体的存在,而在从小鼠粪便中分离出的外泌体中同样携带众多的miRNA,miRNA 谱对比分析显示在粪便中丰度较高的miRNA,在外泌体中也大量存在。作者以厌氧具核梭杆菌(Fusobacterium nucleatum)和兼性厌氧大肠杆菌(Escherichia coli)两种肠道细菌为研究对象,通过生物信息学预测分析发现每个细菌核酸序列都被预测为许多miRNAs 的靶标。用这些miRNAs 的模拟物在体外培养厌氧具核梭杆菌和兼性厌氧大肠杆菌,发现hsa-miR-515-5p 促进了厌氧具核梭杆菌的生长,而hsa-miR-1226-5p 促进了大肠杆菌的生长。以上试验结果表明miRNAs 能够直接影响细菌的生长且这种作用具有序列特异性。进一步研究观察到miRNAs 可进入细菌,且在大肠杆菌培养过程中观察到miRNA 在细菌中的动态积累。因此可以合理推测外泌体中的miRNA 可以转移到肠道微生物体内,从而影响微生物的生长与代谢,同时,不同的miRNA 对不同的细菌具有序列特异性,因而对于不同的种群会产生不同影响,进一步调整肠道菌群的组成。
5 展望
目前,外泌体对于微生物作用的研究还相对较少,虽然已经有研究证明了外泌体影响肠道微生物群的组成及菌种丰度,外泌体组分包括miRNA 和蛋白质等对微生物作用的相关研究也已取得一定进展,然而外泌体内富集的信息分子成分及其功能还有待进一步阐明。此外,关于外泌体作用于微生物的具体机制仍有待深入研究。外泌体对微生物作用的研究有着广阔的应用前景,相信随着研究深入,能更好地阐明外泌体对微生物作用的机制,并在临床实践领域发挥其价值。
