面向肿瘤微环境的响应型表面增强拉曼光谱探针的研究进展
2024-01-24张泽东董建国张裕英
张泽东,董建国,张裕英
(南开大学 医学院,天津 300071)
恶性肿瘤的发病率和死亡率逐年上升,严重威胁着人类的健康[1]。肿瘤微环境(TME)是肿瘤发生发展的“土壤”,由细胞和非细胞成分组成。其中,细胞成分包括肿瘤细胞、浸润性免疫细胞(T细胞、巨噬细胞、树突状细胞、骨髓源性抑制细胞等)和基质细胞(癌症相关成纤维细胞、内皮细胞、血管上皮细胞等);非细胞成分包括各种细胞因子、生长因子、趋化因子和细胞外囊泡等[2-3]。在肿瘤生长与恶化的过程中,往往伴随着pH 降低、氧化应激增强、乏氧、谷胱甘肽(Glutathione,GSH)浓度增大及某些酶发生过表达等特性的微环境。TME 是一个高度动态的、复杂的环境,其与多步骤肿瘤发生过程一起演变[4]。近年来,人们越来越认识到这个生态系统在肿瘤进展和转移的过程中起着至关重要的作用[5]。同时,这些因素也为癌症的诊断与治疗提供了更多可能的途径。
在过去的几十年里,表面增强拉曼光谱(SERS)分子成像取得了重大进展,在生物医学和临床转化中的应用引起了广泛关注[6]。SERS是一种利用金属纳米结构的局域表面等离子体共振现象来放大拉曼光谱信号的强大技术,能够呈现分子的指纹图谱信息。SERS具有高灵敏度、高特异性和抗生物干扰等突出优点,非常有利于复杂生物基质中的生物标志物检测[7-9]。与人体正常内环境相比,肿瘤微环境具有弱酸性、乏氧、活性氧水平上升和某些酶的表达上调等生理特性。利用此特征,研究者们在金属纳米粒子表面修饰上对肿瘤微环境敏感的拉曼信号分子制备成响应型SERS 探针(图1A),通过谱峰位置或强度的变化针对这些区别于正常内环境的生理特征进行鉴别(图1B)。本文总结了响应型SERS 探针应用于肿瘤微环境检测的最新进展。

图1 表面增强拉曼光谱探针的制备(A)及应用于肿瘤微环境检测(B)示意图Fig.1 Scheme of fabrication of SERS probes(A) and their applications in detection of TME(B)
1 针对肿瘤酸性微环境的检测
过去几年,越来越多的证据表明,与正常的组织相比,TME 在血管生成、有氧呼吸以及代谢状态等方面有显著不同。与正常细胞通过氧化磷酸化获取能量的方式不同,肿瘤细胞因为脉管系统分布不均匀,供氧量不足,所以只能利用无氧糖酵解产生的能量(也称Warburg效应)。因此,肿瘤细胞会产生大量的乳酸、氢离子以及二氧化碳,从而导致细胞外TME酸化,pH值在6.5~6.9之间,使肿瘤转移的风险增加,治疗难度加大[10-12]。基于此,研究人员设计了pH 响应型SERS 探针对细胞和肿瘤微环境中的pH进行检测分析,也有一部分研究对酸性微环境刺激纳米药物释放体系进行跟踪监测(表1)[13-29]。

表1 pH响应型SERS探针文献总结Table 1 Application of SERS probes in detection of pH
1.1 细胞外和细胞内pH检测
细胞外pH 值(pHe)是许多细胞过程和疾病病理的重要化学因子。基于SERS 的pHe 检测可作为一种重要的原位成像分析方法,用于长期跟踪pHe的变化,以了解单细胞水平上的细胞过程。Xu等[13]在组装有AuNPs的玻璃基底上修饰pH 敏感分子4-巯基吡啶(4-Mercaptopyridine,4-MPY)用于细胞凋亡过程中的原位pHe监测,通过4-MPY 的两个SERS 特征峰强度比值(I1610/I1575)的变化可以识别不同的pH 值(图2A)。他们发现,在培养基中加入转化生长因子-β(Transforming growth factor-β,TGF-β)后,pHe 先呈快速下降趋势,随后缓慢下降,直至细胞功能完全丧失,细胞内外pH 值趋于相近。Skinner 等[14]将pH 响应拉曼报告分子4-巯基苯甲酸(4-Mercaptobenzoic acid,4-MBA)修饰在金包覆聚氨酯电纺纳米纤维表面,开发了一种用于实时测量pHe 的SERS 传感器。通过在该SERS 传感器上培养HepG2/C3A 细胞,并在细胞-纤维界面处测量pHe,发现SERS 探针可以区分由于不同代谢活动导致的局部pH 变化。随后,研究人员用非特异性蛋白激酶抑制剂星形孢菌素(Staurosporine,STS)处理HepG2/C3A 细胞,发现细胞的形态学变化能够指示细胞凋亡,同时伴随着局部pHe 的增加。微囊化细胞在多种疾病的治疗方案中取得了广泛的进展,特别是在保护移植细胞免受免疫排斥的方面。然而,由于缺乏合适方法跟踪监测体内微囊的位置、稳定性和移植后细胞活力和增殖行为的改变,细胞治疗仍然存在一些挑战。Zhang等[15]制备了AuNS-4MBA-PAH SERS 探针放置在微囊细胞外层,用于封装细胞的微环境成像和局部pH变化的感知,进而能够以非侵入性的方式提供有关微囊化细胞死亡情况的信息。

图2 SERS探针应用于肿瘤微环境中pH检测示意图Fig.2 Scheme of SERS probes for pH detection
细胞内pH 值(pHi)是细胞生理和病理状况的关键指标,利用SERS对pHi进行可视化监测对了解细胞过程具有重要的作用。然而,传统的二维成像分析往往不能反映整个细胞体积内的变化。因此,Zhang等[16]设计了一种pH响应的SERS 探针(AuNS-4MBA-PA),在二维和三维尺度对细胞内的pH值进行可视化监测(图2B)。阳离子聚合物聚L-精氨酸(Poly-L-arginine,PA)作为SERS探针的最外包覆层能够使探针的细胞内化效率和生物相容性得到显著提高。他们以乳腺癌细胞系MCF-7为模型,通过二维SERS成像观察了纳米探针在内吞过程中局部pH的变化情况,并通过三维 SERS成像实验,观察到探针在细胞核周边位置积聚,同时所在位置的局部pH 降低。SERS 探针与细胞共孵育后,部分探针被细胞内吞,另一部分黏附于细胞膜或细胞培养皿上,采用光学显微镜难以区分探针的确切位置。针对此现象,Bai 等[17]利用一种不能穿透活细胞细胞膜的刻蚀液对样品进行处理,细胞外的探针被刻蚀失去SERS 信号,而被细胞吞入的探针仍能保持较高的SERS 信号,因此能够更加准确地对pHi 进行检测分析。溶酶体的酸性环境在细胞的多种功能中起着重要作用,溶酶体pH值的异常变化可引起包括肿瘤在内的多种疾病。由此,Zhang 等[19]设计了一种基于AuNPs-i-motifs 的SERS 探针对溶酶体内的pH 变化进行动态监测。在溶酶体成熟过程中,探针的质子化会导致富含胞嘧啶的单链DNA(Single-stranded DNA,ssDNA)序列构象发生变化,从而引起AuNPs聚集产生热点使报告分子的拉曼信号显著增强。该探针可以指示溶酶体成熟过程中pH 的动态变化,这为研究溶酶体功能失调细胞的病理生理事件提供了新的工具。
虽然由金属纳米粒子构成的SERS 探针具有很高的pH 灵敏性,但由于纳米粒子在经细胞胞吞后大部分存在于溶酶体中,因此能够反映的细胞内pH 信息是有限的,并且在细胞中检测到的pH 值与其生理状况之间的关系仍不明确。Zhang 等[20]提出了采用一种金沉积银纳米线(Au-dep AgNWs@MBA)SERS探针进行特定位点的pH 传感,将该探针插入活的HeLa 细胞的细胞质或细胞核中,能够以高时空分辨率和灵敏度研究细胞质和细胞核的pH 变化(图2C)。此外,还应用该探针分别监测了CoCl2和顺铂治疗前后HeLa 细胞内细胞质和细胞核pH 的变化。Zhao 等[21]报道了一种利用嵌段共聚物刷层模板和配体交换来制造高重复性和稳定性的SERS 活性纳米纤维的策略。该SERS 探针具有低侵入性、高灵敏度以及高时空分辨率能力,能够检测乳腺癌细胞的pHi 和pHe 梯度。检测发现MCF-7 细胞内的pH 平均值为7.26 ± 0.27,还观察到与单层培养MDA-MB-231 细胞不同间距的地方pH 梯度分布广泛(ΔpH=0.1~0.9),表明了肿瘤细胞的异质性。Guo 等[22]开发了一种4-MBA 修饰SERS 纳米管,通过优化纳米管的几何形状和尖端AuNPs 的表面密度,可在最小的损伤下对单个活细胞进行长期可靠的细胞内pH 分析。随后,他们改变细胞外pH环境,比较癌细胞和正常细胞细胞质pH值的变化,结果表明宫颈癌HeLa细胞相比于成纤维细胞能够更好地抵抗pHe 变化,适应弱酸性环境。同时准确检测pHi 和pHe 对于研究癌细胞复杂的生理活动和探索pH 相关的治疗机制至关重要。Fang 等[23]开发了4-MBA@AgNW 作为pH传感SERS探针。将该探针应用于二维和三维培养肿瘤细胞的原位pH检测,可以更好地了解pHi和pHe之间的差异。实验结果表明,三维培养多细胞球(Multicellular cancer spheroid,MCS)的pHi和pHe 均低于二维单层培养肿瘤细胞,这可能是由于 MCS内部细胞缺氧所致。此外,通过4MBA@AgNW 也能准确检测在顺铂处理期间癌细胞pHi 和pHe 值的变化,这将有助于深入了解pH 相关的病理过程和治疗机制。
近年来,pH 响应型SERS 探针已经开始应用于术中影像导航。Yang 等[24]将pH 响应SERS 探针Ag@MPY 应用于快速识别胶质瘤边界。通过在肿瘤组织表面构建纯水滴阵列,使组织间液扩散到水滴中,然后将水滴转移到SERS基底上,采用便携式拉曼光谱仪获得SERS光谱(图2D)。由于肿瘤区域的酸化特性,他们可以通过所检测组织的不同pH值准确区分肿瘤组织与正常组织的界限。该技术操作方便,能够准确、无创、快速地测定局部pH值,从而最大限度地切除肿瘤组织,同时减少对正常组织的损害。与此类似,Jin 等[25]建立了一种智能SERS 导航系统用于描绘胶质瘤的酸性边缘。他们通过深度学习模型对SERS 芯片采集的拉曼光谱进行自动处理,能够加快描绘肿瘤切除床的pH 分布图,并在动物模型的肿瘤边缘和胶质瘤患者的切除组织中证实了酸度与癌细胞密度和增殖水平相关。与目前临床实践中使用的常规方法相比,SERS 系统引导手术切除后,动物模型的总体生存率显著提高。该SERS检测系统有望进行临床转化,将来应用于酸性边缘引导的浸润性实体瘤切除手术。
1.2 pH响应药物递送系统的跟踪检测
卡铂(Carboplatin,CBP)是卵巢癌治疗中最常用的细胞毒性药物。Potara 等[26]设计了一种集化疗、pH传感和多模态追踪功能为一体的CBP-4MBA-chit-AgNTs SERS 探针。他们利用暗场和微分干涉差显微镜研究了CBP-4MBA-chit-AgNTs 在NIH∶OVCAR-3 卵巢癌细胞内不同层面的摄取分布情况,并通过双光子激发荧光寿命成像和共聚焦拉曼显微镜进行示踪分析,对探针所在位置的pH 分布进行检测。同时,体外细胞增殖实验清楚地表明所制备的多功能SERS探针能够有效抑制癌细胞生长。
实时监测药物释放的性能是评估载药系统药效的关键。Huang等[27]提出了一种新型的pH 响应纳米载药系统,用于通过SERS 实时监测药物释放和进行光化学治疗。他们合成了具有高SERS 活性和稳定性的GO-Fe3O4@Au@Ag-MPBA-DOX 纳米复合材料,同时涵盖实时SERS 监测、磁共振(Magnetic resonance,MR)成像和pH 响应药物释放的功能。在这种纳米复合材料中,沉积在氧化石墨烯(Graphene oxide,GO)纳米片表面的Fe3O4@Au@Ag NPs-4MPBA 通过硼酸基团与阿霉素(Doxorubicin,DOX)结合形成pH 敏感的SERS探针。以人乳腺癌细胞系MCF-7为模型,研究了SERS探针在癌症治疗中的监测性能,结果表明SERS光谱能监测DOX释放,化疗联合GO介导的光热疗法能有效地抑制癌细胞和肿瘤异种移植物,且无明显副作用。该纳米复合载体系统具有良好的生物相容性、优异的SERS活性和稳定性、较高的光热转换效率、活跃的肿瘤靶向性和灵敏的近红外及pH响应药物释放能力,有利于癌症的高效光化学治疗。Zhang等[28]采用“点击化学”的方法制备了含有PEG和两种DNA的Janus纳米颗粒(JNPs)。在腺嘌呤核苷三磷酸(Adenosine 5’-triphosphate,ATP)或酸性条件下,所制备的JNPs可形成二聚体,生成的“热点”有利于癌细胞的原位SERS检测和成像分析。作为pH传感器,SERS信号随pH 值从8.0到4.0的降低而增加;同时,JNPs另一侧负载的药物和光敏剂产生化疗和光动力治疗的协同抗肿瘤作用。体外和体内实验验证了所制备的JNPs具有良好的抗癌作用。在纳米颗粒上修饰核蛋白核酸适配体能提高选择性检测和进行靶向治疗。此外,Managò 等[29]描述了能在结直肠癌细胞中实时监测Galunisertib(LY2157299,LY)释放的DNP-AuNPs-LY@Gel 纳米复合物。从纳米复合物中释放LY 是时间和pH 依赖的,在生理pH 值(7.4)时,明胶层紧密折叠,药物保留在纳米系统中。相反,在酸性环境(5.5)下明胶分子发生降解,释放LY。在结直肠癌CRC 细胞中,由于外部微环境中乳酸的积累使pH 呈酸性及基质金属蛋白酶2(Matrix metalloproteinase-2,MMP-2)过度表达,从而促进了药物释放。通过SERS 可以监测纳米颗粒的内化并量化LY 的释放。DNP-AuNPs-LY@Gel 复合物释放LY 可抑制CRC细胞增殖并诱导间充质-上皮转化(Mesenchymal-to-epithelial transition,MET),与游离药物相比治疗效果更好。
2 针对活性氧的检测
活性氧(Reactive oxygen species,ROS)主要描述氧在体内的单电子还原物质,包括过氧化氢(H2O2)、超氧阴离子(•O2-)、单线态氧(1O2)、羟基自由基(•OH)等[30-31]。由于致癌刺激、线粒体功能障碍、细胞增殖失控及代谢活动增加等因素,癌细胞表现出内在氧化应激增加[32]。近年来,针对肿瘤微环境中总体活性氧或单种活性氧物质进行检测的SERS探针均有文献报道[33]。
2.1 总体活性氧
Kumar等[34]设计并合成了一种肌红蛋白和聚多巴胺工程化的SERS(MP-SERS)探针,能对活细胞中的ROS进行检测和时空成像,并且还可以有效地监测饥饿诱导活细胞的自噬过程。MP-SERS探针中肌红蛋白包含的六配位Fe(III)-OH2可与ROS 反应形成Fe(IV)=O,其特征拉曼峰可以用于分析和量化ROS(图3A)。实验结果表明,癌细胞与非癌细胞表现出不同的ROS分布,采用细胞穿透线粒体靶向肽序列对MP-SERS探针进行修饰可以特异性地将探针递送到线粒体中以对线粒体ROS进行成像。这是首个能够实时监测饥饿诱导活细胞自噬过程的SERS 纳米探针。ROS 水平和磷脂酰肌醇3 激酶(Phosphatidylinositol 3 Kinase,PI3K)蛋白含量是表征细胞凋亡状态的两个重要参数。Wan 等[35]采用AuNRs@MPBA SERS 探针监测细胞内ROS水平和磷脂酰肌醇3,4,5-三磷酸(Phosphatidylinositol-3,4,5-triphosphate,PI(3,4,5)P3)的含量,反映PI3K/Akt 通路的调控作用。采用拉曼峰强度比I1071/I997计算细胞内ROS水平,776 cm-1处的拉曼峰检测PI(3,4,5)P3含量。当ROS水平显著升高时,线粒体膜电位降低,表明细胞内ROS水平对PI3K/Akt通路具有动态调节作用。Lü等[36]提出了一种基于冠状壳纳米颗粒的多模态成像策略,以研究三种典型的癌症生物标志物(MUC1,miRNA-21,ROS)在活细胞中的相关表达和协同作用。先在共价有机骨架(Covalent organic framework,COF)薄层上修饰ROS 响应的拉曼报告分子2-Mercaptohydroquinone(2-MHQ),然后在COF 层功能化上Cy5 标记的MUC1 核酸适配体和miRNA-21 响应的异硫氰酸荧光素(FITC)标记的发夹DNA。当纳米材料与细胞膜接触时,MUC1 和核酸适配体链之间的识别引起Cy5 的荧光恢复;在内化后,miRNA-21 与发夹DNA 间的杂交可诱导FITC的荧光恢复。因此,通过荧光成像可以可视化MUC1和miRNA-21的表达。在ROS存在的情况下,2-MHQ 分子可被氧化为2-Mercaptobenzoquinone(2-MBQ),引起SERS 光谱发生变化。因此,该设计可以实现3 种癌症生物标志物的多模态成像,为在三维细胞球体和复杂的细胞环境中可视化各种生物标志物铺平道路。

图3 SERS探针应用于肿瘤微环境中活性氧检测示意图Fig.3 Scheme of SERS probes for ROS detection
电刺激(Electrostimulation,ES)是一种重要的通过细胞内电活动进行治疗的方法。此外,它还能诱导细胞凋亡,是一种潜在的肿瘤治疗方法。Chen 等[37]设计了一种基于Au@MBN@Ag nanorods 的SERS探针,以检测在ES过程中产生的细胞内ROS。其传感机制是基于ROS可以蚀刻银壳,形成更薄、受损的银壳,从而削弱SERS 信号。通过在SERS 探针表面修饰多肽,可帮助其靶向到达目标细胞器,以检测在线粒体、细胞核中产生的局部ROS。监测细胞在化疗药物刺激下产生的ROS 对了解药物诱导细胞毒性的机制具有重要意义。Wang 等[38]构建了一种基于Ag/Au nanoshell 的新型比色和SERS 双响应传感器,用于细胞中ROS的检测。通过ROS诱导的银粒子降解,该纳米探针的紫外吸收光谱和拉曼信号发生明显变化。在此基础上,实现了抗癌药物刺激的细胞内ROS检测,证实了顺铂、紫杉醇、阿霉素和5-氟尿嘧啶可以刺激ROS的产生。
2.2 过氧化氢
过氧化氢是细胞内活性氧的代表之一,内源性H2O2水平被认为是反映恶性肿瘤发生和发展的一个重要指标。因此,开发SERS 探针用于活体细胞内的原位和可视化监测对肿瘤的早期诊断和有效治疗十分重要。
Peng 等[39]开发了一种基于金纳米棒的比例型SERS纳米探针,用于活细胞和组织中H2O2的检测。4-巯基硼酸酯(4-mercaptophenylboronic ester,MPBE)是传感H2O2的理想底物,苯硼酸酯与H2O2反应生成苯酚,致使993 cm-1处由于B—O 对称拉伸引起的强拉曼信号降低或消失,而1 071 cm-1处由于C—H 面内变形引起的拉曼信号不变,从而实现基于I1071/I993峰强度比值的H2O2定量检测。通过比例型策略能克服由于分子吸附不均匀和增强底物分布不规则而导致的SERS 信号重复性差的问题。实验结果表明,GNR/MPBE 探针可有效地进入活细胞中,对目标H2O2进行特异性、高信噪比成像。Wang 等[40]提出了一种利用Fe3O4@Ag 核-卫星无标记纳米颗粒对单个癌细胞内H2O2进行SERS超灵敏原位成像的策略。在H2O2存在下,Fe3O4@Ag NPs 能高效、选择性地催化过氧化物酶底物3,3’,5,5’-四甲基联苯胺(Tetramethyl benzidine,TMB)的氧化。通过建立H2O2水平与TMB 催化氧化产物的SERS 强度之间的相关性,可对活细胞内的H2O2进行原位监测(图3B)。在佛波酯(Phorbol myristate acetate,PMA)刺激单个B16 细胞后,采用Fe3O4@AgNP SERS 探针进行原位SERS 成像,能够量化细胞内H2O2并实现对释放到胞外H2O2的可视化。小尺寸等离子体纳米粒子易于被细胞和细胞器内化,但通常具有较低的SERS 活性,限制了其在细胞内SERS 分析中的应用前景。为了打破目前细胞内SERS应用的瓶颈,Jin等[41]首次提出了一种小尺寸(约10 nm)单分散核壳结构Ag/o-GQDs 纳米杂化的有效策略。Ag/o-GQDs 表现出优异的SERS 灵敏度和高效的纳米酶催化活性,通过催化类过氧化物酶的反应,可实现在亚细胞水平上精确感应细胞内H2O2。此外,Ag/o-GQDs纳米酶催化ROS生成和双靶向的能力也为肿瘤的特异性协同催化治疗提供了一个有前景的新途径。
Zhang等[42]采用简单的方法制备了多通道响应型Au@MnO2@MBN SERS 探针,实现了不同生物环境下对H2O2的传感。在该系统中,MnO2壳被用作H2O2响应调节器来调节拉曼报告分子与SERS 基底之间的距离。伴随着H2O2对MnO2壳层的降解,裸露的Au NP核和游离的Mn2+被释放,导致颜色明显变化和T1-MR 信号开启。同时,拉曼报告分子吸附在暴露的Au NPs上,产生强SERS信号(图3C)。该多功能纳米平台已被应用于裸眼感知H2O2的体外检测、单细胞水平的SERS 成像和体内核磁共振成像。这种多通道响应型SERS 探针为各种领域的H2O2检测提供了新的平台。Shen 等[43]设计并合成了一种具有双响应特性的新型MnO2@Ag@PMBA 核-卫星结构SERS 纳米探针用于H2O2的灵敏检测。在H2O2存在下,MnO2和Ag NPs 发生降解,导致SERS 信号发生变化,进而显著提高纳米探针的灵敏度。此外,实验验证了该探针在饥饿诱导的细胞自噬过程中能够检测H2O2水平。
Si 等[44]制备了一种超薄多孔硅壳包覆的金银合金纳米颗粒(AuAg@p-SiO2NP),并将其作为一种新型的炔基SERS纳米探针,用于活细胞中外源和内源H2O2的比例型SERS成像(图3D)。首先,将4-巯基苯乙炔(4-Mercaptophenylacetylene,MPAE)和4-巯基苯硼酸(4-Mercaptophenylboronic acid,MPBA)修饰的AuAg@p-SiO2NPs 与多巴胺(Dopamine,DA)一起孵育,通过DA 和MPBA 在纳米颗粒表面形成硼酸酯键作为中间连接体。然后,将3-(4-(Phenylethynyl) benzylthio) propanoic acid(PEB,2 214 cm-1)的信号炔分子通过PEB 上的羧基与DA 上的氨基之间形成酰胺键,结合到纳米粒子表面形成比例型SERS纳米探针。在H2O2的存在下,苯硼酸酯转换为苯酚,PEB 上的炔基从Au-Ag 合金纳米颗粒表面释放出来,显著降低了2 214 cm-1处的拉曼信号。而MPAE 在1 986 cm-1处的拉曼信号保持不变,因此可以根据I1986/I2214的比值对H2O2浓度进行定量分析。多孔SiO2包覆的Au-Ag合金纳米颗粒提供了一种具有良好生物相容性、高稳定性和有效抗干扰能力的新型SERS基底。
在肿瘤发生过程中,细胞膜相关的还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶和超氧化物歧化酶在细胞外空间产生H2O2,刺激细胞增殖并保持转化状态。因此,肿瘤细胞的一个特征是在细胞外环境中过量产生H2O2,随后吸收到细胞质中。由于细胞外H2O2的最显著梯度只能在与质膜接触的流体非常近的区域观察到,因此Hosogi 等[45]设计了一种能够锚定在细胞外表面膜蛋白处的Au@4MPBE SERS 探针用于H2O2的监测。将细胞表面高度定位的SERS 信息与氧化还原生物学的分析方法相结合,进而评估细胞内负责信号传导的H2O2的相关水平。这种新方法可能有助于研究实际H2O2浓度参与细胞增殖或死亡的机制。
肿瘤微环境含有的丰富H2O2与炎症过程也密切相关。Li 等[46]开发了一种新型的AuNNRNAT@Au@MSi-AuNP-MBN/MPA 双模态比例型核-卫星纳米探针,将SERS 和光声(Photoacoustic,PA)成像相结合,用于体内H2O2的实时定量检测。在H2O2的存在下,将作为核-卫星之间连接分子的硼酸酯转化为苯酚,导致AuNPs@MBN 释放,拉曼信号大大降低,而在纳米间隙内NAT 的拉曼信号保持不变。同时,在辣根过氧化物酶催化下封装于介孔硅中的2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS)转化为氧化态,在750 nm 处有很强的吸收,而AuNNRs 在1 250 nm 处的吸收几乎不变,并且能够应用于PA成像。该双模态比例型纳米探针不仅可以用于小鼠乳腺癌皮下肿瘤模型H2O2的检测,还可以根据H2O2的变化实时检测和跟踪炎症的治疗过程。双模态比例检测可以在空间和时间范围内获得多尺度信息,从而实现可靠的疾病诊断。
2.3 过氧亚硝酸盐
过氧亚硝酸盐(ONOO-)是各种生理和病理过程中重要的氧化剂,通常由一氧化氮或超氧化物的极限扩散反应产生。因此,迫切需要发展高灵敏和选择性的SERS 探针用于了解其相关的生理和病理机制。Liu 等[47]开发了一种高灵敏AuNFs/MAPE SERS 探针用于检测活细胞中的ONOO-。该探针的原理是基于ONOO-可以将苯硼酸酯氧化生成苯酚,从而导致SERS 光谱发生变化。结果表明,在其他干扰离子存在下,AuNFs/MAPE SERS 探针对ONOO-表现出较高的选择性和灵敏度。在氧化应激下,AuNFs/MAPE SERS探针可以快速、特异地检测出活细胞中ONOO-的水平。
表2 总结了近年来报道的应用于H2O2检测的SERS探针[17,39,41-46,48-56]。

表2 H2O2响应型SERS探针文献总结Table 2 Application of SERS probes in detection of H2O2
3 针对肿瘤乏氧状态的检测
肿瘤乏氧的主要原因是供应肿瘤的微血管的结构和功能异常,O2在血管与肿瘤细胞之间的扩散距离增大,因而无法被有效运输至特定部位[57]。乏氧不仅可以促进肿瘤生长、恶化和转移,还会降低放疗和化疗的疗效[58]。Qin 等[59]构建了一种由Ag/Au 合金纳米颗粒和单壁碳纳米管(SWCNT/Ag/AuNPs)组成的比例型SERS 纳米探针,该探针具有强SERS 信号、低细胞毒性和优异的化学稳定性。在拉曼静默区,SWCNT 在2 578 cm-1处呈现尖锐的散射峰,而拉曼报告分子在2 207 cm-1处呈现典型的散射峰。在乏氧条件下,拉曼报告分子被还原并从SERS基底上离开,导致2 207 cm-1处SERS强度降低,从而实现缺氧水平的检测。在HepG2、HeLa 活细胞和大鼠肝组织中,通过I2578/I2207两个峰强度的比值能实现比率法检测乏氧水平,表明该SERS探针可作为乏氧研究和临床应用的有力工具,有可能成为医学研究和临床诊断中体内外乏氧监测的有用方法。
4 针对高浓度谷胱甘肽的检测
谷胱甘肽(GSH)能够维持生物系统内的氧化还原平衡,是细胞中最丰富的内源性抗氧化剂。高浓度GSH 是多种肿瘤微环境的显著特征,过量的GSH 可清除具有细胞毒性的ROS,因而显著增强癌细胞对依赖ROS 进行治疗的抵抗能力。Sánchez-Illana 等[60]采用AgNPs 直接检测全血样本中谷胱甘肽的SERS 光谱。然而,由于GSH 具有低分子极化和小拉曼散射截面的特性,使得直接应用SERS 检测GSH具有挑战性。因此开发用于间接检测GSH的响应型SERS探针非常必要。
二硫键(S—S)可被GSH快速裂解,是构建GSH响应型载体的常见结构。在低浓度GSH的细胞外环境中,二硫键可以保持稳定,而在高度还原性的细胞内环境中,通过GSH 介导的硫醇-二硫化物交换反应,使二硫键被快速切断。利用GSH 能将分子中二硫键断裂的特性,研究者们设计了一系列分子用于监测GSH的浓度(图4A)。Zhu等[61]开发了一种用于检测细胞内GSH的SERS探针。GSH能够将5,5’-Dithiobis-(2-nitrobenzoic acid)(DTNB)内部的二硫键断裂生成2-Nitro-5-thiobenzoic acid(TNB),然后利用无机盐MgSO4诱导AgNPs聚集的简便方法对DTNB和TNB的SERS信号进行区分,进而实现GSH 的高灵敏定量测定。Wei 等[62]设计了一种基于2-(Pyridyldithio) ethylamine(PDEA)修饰的AgNPs@Si SERS 探针用于检测细胞内谷胱甘肽。GSH 会破坏PDEA 的二硫键,释放PDEA 中的吡啶环,导致SERS 信号减弱。研究人员使用该方法评估细胞GSH水平,发现癌细胞中的GSH水平高于正常细胞。通过这种特殊的表面反应策略,可以快速、灵敏地测定GSH 的含量,该方法在生物医学诊断中具有很大的潜力,同时能为依赖细胞内GSH 水平的生物医学应用提供指导。Zong 等[63]开发了一种SERS 可追踪和刺激响应的纳米载药系统,该系统由拉曼报告分子标记的Au@Ag 纳米棒(Au@Ag NRs)作为内部SERS 活性核,介孔二氧化硅(Mesoporous silica,MS)作为外部含药壳。为了使纳米载体具有GSH的响应行为,利用可被GSH 切割的二硫键直接将药物分子附着在MS 上。在高浓度GSH 环境下,二硫键断裂,导致细胞内药物释放。通过SERS信号跟踪纳米载体的位置以及荧光跟踪药物的位置,可以监测药物在活细胞内释放的动态过程。

图4 SERS探针应用于肿瘤微环境中GSH检测示意图Fig.4 Scheme of SERS probes for GSH detection
Hu 等[64]基于GSH 能够溶解MnO2这一特性设计了一种新型的PMBA@Ag/Au@MnO2核-卫星结构SERS 纳米探针。其中,MnO2既可作为Ag/Au NPs 的“热点”载体增强SERS 信号,又可通过GSH 刺激发生降解来改变SERS 强度(图4B)。此外,SERS纳米探针不仅可测量正常细胞和癌细胞的GSH 水平,还可检测L-2-氧代噻唑烷-4-羧酸盐(L-2-Oxothiazolidine-4-carboxylate,OTZ)刺激正常细胞和癌细胞时GSH 水平的变化情况。同样,Wang等[65]设计并制备了Au@MnO2核壳复合SERS 探针。在MnO2的作用下,TMB 分子被催化形成二聚体电荷转移复合物(Charge-transfer complex,CTC)。加入GSH 后,MnO2发生溶解,使CTC 分子从表面释放,其SERS 信号降低,进而间接、灵敏地检测GSH(图4C)。研究表明,Au@MnO2-SERS 探针可以快速、可靠地测定细胞中GSH 的含量,在快速诊断GSH 相关疾病方面具有很大的应用潜力。
Li 等[66]开发了一种Neocuproine-Cu(Nc-CuII)功能化Au-Ag“纳米碗”(Au-Ag NBs/Nc-CuII)SERS 纳米探针用于检测GSH。其原理是基于经典的氧化还原反应,在GSH 存在下Nc-CuII还原为Nc-CuI,使SERS 光谱发生变化,从而应用于GSH的灵敏和选择性检测(图4D)。Li等[67]通过界面多酚还原法在金属-多酚胶体球上沉积银纳米粒子制备了Ag NPs/Gu-多酚胶体球(CuTA@Ag)。通过调整银前驱体的浓度,可以很容易地调节沉积在外层上的银纳米粒子的大小和密度,引起纳米酶活性和SERS 特性的差异。该SERS 探针能够催化TMB,得到具有强SERS 信号的氧化型TMB(oxTMB),而GSH 的加入使oxTMB 减少,信号减弱。这种基于催化反应的SERS 探针能够准确、可重复地检测癌细胞中的GSH 含量,捕捉到癌症标志物水平上升的迹象,有望应用于肿瘤微环境中GSH的高灵敏检测。
5 针对过表达酶的检测
酶在生物代谢过程中起着至关重要的作用,肿瘤疾病的病理学进展与酶的活性和表达水平密切相关。在肿瘤组织部位,蛋白酶和磷脂酶等酶的表达和活性均显著高于正常组织,这对肿瘤的发生和发展有着重要的影响[68]。酶响应型SERS 探针的构建大多是基于可被蛋白酶或酯酶降解的短肽序列或酯键。
基质金属蛋白酶(Matrix metalloproteinases,MMPs)在肿瘤中高度表达,与肿瘤生长、侵袭和转移具有密切关系,因此对其检测对于促进临床诊断非常重要。Narayanan 等[69]开发了一种MMPSQ@GNR@LAH-DOX SERS 探针,可以靶向MMPs 过表达的癌细胞并结合GNR 的光热效应和DOX 的细胞毒性进行光热治疗和化疗。该探针在接近靶细胞时,酶的识别会引起底物肽链断裂,使拉曼特征分子从GNR 表面分离,导致SERS 信号强度逐渐下降(图5A)。随后,LAH-DOX 偶联物的腙键在酸性肿瘤微环境中发生断裂,释放DOX。另外,在激光照射下GNR 产生光热联合治疗作用。同时,该SERS平台也能够研究细胞凋亡过程中的分子变化。虽然在癌症等复杂的疾病中需要进一步的观察验证,但目前的研究表明,SERS诊断方法具有监测治疗效果的潜力。
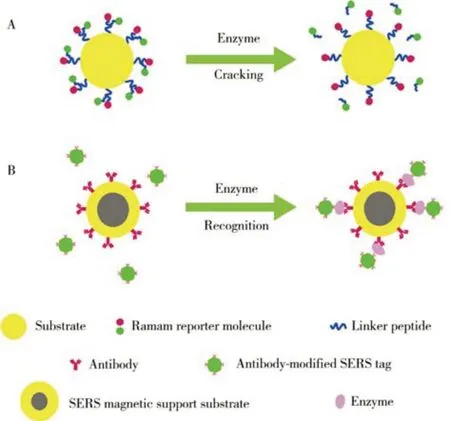
图5 SERS探针应用于肿瘤微环境中酶表达水平的检测Fig.5 Scheme of SERS probes for detection of overexpressed enzyme
Saranya等[70]制备了具有荧光和SERS之间“开-关”转换的可编程纳米颗粒。该纳米系统的设计原理是在AuNPs表面通过(Phe-Lys-Cys,FKC)序列连接上双响应拉曼活性荧光基团,而肿瘤细胞中过量表达的组织蛋白酶(Cathepsin B,CathB)可使FKC 序列被特异性降解,释放荧光基团的同时抑制SERS信号强度,从而实现荧光和拉曼模态之间的开关。该纳米系统利用3种探针在837、354、617 cm-1处的独特指纹SERS 峰和450、520、580 nm 处的发射峰,可同时检测多种生物标志物,具有较高的灵敏度和特异性。酶驱动荧光-SERS 编码探针能够通过多模态方法对疾病靶点进行灵敏和特异性分析,是一种有效的生物标志物检测方案,为开发用于即时诊断和个性化治疗应用的临床筛选探针提供了新的途径。
亮氨酸氨基肽酶(Leucine aminopeptidase,LAP)是一种重要的蛋白水解酶,与肝损伤、癌症等多种疾病密切相关。Guo等[71]开发了一种结合LAP响应性和SERS活性的新型SERS探针(b-(s)-ANT-Leu)。该探针分子通过Ag—S键,将b-(s)-ANT-Leu结合在AgNPs表面,其L-亮氨酸酰胺基团可被LAP裂解,转化为相应的水解反应产物3,3’-disulfanediyldianiline(DSDA),致使其SERS 光谱产生显著差异。根据SERS信号的变化可实现LAP活性检测。
Si 等[72]成功开发了一种基于炔-DNA 功能化合金Au/Ag NPs 的比例型SERS 纳米传感器,用于检测活细胞中的核酸内切酶,具有高灵敏度和良好的信号再现性。将制备的3-[4-(Phenylethynyl)benzylthio] propanoic acid(PEB)标记在巯基修饰的DNA 上(HS-DNA-PEB),形成巯基/炔双功能化单链DNA 作为拉曼报告分子。通过在合金Au/AgNPs 表面组装ssDNA 和内标分子4-Thiophenylacetylene(TPA),构建了炔-DNA/合金Au/AgNPs SERS 探针。该SERS 探针可以同时检测PEB 和TPA 分子的拉曼信号。在存在核酸内切酶的情况下,与ssDNA 偶联的PEB分子因核酸内切酶的催化导致DNA裂解从粒子表面释放,导致其SERS 信号大幅降低,而TPA 的拉曼信号不受内切酶的影响,因此可以通过计算峰值强度比实现对核酸内切酶活性的定量检测。炔作为拉曼报告分子能够在拉曼静默区产生无干扰的强拉曼信号,基于炔烃的比例型SERS传感方法提高了复杂体系中核酸内切酶检测的可靠性。
近年来,人们发现人羧酸酯酶1(Human carboxylesterase 1,hCE1)的水平异常可能与代谢性肝病和肝细胞癌的发生发展有直接关系。因此,监测hCE1 水平对于研究肝细胞损伤和肝细胞癌的进展非常重要。Yang等[73]开发了一种用于hCE1 检测的“三明治”结构SERS 免疫磁性生物传感器(图5B)。该方法利用ZIF-67/Ag/R6G/antihCE1 作为SERS 探针、磁性CoFe2O4/Ag/anti-hCE1核-卫星纳米结构作为SERS 增强基底用于检测hCE1。存在hCE1 时,SERS 探针与磁性CoFe2O4/Ag/anti-hCE1 基底通过抗原-抗体免疫反应耦合,进一步增强SERS 光谱的强度。利用构建的SERS免疫磁性传感器能够快速测定HepG2细胞裂解液和培养上清液中的hCE1 浓度,并实时监测对乙酰氨基酚处理的HepG2 细胞释放到培养液中的hCE1,进而了解hCE1 水平与肝细胞损伤之间的相关性。
最近,液体活检因其简单、无创的取样方式而引起了广泛的关注。Wang 等[74]制备了一种肾脏可清除的Glu-RR-AuNC SERS 探针用于通过尿液实时监测癌症进展和治疗响应。将含有炔基的内标分子和酶响应单元(SERS 特征峰分别为2 154 和2 230 cm-1)连接在金纳米团簇(Gold nanoclusters,AuNCs)上构成β-葡萄糖醛酸酶(β-Glucuronidase,GUSB)响应的SERS 探针。将纳米探针经小鼠静脉注射到体内后,Glu-RR-AuNCs 被动积累到肿瘤部位,其中酶响应单元被过表达的GUSB 特异性切割断裂,生成只含有内标分子的AuNCs。在尿液中加入生长液使AuNCs 生长成纳米星,进而放大表面保留的内标分子的SERS信号。这些信号位于生物拉曼静默区,消除了可能的背景干扰。该文献报道的这种自我校准、无背景、高灵敏度的尿液传感系统对于无创检测早期癌症和定量监测癌症的发展具有重要的临床意义。
6 总结与展望
SERS是一种强大的定量检测和成像分析工具,具有灵敏度高、特异性好、多重检测、抗光漂白等显著优点,因此,基于SERS的检测方法备受活细胞和组织可视化及疾病诊断领域的关注。本文总结了目前常见的针对pH、氧化应激、乏氧、高浓度谷胱甘肽和过表达酶进行检测的TME 响应型SERS 探针及其响应机理。这些探针具有高度的特异性和强信噪比,能够清晰直观地传递生物信息,为肿瘤相关疾病的纳米诊疗技术提供有效策略。将诊断与治疗相结合是设计双模式或多模式肿瘤微环境响应型SERS 探针的主要研究方向。通过SERS 探针进行灵敏特异的分子识别,同时在激光辐射下产生光热、光动力治疗或通过TME 刺激激活化疗等其他级联治疗方案,这类新型SERS 探针的设计制备已经成为癌症特异性治疗领域的热门方向之一。
尽管基于肿瘤微环境设计的响应型SERS探针被相继报道,但要真正应用于肿瘤的临床研究和诊断治疗仍存在许多挑战,如材料的生物相容性、拉曼信号强度和生物自身信号干扰等。首先,研究人员需要设计和构建具有更好生物相容性的SERS基底,并充分评价材料对细胞、机体的短期长期影响及在体内的分布和代谢情况;其次,对于体内应用,合成具有更强拉曼信号的报告分子、具有更高信号增强能力的SERS 基底,建立具有更大穿透深度的成像方法,对提高探针的检测灵敏度十分重要,同时,基于拉曼静默区设计的SERS 探针能够避免生物体内复杂环境对其产生额外的、不可预测的信号干扰,信噪比更高。此外,设计制备过程简单、组分少、具有多重响应能力及多重诊疗功能的肿瘤微环境响应型SERS探针具有良好的发展前景。我们相信,在不久的将来,随着人们对肿瘤发生发展过程中各种机制的阐明和SERS 技术的快速发展,具有更大优势的新型诊疗一体化SERS 探针也将随之被开发并应用于肿瘤的临床诊断和治疗。
