刺激响应型SERS探针在分子医学领域的应用
2024-01-24徐逸婷罗奥雅曲家毅肖嘉祥
徐逸婷,罗奥雅,曲家毅,肖嘉祥,董 倩*
(1.湖南科技大学 化学化工学院,湖南 湘潭 411201;2.湖南大学 化学化工学院,分子科学与生物医学湖南省重点实验室,湖南 长沙 410082;3.湖南大学 化学化工学院,化学生物传感与计量学国家重点实验室,湖南 长沙 410082)
拉曼光谱技术基于拉曼散射现象,即单色光(通常是激光)与样品相互作用并散射其分子。散射的光由于分子的振动能级而发生频率偏移,从而产生包含对应于不同分子振动的特征峰的拉曼光谱,是一种用于研究分子振动模式的强大光学技术,能够提供检测物的化学成分、分子结构和相互作用等有价值的信息[1-2]。拉曼光谱的非侵入性和无标记性使其在医学应用中具有极大吸引力[3]。表面增强拉曼(SERS)和针尖增强拉曼(TERS)现象被发现以来,拉曼技术已能够实现对微量目标分子的检测,为分子医学领域的应用铺平了道路。如今,SERS探针已被广泛应用于生命医学研究,帮助疾病诊断和药物监测[4-7]。而刺激响应型表面增强拉曼散射(SR-SERS)是一种结合了表面增强拉曼散射原理和对外界刺激的响应性的特殊类型的光学传感技术,通过对增强基底进行功能化修饰,可在特定的环境变化或刺激下改变其SERS 活性。这些变化包括pH 值、温度、某些分子或离子浓度的变化,以及其他可以表明特定生理状态或疾病状况的因素。当探针与目标环境相互作用时,其SERS活性发生变化,导致拉曼散射信号发生可检测的变化。SR-SERS 探针因其敏感性、特异性和实时监测能力,在医学应用中具有巨大的潜力。本文对现有SR-SERS探针的设计原则和响应原理进行介绍,对其在分子医学领域的应用进行综述,并对其未来的发展趋势和面临的挑战进行了讨论,旨在较为全面、客观地展现SR-SERS探针的发展情况。
1 刺激响应型SERS探针的响应原理
刺激响应型SERS探针通常包括3个组成部分:增强基底、刺激响应介质和拉曼报告分子,有些还包括辅助部分,主要用于提高探针的生物相容性、维持探针的结构稳定性,保障检测的高灵敏度和高特异性。其设计和响应原理如图1所示。其中刺激响应介质是实现目标物高特异性检测的最关键部分。通过对分子结构和化学特性的设计,能够实现SERS在复杂环境中对目标分子的精确捕获[9];通过设计多种响应介质,可根据拉曼报告分子特征图谱的差异,实现多目标分子的同时检测[10]。常见的响应介质有聚合物[11-14]、DNA[15-19]、蛋白质/多肽[20-21]、有机小分子化合物[22-24]、无机化合物[25-27]等。值得注意的是,增强基底、响应介质、拉曼报告分子和辅助部分既可以是相对独立的组件也可以是统一的整体,例如Chen 课题组和Liu 课题组合成的多种贵金属石墨纳米颗粒[28-29],通过石墨材料对金属纳米颗粒的包覆,提高了探针整体在复杂生理条件下的稳定性。此外,其石墨材料既可作为拉曼增强基底,又可作为辅助部分维持信号稳定,而修饰有核酸适配体的聚乙二醇烷基链则既可实现目标物的捕获,又可作为辅助部分提高探针的生物相容性。SR-SERS 探针各部分的有机整合能够实现对目标物高选择性、高灵敏度、高响应性的检测。

图1 SR-SERS探针的设计和响应原理示意图[8]Fig.1 Schematic diagram of the design and responsive mechanism of SR-SERS probes[8]
SR-SERS探针在待检测分子或外部刺激与SERS探针的特定相互作用下可以激活探针体系产生SERS信号的变化,基于此可建立定性或定量检测方法。这种SERS信号变化可分为信号强度变化和位移变化。
1.1 强度变化
SERS效应中拉曼散射信号的增强通常由两种机制产生[30]:一是通过光场在金属纳米结构中的局部化而产生的电磁场增强,这种局部电磁场增强被称为“热点”(Hot spot)。当金属纳米粒子之间的距离减小,彼此间会产生更多“热点”,并引发局部电磁场增强,获得更强的拉曼信号;二是在分子或晶格与金属纳米结构接触时,当被检测分子与增强基底之间距离减小(通常要求小于2 nm),由于拉曼截面的增加而产生化学或电子增强,从而获得更强的拉曼信号。上述两种响应机制分别调控了增强基底之间的耦合距离或基底-报告分子之间的耦合距离。这种对距离的调控可通过在金属纳米粒子表面修饰响应介质实现。
调控增强基底之间的耦合距离:利用基底之间介质对外界刺激的响应,能够引起体系中电荷[31-32]或亲疏水性质[33-34]的变化,在静电作用力或范德华力的作用下探针内部空间结构膨胀或坍缩,引起增强基底金属纳米粒子之间间隙的改变。
调控基底-报告分子之间的耦合距离:与控制基底之间的间隙不同,基底-报告分子距离调控主要是利用外界刺激改变增强基底与报告分子之间的距离,随着报告分子与基底之间距离的增加,等离子共振耦合强度削弱,拉曼信号也随之减弱。这种信号分子与基底的距离调控可采用中间介质空间结构转变或与其它配体的结合竞争等策略实现。
上述两种策略通常能够带来拉曼信号数十倍到数百倍不等的强度变化,极大提高了分析检测的选择性和灵敏度。然而,大部分探针通过静电相互作用力或疏水作用力实现这种转变,非键合力相对较弱,易受到体内生理环境的干扰。针对这一问题,有研究工作进一步设计了刺激响应的共价连接的SERS 探针。Huang 等[35]开发了一种pH 响应纳米诊疗体系。在该系统中,模型药物阿霉素(DOX)通过pH 响应的硼酸酯键连接在拉曼报告分子4-巯基苯基硼酸(4-MPBA)上。进入肿瘤后,硼酸酯在酸性环境中的断裂导致DOX 的释放和4-MPBA SERS 信号的恢复。通过4-MPBA SERS 光谱的实时变化可监测药物的动态释放情况(图2A)。以人乳腺癌细胞(MCF-7)作为模型细胞,这种纳米复合材料利用拉曼信号的变化实现了药物信号的检测,并通过光热治疗实现了对肿瘤细胞的高效抑制且在活体移植瘤模型中未发现明显的副作用,显示出其在实际应用中良好的生物相容性和卓越的SERS活性,为检测其他药物的释放提供了有效方式。

图2 pH响应共价连接型SR-SERS探针4-巯基苯基硼酸[35](A),基质金属蛋白酶-2(MMP-2)敏感的比率型SR-SERS探针[36](B),胆汁多组分识别的位移变化型SR-SERS探针[37](C)Fig.2 pH response covalent linked SR-SERS probe,4-MPBA[35](A);rate-type SR-SERS probes sensitive to metalloproteinase-2(MMP-2)[36](B);displacement-varying SR-SERS probes for bile multi-component recognition[37](C)
然而,受到成像条件和外界环境的干扰,例如探针浓度、底物状态以及激光聚焦深度等因素,拉曼绝对强度的分析已不能够实现目标物的准确定量检测。研究表明,设置对目标物分子或离子不敏感的内参分子信标,通过分析内参与响应性拉曼报告分子信号比率的变化可有效提高定量检测的准确性。如图2B,Zhong等[36]提出了一种基质金属蛋白酶-2(MMP-2)敏感的比率型SERS纳米探针。纳米探针包含3 个组分:等离子体活性金纳米粒子作为SERS 增强基质,拉曼染料罗丹明B(Rh B)标记的底物肽作为特异性MMP-2 识别元件,2-萘硫醇(2-NT)作为内标。MMP-2 响应性切割纳米探针表面的肽导致Rh B的SERS信号减弱,其与内标2-NT的强度成比例变化,可定量反映MMP-2的活性水平,而MMP-2的活性可用于区分两种不同恶性程度的乳腺癌细胞亚型。该工作利用具有较大拉曼截面积的拉曼报告分子Rh B 与化学惰性分子2-NT 结合,提高了纳米探针的灵敏度和稳定性,使该探针可检测生物样本中MMP-2 酶活性,并实现了对正常的乳腺上表皮细胞和不同亚型的乳腺癌细胞中MMP-2 酶的可视化分析,为区分不同恶性程度的肿瘤细胞提供了极具可行性的检测方案。
1.2 拉曼位移变化
除了调控强度变化以外,SR-SERS 探针还可通过构建与目标物发生作用前后散射光谱峰位移数与目标物浓度之间的关系对目标物进行检测。这种针对指纹图谱位移的分析有时能够极大提高检测的灵敏度和准确性。例如Bui 等[37]探索了一种间接响应多种胆汁成分的SERS 分析方法(如图2C),在SERS衬底(Ni箔上的Au纳米枝晶)表面修饰了4种具有不同官能团的烷硫醇分子作为胆汁成分响应的拉曼报告分子(—SH(CH2)2CH3、—SH(CH2)2NH2、—SH(CH2)2COOH 和—SH(CH2)2OH),每种报告分子具有特征指纹谱,且与胆汁纯组分及胆汁水溶液相互作用时的SERS 峰明显不同。分析结果表明,将—SH(CH2)2CH3和—SH(CH2)2OH 所获得的光谱主成分评分组合后,基于k 近邻法的鉴别准确率为100%,优于单独使用底物的鉴别准确率(90.6%~96.9%)。这种由多种报告分子提供的互补的光谱信息提高了胆囊息肉和胆囊癌等疾病鉴别的准确性。
以上两种响应原理各有优缺点。从检测的灵敏度上来说,通常强度信号变化高于拉曼位移信号变化。这是因为区分小的拉曼位移信号(2~10 cm-1)变化需要更窄的光栅,同时还要满足响应前后各谱峰相对分离、不重叠。而比率信号变化通过设置内参,有效提高了探针的抗干扰能力,准确性优于单纯的强度信号变化[38];而基于拉曼位移信号变化原理,能够对指纹图谱中多个特征峰的位移变化进行同时分析,由于这些变化提供了样品中分子键振动频率的直接信息,相对于特定峰强度信号或比率信号变化,其检测特异性更强,特别是在复杂混合物的定性分析以及微量化合物的检测应用中[39-40]。例如Zheng 等[41]报道了一种基于单抗体、多变量回归和峰移策略的等离子体拉曼免疫测定方法,用于血清生物标志物的检测。通过对拉曼报告器振动的纳米力学扰动而产生的具有特征的光谱变化,重新编码了与捕获的分析物相关的丰富信息。该工作通过融合拉曼光谱和化学计量分析,建立了用于生物标志物敏感检测的拉曼频移和多元回归模型,实现了羊血清等样品中生物分子的检测。
2 刺激响应型SERS探针在分子医学领域的应用
2.1 在疾病诊断中的应用
拉曼成像技术可在细胞水平乃至生物分子水平对复杂的生物体结构进行解析,对疾病诊断具有重要意义。本文将对不同响应刺激的探针在分子医学领域的应用进行系统阐述。
2.1.1 pH 响应型SERS 探针生理局部pH 是一个动态平衡的指标。异常的pH 水平通常与疾病发生与发展密切相关。发展pH 响应型SERS 探针对这类pH 相关疾病的诊断可以起到辅助作用。pH 响应型SERS 探针通常由SERS 基底和pH 响应的介质或拉曼报告分子组成。介质或拉曼报告分子在外界pH 刺激下发生质子化/去质子化或者化合键断裂/形成的过程,基于不同的响应机理,上述改变带来信号强度或拉曼位移的变化,可用于检测环境pH水平变化。例如Quazi等[31]合成了一种pH响应的多功能金纳米粒子。通过在纳米粒子表面引入混合层的荧光染料修饰的单链DNA(作为拉曼探针和带负电荷的配体)和细胞色素C(作为pH 响应的电荷反转配体),在肿瘤酸性环境中可逆调控了基底间的耦合距离。但这种以调控增强基底之间的耦合距离改变信号强度来测定pH的策略往往受到响应介质单一等电点的限制,无法满足高分辨的pH测定。相比之下,通过观测相应介质本身拉曼峰强比率信号的改变来监测pH水平能够克服这一缺点。如图3,Chung等[43]开发了一种可穿戴的柔性Au/TPU静电纺纳米纤维SERS贴片用于汗液pH 的传感。该工作引入pH 响应分子4-巯基苯甲酸(4-MBA)和4-巯基吡啶(4-Mpy)作为pH 响应拉曼信号分子,结果显示,通过分析4-MBA 的特征峰强度比能够实现在pH 5.5~7.0 范围内0.14~0.33 pH 的高分辨率检测。该方法成本低,机械性能稳定,便于干燥室温存储,同时由于水分子可以快速渗透,可作为少量液体SERS基底用于汗液、血液、尿液等外周体液的检测。pH响应型SERS探针在分子医学领域中的应用如表1所示。

表1 pH响应型SERS探针在分子医学领域的应用Table 1 The applications of pH responsive SERS probes in molecular medicine

图3 基于SERS活性的静电纺丝可穿戴汗液pH传感器示意图(A),以及利用4-MBA峰值比率标定pH曲线v(COO-)/v(ref)(B)和v(C=O)/v(ref)(C)[43]Fig.3 Schematic diagram of electrospinning wearable sweat pH sensor based on SERS activity(A);calibration curves of 4-MBA using intensity ratio of peaks v(COO-)/v(ref)(B) and v(C=O)/v(ref)(C)[43]v(ref) represented the peak value in 1 590 cm-1,which was assigned to the v8a ring breathing mode of the 4-MBA aromatic ring
2.1.2 温度响应型SERS 探针温度响应型SERS 探针较少用于生物体的测温,其应用更多集中在利用温度响应性调节耦合距离增强待测目标物的拉曼信号(见表2)。如图4,Juang 等[48]利用温敏性聚合物Pluronic®F127(F127)制备了一种带有金纳米颗粒(AuNPs)的热响应性拉曼增强纳米囊。F127的低共溶温度(LCST)约为26.5 ℃,当温度从15 ℃升至37 ℃时,F127 纳米囊从亲水性(溶胀)变为疏水性(皱缩),纳米胶囊的尺寸会从160 nm大幅缩小到20 nm,使得AuNPs之间的距离显著减小,从而增强了热点效应,提高了SERS检测的灵敏度,其对临床样本中难以检测的羧基末端甲状旁腺激素片段(PTH)的LOD 为10-6mol/L。这种无需额外荧光标记的SERS 检测方法不但样品前处理简单,而且可快速分析待测物的浓度,因此在生物医学、环境和临床检测中有广阔的应用前景。

表2 温度响应型SERS探针在分子医学领域的应用Table 2 The applications of temperature responsive SERS probes in molecular medicine

图4 AuNPs@Pluronic F127纳米胶囊的热响应性合成和检测示意图(A),及其对羧基末端甲状旁腺激素片段(C-PTH)的SERS光谱(37 ℃>LCST)(B)[48]Fig.4 Schematic diagram of thermal response synthesis and detection of AuNPs@Pluronic F127 nanocapsules(A);SERS spectra of AuNPs@Pluronic F127 nanocapsules for carboxylterminal parathyroid hormone fragments(C-PTH)at 37 ℃ (above LCST)(B)[48]
2.1.3 代谢小分子响应型SERS 探针代谢物是参与体内各种生化通路的小分子物质。通过分析代谢产物,医疗人员可以了解与疾病相关的特定代谢改变。代谢物水平的变化常发生在出现明显症状前,检测这些变化有助于疾病的早期发现、监测和预后[52]。在众多代谢物中,活性氧簇(如超氧化物阴离子、过氧化氢、羟基自由基、单线态氧等)广泛参与细胞分化、增殖、肿瘤发生和免疫应答等多种生理或病理过程,而这种活性氧簇分子由于化学活性高,存在时间短,使得原位定量检测H2O2存在挑战。2021年,Li等[53]发展了一种新型核心-卫星纳米金探针,该探针采取SERS 和光声(PA)双比率成像策略,在活体层面实现了对炎症/癌症相关活性氧簇的定量可视化检测和治疗(图5)。在H2O2存在下,这种核心-卫星纳米结构的外部AuNPs 首先发生解离,使4-巯基苯甲腈(MBN)在2 228 cm-1处的SERS 峰值强度减弱,而放置在介孔硅(MSNs)包覆金纳米棒间隙(AuNNR)的2-萘硫醇(NAT)在1 418 cm-1处的信号不变,形成H2O2响应的I2228/I1418的比值SERS 信号。同时,在H2O2存在下,负载在MSNs 壳中的2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵(ABTS)转化为氧化形式,750 nm 处的PA 信号增强,而1 250 nm 处AuNNR的PA 强度保持不变,产生比率PA750/PA1250信号。这一双模态比率成像机制提高了检测的准确性,为解构复杂的生理过程提供了有力的分析工具。除了可对代谢物进行原位检测外,SERS技术还可实现体外高灵敏度的快速检测以满足临床检测的需要。例如Sahoo等[54]设计并构建了一种简单、无标记、无预处理的潜在生物传感器用于人血清中直接胆红素(D-BIL)的快速检测。该传感器由银纳米线组成随机交叉-木桩的纳米结构(图6)。这种三维富等离子体纳米结构能够提供丰富的空间热点,具有较高灵敏度,对D-BIL的检测限为10 nmol/L,且所需样本极少,只需要10 µL人血清。这是利用SERS技术首次在临床检测范围内检测到D-BIL,为这类响应型SERS探针的临床转化提供了可能。代谢小分子响应型SERS探针在分子医学领域的应用实例如表3所示。

表3 代谢小分子响应型SERS探针在分子医学领域的应用Table 3 The applications of small molecular metabolite responsive SERS probes in molecular medicine
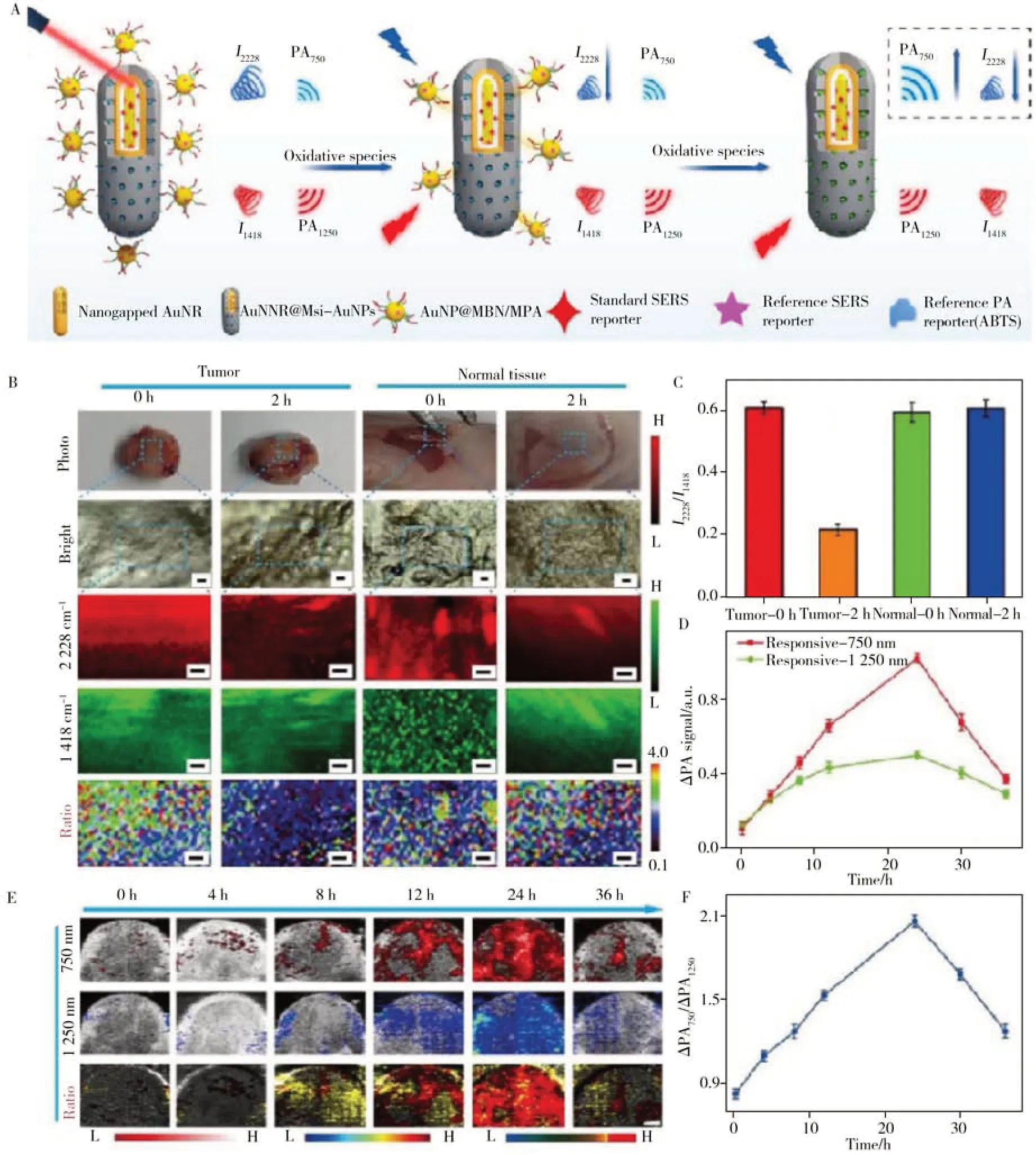
图5 H2O2响应的SERS和光声(PA)双比率成像示意图(A);SERS比率(I2228/I1418)信号成像肿瘤和正常组织(B);SERS比率(I2228/I1418)信号在纳米探针注入后不同时间点的强度(C);静脉注射纳米探针后不同时间皮下4T1肿瘤小鼠的PA值(D,750 nm、1 250 nm)及相应的比例(ΔPA750/ΔPA1250)PA成像(E),以及注射后不同时间点ΔPA750/ΔPA1250信号强度(F)[53]Fig.5 Schematic illustration of H2O2 responsive dual ratiometric SERS and photoacoustic imaging (A);ratio(I2228/I1418) SERS imaging of tumors and normal tissues (B);ratio(I2228/I1418) SERS intensity at different time points after injection of the nanoprobe(C);PA values(D) at 750 nm and 1 250 nm and the corresponding ratiometric PA imaging(E) and the ratiometric PA intensity in mice with subcutaneous 4T1 tumor at different times after intravenous injection of the nanoprobe (F)[53]

图6 银纳米线组成的随机交叉-木桩的三维富等离子体纳米结构示意图(A),以及在胎牛血清中监测到的胆红素分子指纹图谱(B)[54]Fig.6 3D plasma nanostructure diagram of silver nanowires composed of random cross-wood piles(A),SERS substrates identify bilirubin molecular fingerprints in bilirubin-containing fetal bovine serum(B)[54]
2.1.4 生物大分子响应型SERS 探针大分子如蛋白质(包括酶)和核酸(DNA 和RNA),是细胞的基本组成部分,在生物过程中发挥重要作用,检测这些生物标志物有助于了解发病机制、早期诊断、风险评估和监测疾病进展。生物大分子响应型SERS探针通常是基于分子识别机制来构建,其在分子医学领域的应用如表4 所示。如图7A,Wang 等[65]构建了一种新型的SERS 生物传感平台,结合靶向响应的DNA 水凝胶实现了快速、准确、灵活地检测肝癌特异性标志物甲胎蛋白(AFP)。通过引入特异性识别AFP的适配子构成DNA 水凝胶中的连接子链,在AFP存在的情况下,引起水凝胶解缠结并释放免疫球蛋白G(IgG)。随后,释放的IgG被SERS探针和生物功能磁珠通过形成三明治状结构捕获,导致磁分离后上清液中拉曼标签的信号峰值比率I1612/I520降低(图7C)。这种检测方法由于SERS 生物传感器的超高灵敏度,检测线性范围较宽(50~0.5 µg/mL),检测限低至50 pg/mL,为肝癌诊断提供了新的分子工具。

表4 生物大分子响应型SERS探针在分子医学领域的应用Table 4 The applications of micromolecule responsive SERS probes in molecular medicine

图7 甲胎蛋白(AFP)响应性DNA水凝胶示意图[65](A);该检测平台在不同浓度AFP下采集的SERS光谱[65](B);I1612/I520峰值比率与AFP浓度对数值的线性关系(n=6)[65](C);内切酶响应的DNA-炔纳米传感器示意图[66](D);添加不同浓度DNA酶I后的SERS光谱[66](E);I1983/I2215的峰值强度比与DNA酶I浓度的相关性[66](F)Fig.7 Schematic diagram of alpha-fetoprotein(AFP) responsive DNA hydrogel[65](A);SERS spectra of this detection platform collected with various concentrations of AFP[65](B);linear relationship between the value of I1612/I520 and the logarithm of AFP concentration(n=6)[65](C);schematic diagram of endonuclide responsive DNA-acetylene nanosensor[66](D);SERS spectra upon addition of DNase I with different concentrations[66](E);correlation of the peak intensity ratios of I1983/I2215 and DNase I concentrations[66](F)
利用酶催化反应构建探针是检测疾病相关酶的常见策略。Si等[66]构建了一种新型的比率型SERS传感器用于检测核酸内切酶的活性(图7D)。该工作在金银合金纳米粒子表面修饰3-[4-(苯乙炔基)苄基硫]丙酸(PEB)的单链DNA(ssDNA)作为内切核酸酶响应的SERS 信号分子,同时修饰4-噻吩基乙炔(TPA)作为内标SERS信号分子。在核酸内切酶存在时,ssDNA 被切割,从粒子表面释放PEB 分子,使得PEB在2 215 cm-1处的SERS信号降低,而TPA内标在1 983 cm-1处的信号保持不变,基于I1983/I2215的比率实现了核酸内切酶的定量检测,检测限低至0.056 U/mL(图7E、7F)。该研究证明了Au/Ag纳米复合材料除了具有更好的化学稳定性和低生物毒性,还具有更优异的等离子体特性。通过在材料表面进行炔烃的功能化修饰在生物静默区获得明显的拉曼特征信号,这种比率型的拉曼信号检测方法使体外和活细胞层面的检测结果更为可靠。
2.2 在成像辅助手术治疗中的应用
成像辅助手术,又称术中成像,通过在手术过程中为外科医生提供实时的视觉指导,在现代医疗实践中发挥着至关重要的作用。传统临床成像技术,例如核磁共振成像、计算机断层扫描成像和超声成像,虽然能够在组织穿透深度和解剖学结构上提供更丰富的信息,但在分子层面的理解仍较少。SR-SERS 探针可被设计为具有靶向特定组织或细胞的识别探针。在手术中,这些探针在特定区域产生SERS 信号,可辅助外科医生从分子层面实时区分不同的组织类型。Yang 等[68]探索了一种pH 响应的SERS 策略,用于快速识别胶质瘤边界。该研究制备了一种由银纳米粒子自组装膜组成的传感芯片(图8A),在其表面修饰了pH 响应的SERS 报告基因4-巯基吡啶(4-MPY)。4-MPY 的特征SERS 峰比值在不同pH 条件下呈现规律性的变化。通过活体实验测量组织间液浸润水珠的pH 值能够有效确定胶质瘤的浸润边界(图8B),在最大限度地切除肿瘤组织的同时减少了对正常组织的损伤。

图8 胶质瘤样本组织液提取及用便携式光纤拉曼光谱仪测量其SERS图谱的示意图(A);在小鼠胶质瘤不同位置测得的特征峰比值(I1091/I1580)及其相应的pH值(B)[68]Fig.8 Schematic diagram of the extraction of interstitial fluid of a glioma sample,and its SERS measurement by a portable optical-fiber Raman spectrometer(A);characteristic peak ratios(I1091/I1580) measured at different locations of mouse glioma and its corresponding pH values(B)[68]
2.3 在药物释放监测中的应用
SR-SERS 探针在药物检测和分析中具有重要的应用价值,能够满足低浓度特定目标分子的高灵敏度、高选择性检测。SERS 探针可以集成到药物递送系统中,以监测药物在目标位点的释放情况。Sreedevi等[69]开发了一种模块化的胶束化方法,用于多种疏水性药物的靶向递送。通过监测胶束分子和药物的拉曼特征峰,首次实现了利用SERS技术评估药物形成、细胞摄取和细胞内释放等过程中的临界胶束浓度。这种实时监测确保了药物递送的可控和高效,最大限度地减少了副作用,对药物开发和评价具有重要意义。
3 总结与展望
自1928年拉曼散射被钱德拉塞卡拉·文卡塔·拉曼发现以来,拉曼光谱技术飞速发展,拥有众多分支的刺激响应型SERS技术因其高选择性的增强效果、多目标物同时分析以及多模成像的潜力成为重要的分子医学研究工具,在疾病诊断、成像辅助手术治疗和药物释放监测等方面有着不可替代的地位。然而,从针对临床医学应用的发展来看,SERS探针仍面临以下挑战。
3.1 毒性问题
SR-SERS 探针应用于临床,面临的首要问题是毒性问题。多数SERS 探针依靠贵金属纳米粒子,如金或银纳米粒子实现拉曼信号的增强。为了提高体内拉曼成像的灵敏度,传统SERS探针基底金纳米颗粒通常采用直径大于10 nm 的颗粒,而如此大的金纳米粒子难以在短时间内排出体外,存在纳米材料的毒性隐患,限制了拉曼成像技术的临床转化。基于此,2023年Yu等[70]制备了一种金超团簇拉曼活性基底,该基底兼具显著的SERS活性和超高的排出率(图9)。实验证明这种金超团簇经瘤内注射入实验小鼠体内后,在体内可逐步分解为直径2~3 nm的超小团簇,加快基底材料在体内的代谢过程,四个月的排出率达到73%,其中肝和肾几乎无药物残留,极大地减少了纳米材料滞留体内带来的潜在毒性。机理验证显示这种金纳米超团簇构建组分的小尺寸虽然损害了电磁场增强效应,但由于NIR 共振拉曼染料的高负载和金属超团簇的荧光背景受到很大抑制,超团簇表现出与大金纳米颗粒相当的SERS 活性。此外,选择具有良好生物相容性的基底材料和利用表面修饰增加探针的生物相容性,减少基底可能引起不良反应和对样品生物学特性的影响是目前的主流研究方向。

图9 金纳米粒子与超簇的示意图比较(A);球形和分枝的金超团簇方案作为纳米团簇在肝脏和脾脏中可生物降解和排泄,并在体内进行肿瘤的拉曼成像(B)[70]Fig.9 A schematic comparison of a gold nanoparticle and a supracluster(A);a scheme of spherical and branched gold supraclusters that are biodegradable and excretable as nanoclusters in the liver and spleen and perform in vivo Raman imaging of tumors(B)[70]
3.2 重现性问题
SR-SERS 探针应用于活体检测的重现性易受到探针的分布、组织深度、外界环境触发的探针形态或大小变化等因素影响。因此,保障SERS信号检测结果的一致性和重现性极具挑战。除了控制实验条件、样品制备标准化等解决方法外,设置稳定的内参信号、结合其它检测方法是发展的新方向。例如Feng 等[71]基于缺口金纳米颗粒和聚N-异丙基丙烯酰胺分子设计合成了一种Cu2+响应的探针,利用探针具有的SERS和近红外二区(NIR-Ⅱ)活性,在威尔逊疾病模型动物中实现了肝脏和尿液中Cu2+含量的同时定量检测。探针体系经Cu2+激活后,其NIR-Ⅱ光声信号(PA1250)和SERS 比率信号(I2223/I1378)的强度均与Cu2+含量呈线性关系。利用此特性,该探针排除了单一响应型拉曼成像易受假阳性信号或非特异性摄取的干扰,在活体层面实现了对Cu2+的定量检测,有效提高了检测结果的可靠性。
3.3 穿透深度限制
SR-SERS 探针原理上属于光学成像技术,囿于光与人体生物组织之间的相互作用会导致信号衰减、散射和吸收,SERS信号能够有效检测到的深度受到限制(通常小于1 cm)[72]。这极大限制了对深层病变组织的观察。克服组织穿透性的挑战对于扩大SERS 在深部组织成像和诊断中的适用性至关重要。提高组织穿透的一种方法是使用近红外激发波长。近红外光在生物组织中的散射和吸收减少,从而能够穿透更深(可达到数厘米)[73-74]。此外,利用光纤系统,研究人员可将激发光传送到感兴趣的组织部位,并从组织部位直接收集拉曼信号。该方法可以利用微创操作抵达传统方法不易到达的组织部位[75-79]。另外,将SERS与光学相干断层扫描、磁共振成像或超声等其他成像模式相结合,可以提供互补的组织层结构信息[27,80-82]。这种技术的集成有助于引导SERS测量到目标区域,提高信号检测的准确性。同时,通过分析体外或表面样品,例如血液、尿液、汗液、皮肤,也是绕开组织穿透深度限制的一种方法[83]。
未来SR-SERS 探针在分子医学领域的发展将集中在实现快速精准的诊疗一体化,随着材料科学、化学、生物和医学等多学科交叉领域研究人员之间的合作,突破现有材料毒性、重现性和穿透深度等SR-SERS检测技术的局限,将为SR-SERS探针的进一步临床转化带来可能。
