铜胁迫对人参生理参数和品质的影响研究
2024-01-20代鸣涛郝甜甜丁万博许永华
代鸣涛 梁 佳 郝甜甜 丁万博 杨 鹤 许永华
(人参新品种选育与开发国家地方联合工程研究中心,吉林 长春 130118)
人参(PanaxginsengC.A.Meyer)为五加科人参属多年生宿根性草本植物,具有固脱生津、补气养血等多种功效,被称为“百草之王”[1]。人参国内产地主要分布于我国东北地区,是吉林省重要经济作物[2]。人参是药食两用产品,2020年版《中华人民共和国药典》[1]规定人参铜含量不得超过20 mg·kg-1,GB 15199-94《食品中铜限量卫生标准》[3]规定食品中铜的含量应≤10 mg·kg-1,2014年,《全国土壤污染状况调查公报》[4]显示我国16.1%的土壤受到不同程度污染,其中铜污染物点位超标率达2.1%。特别是近些年来高铜农药和肥料的大量使用和工业三废排放导致部分农田土壤铜污染严重[5]。正常情况下植物体内铜含量为5~30 mg·kg-1[6]。有研究发现,过量铜会导致辣椒(Capsicum annuumLinn.)发育不良,表现为各器官鲜重下降[7]。外源施加铜浓度为100 mg·kg-1时,空心菜(Ipomoea aquaticaForssk.)株高最大,当铜浓度继续增加至超过铜毒性阈值时,其根系最先受损,吸水能力变差,后伴随植株干枯、新叶皱缩卷曲、生物量严重降低等现象[8]。因此,全面了解土壤与植物中的铜含量对植物生长发育的影响对解决全球作物产量问题有重大意义。
植物通过各种吸收、运输和抗氧化防御过程来抵抗铜的损伤。重金属胁迫下,植物通过启动抗氧化系统来清除体内多余的活性氧(reactive oxygen species,ROS)。研究证明,铜能够提高编码不同抗氧化剂,如过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)的基因转录水平[9]。在不同浓度铜(0.5、1、1.5、2 mmol·L-1)处理下,葡萄根系中的POD、SOD 和CAT 活性均随浓度的增加先上升后下降[10]。同时细胞壁也是响应重金属胁迫信号分子和代谢所在的位点,也是铜积累的主要场所,并参与植物对重金属胁迫的响应过程[11]。有报道指出,苹果植株将所吸收的大部分Cu2+固定在根系细胞壁和液泡中,并将其转化为难溶性磷酸盐或草酸盐态等低毒或无毒化合物从而缓解Cu2+毒害[12]。木质素是细胞壁的重要组成成分,有研究表明,在生物与非生物胁迫下,植物的普遍反应之一是活性氧的积累[13],并伴随有木质素含量的增加[14]。本研究通过分析不同浓度铜处理后人参抗氧化系统和木质素含量及其酶活变化情况,旨在提高人参在生长发育期间的抗逆性,为今后人参栽培解除铜毒害提供依据。
1 材料与方法
1.1 试验材料
试验材料为三年生人参种苗,采于吉林农业大学药园,在吉林农业大学温室人工气候室中进行水培试验。
1.2 试验设计
选择大小、鲜重基本一致且无病害的三年生人参种苗,每个水培管中加入1.5 L 1/2 Hoagland 营养液,于2023年2月22日开始水培培养。培养10 d 后挑选长势一致弓形幼苗进行铜胁迫处理,CuSO4浓度分别为0、50、150、300 和500 µmol·L-1,记为CK、A1、A2、A3和A4。处理期间每3 d更换一次营养液,每天通氧6 h,光照培养室中昼夜条件为14 h/10 h,温度为20 ℃,于处理21 d时取样,每个处理5次重复。
1.3 测定项目与方法
1.3.1 人参不同部位铜含量的测定及亚细胞定位铜含量采用iCAP Q 三重四极杆电感耦合等离子质谱仪(美国Thermo 公司)测定[15]。称取0.4 g 在-80 ℃贮存的冷冻组织,用研钵研磨成粉末,并在预冷提取缓冲液(成分包括50 mmol·L-1Tris-HC1、250 mmol·L-1蔗糖、5 mmol·L-1抗坏血酸、1.0 mmol·L-1二硫赤藓醇,pH值7.5)中均匀化。采用差速离心法将不同组织的亚细胞分离为细胞壁组分、可溶性组分(含液泡组分)和细胞器组分。将匀浆液于4 000 r·min-1离心15 min。第一批残渣主要是细胞壁组分。上清液在16 000 r·min-1下进一步离心30 min。其残渣为细胞器组分,上清液为可溶性组分。所有步骤均在4 ℃下进行。将不同组分在145 ℃下用HNO3∶HCIO4(V∶V,2∶1)的氧化酸混合物进行消解。待消解完毕,用去离子水定容至50 mL。最后使用三重四极杆电感耦合等离子体质谱仪测定不同亚细胞组分中的铜含量。
1.3.2 丙二醛含量的测定 丙二醛含量测定采用硫代巴比妥酸法[16]。
1.3.3 过氧化氢含量的测定 过氧化氢含量的测定采用苯酚-硫酸肽法[16]。
1.3.4 抗氧化酶活性的测定 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的测定参照《植物生理学实验指导》[17]。
1.3.5 木质素含量的测定及木质素染色 木质素含量测定采用紫外分光光度法[18]、木质素染色采用间苯三酚法。
1.3.6 木质素合成途径相关酶活性的测定 苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)活性采用李孟园[19]的方法进行测定,漆酶(laccase,LAC)活性采用刘清泉[20]的方法进行测定。
1.3.7 总皂苷含量的测定 参照2020年版《中华人民共和国药典》[1]测定总皂苷含量。
1.4 数据处理
采用Excel 2021 进行初步统计,再利用SPSS 23 软件对数据进行单因素方差分析(ANOVA),采用Duncan’s 法进行多重比较,结果用平均值±标准差表示,P<0.05 表示差异显著。采用Graphpad Pism9.5 软件绘图。
2 结果与分析
2.1 铜胁迫对人参生长的影响
由图1 可知,随着Cu2+胁迫程度的增强,地上地下部分干重和鲜重均出现下降趋势,以500 µmol·L-1CuSO4处理(A4)降幅最大。与对照组(CK)相比,50 µmol·L-1CuSO4处理(A1)各指标及150 µmol·L-1CuSO4处理(A2)地下部分干重均无显著差异;其余组地上部分鲜重分别显著下降了11.60%、50.78%和63.00%,地下部分鲜重分别显著下降7.13%、27.52%和45.43%,地上部分干重分别显著下降12.03%、40.52%和53.53%;300(A3)和500 µmol·L-1CuSO4处理地下干重分别显著下降了43.41%和47.67%。
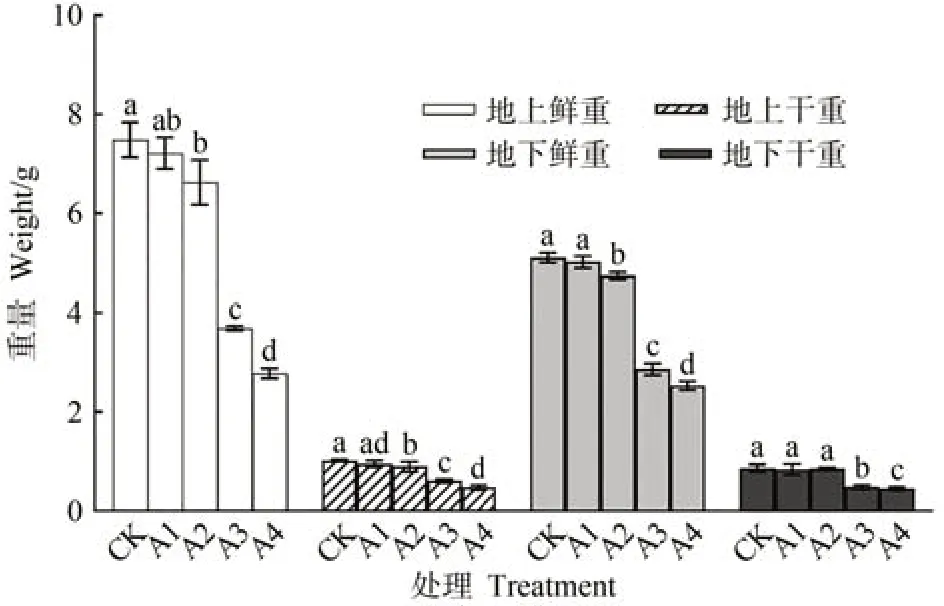
图1 不同浓度铜胁迫对人参干重鲜重的影响Fig.1 Effect of different concentrations of copper stress on the dry and fresh weight of P.ginseng
Cu2+胁迫对人参生长的影响见图2,对照组人参生长良好,叶片开展充分,叶面平滑,CuSO4处理浓度大于300 µmol·L-1时,人参生长受到明显抑制。与CK 相比,300 和500 µmol·L-1CuSO4处理茎长缩短,叶片开始出现皱缩现象(图2-A)。通过根部石蜡切片观察发现,对照组人参根表皮细胞形态结构正常,表皮细胞和韧皮部细胞结构正常,界限分明,表皮细胞排列紧密(图2-B)。但500 µmol·L-1CuSO4处理组人参根部细胞排列松散,部分薄壁细胞出现明显被破坏情况(图2-C)。
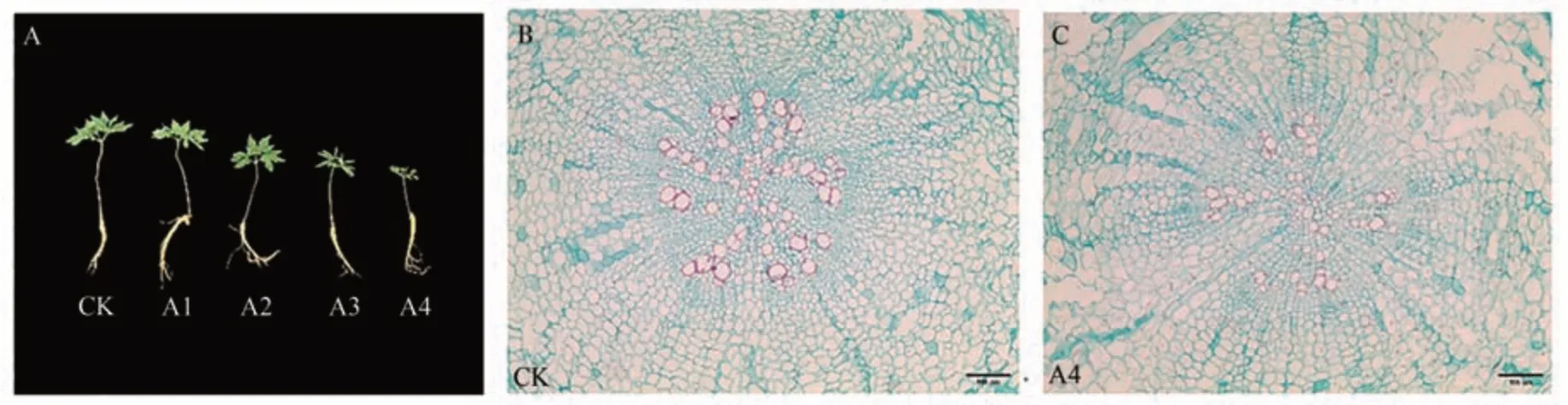
图2 不同浓度铜胁迫对人参生长的影响Fig.2 Effects of copper stress at different concentrations on the growth of P.ginseng
2.2 人参不同部位铜含量及亚细胞定位
不同浓度铜处理21 d后人参各部位铜含量及细胞壁所富集铜含量见表1。结果表明,铜胁迫整体显著增加了人参各部位铜含量,且人参根茎叶铜含量均与处理浓度呈正相关并存在浓度依赖性。随着Cu2+浓度增加,人参根茎叶中铜含量均出现上升趋势。其中人参根茎叶中铜含量在500 µmol·L-1CuSO4处理时较对照增幅高达784.66%、739.40%和1 103.06%。根部各处理细胞壁中铜含量占总铜含量的48.85%、55.27%、57.73%、38.44%和32.77%。茎部各处理细胞壁中铜含量占总铜含量的37.65%、30.18%、43.33%、25.15%和28.82%。叶部各处理细胞壁中铜含量占总铜含量的27.06%、38.30%、37.24%、21.47%和32.61%。
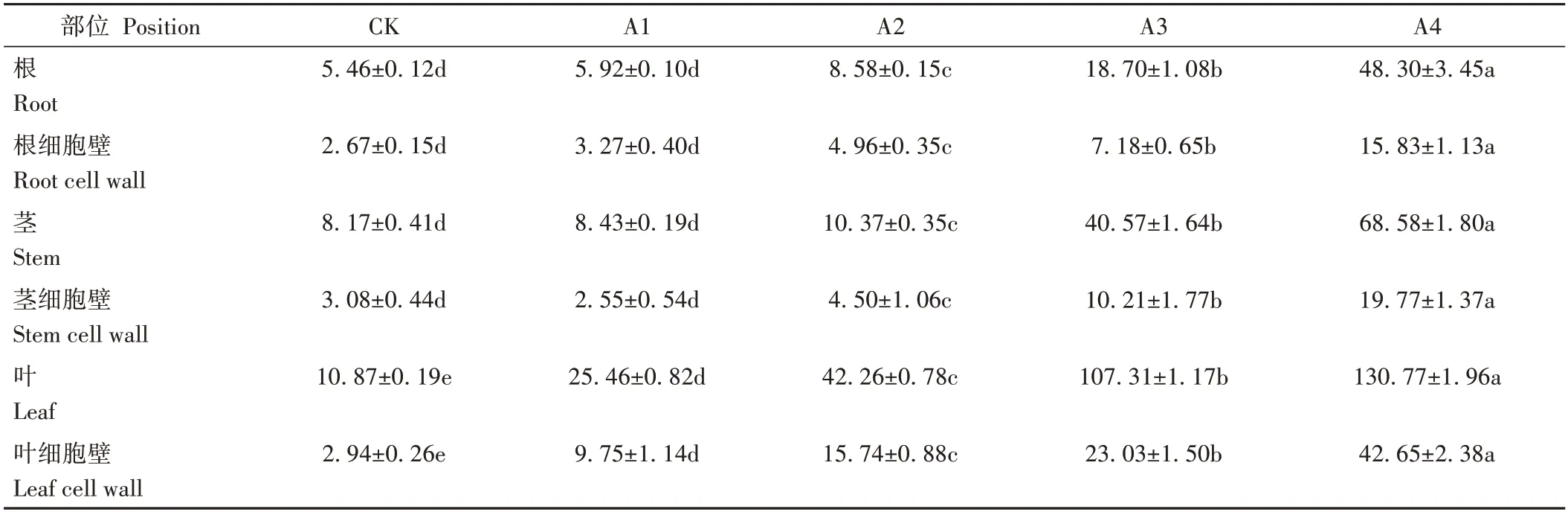
表1 人参不同部位铜含量及亚细胞定位Table 1 Determination of copper content and subcellular localization in different parts of P.ginseng
2.3 不同浓度铜处理对人参各部位丙二醛及过氧化氢含量的影响
由图3可知,人参各部位MDA和过氧化氢含量均随铜处理浓度的增加而上升,以500 µmol·L-1CuSO4处理最高。500 µmol·L-1CuSO4处理人参根和叶MDA含量分别是CK 的2.65 和1.96 倍;300 µmol·L-1CuSO4处理茎MDA含量是CK的2.18倍;根茎叶过氧化氢含量在500µmol·L-1CuSO4处理分别是CK的3.00、1.08和1.88倍。
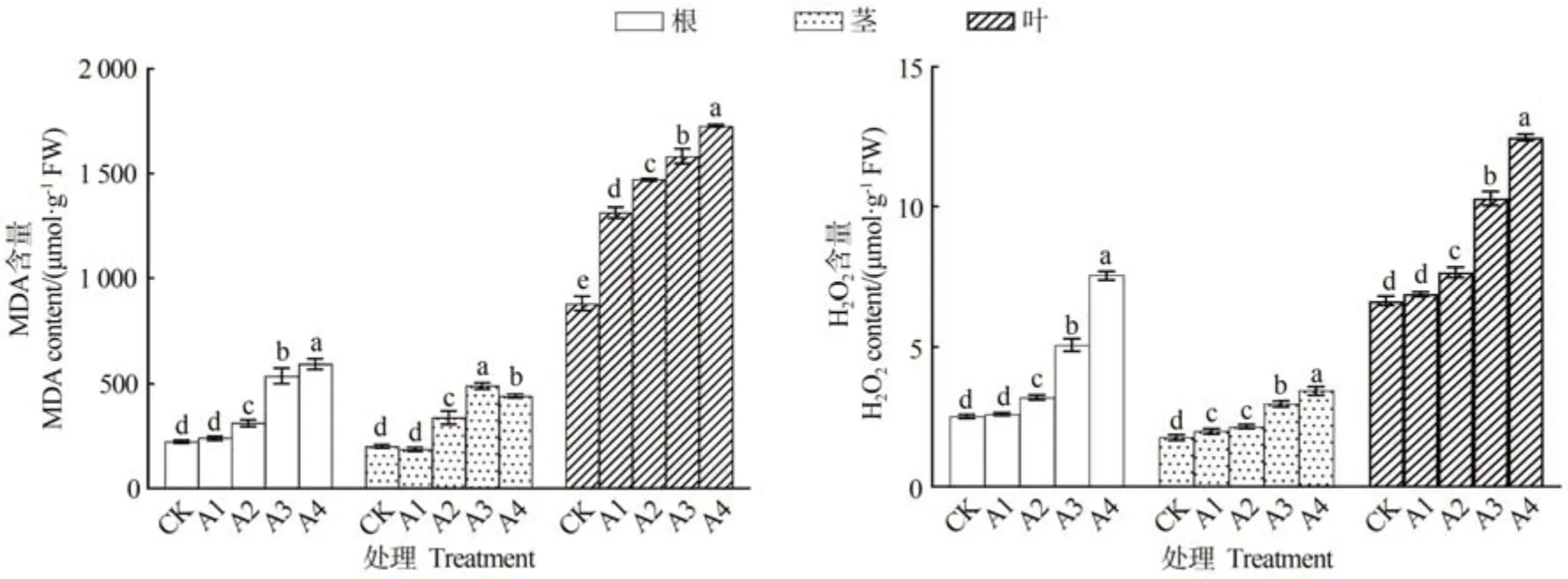
图3 不同浓度铜处理对人参各部位丙二醛及过氧化氢含量影响Fig.3 Effects of copper treatment with different concentrations on malondialdehyde and hydrogen peroxide contents in different parts of P.ginseng
2.4 不同浓度铜处理对人参各部位抗氧化酶活性的影响
由图4-A 可知,随着铜胁迫程度的增加,SOD 活性呈现先升高后降低的趋势,根和叶SOD 活性在150 µmol·L-1CuSO4处理最强,茎则在300 µmol·L-1CuSO4处理时活性最强。与对照组相比,150 µmol·L-1CuSO4处理根和叶SOD 活性较对照分别显著上升了61.72% 和32.67%。300 µmol·L-1CuSO4处理茎部SOD 活性较对照显著上升了16.42%,500 µmol·L-1CuSO4处理SOD活性则显著下降了13.83%。

图4 不同浓度铜处理对人参抗氧化酶活性的影响Fig.4 Effect of copper treatment with different concentrations on P.ginseng antioxidant enzymes
由图4-B 可知,人参各部位POD 活性随着铜胁迫程度的增大整体呈现先上升后下降趋势,根和叶在300 µmol·L-1CuSO4处理时活性最强,茎在50 µmol·L-1CuSO4处理时活性最强。300 µmol·L-1CuSO4处理根和叶POD 活性分别较对照显著上升19.39%和36.64%。50 µmol·L-1CuSO4处理茎POD 活性较对照显著上升150.78%。
由图4-C可知,各部位CAT活性均在300 µmol·L-1CuSO4处理时达到最高。人参根中CAT活性随着铜胁迫程度的增大呈现先下降后上升再下降趋势。500 µmol·L-1CuSO4处理根中CAT 活性较对照显著下降24.39%,300 µmol·L-1CuSO4处理CAT 活性较对照显著上升13.78%。人参茎中CAT 活性随着铜胁迫程度的增大呈现先上升后下降趋势,其中300 µmol·L-1CuSO4处理CAT 活性较对照显著升高34.48%,500 µmol·L-1CuSO4处理CAT 活性较对照显著下降15.88%。人参叶中CAT 活性随着铜胁迫程度的增大呈现先降低后上升再下降的趋势,其中500 µmol·L-1CuSO4处理CAT活性较对照显著降低16.07%,300 mol·L-1CuSO4处理CAT活性较对照显著上升17.78%。
2.5 不同浓度铜胁迫对人参各部位木质素含量的影响
由图5-A、B 可知,人参根切片染色结果表明,500 µmol·L-1CuSO4处理人参根中木质素的积累量较CK 组增加。铜胁迫下中央大维管束(包括厚壁组织、木质部和维管柱)木质化组织的面积占比较对照组有所增加。说明铜胁迫处理可以诱导人参根部木质素含量的积累,同时木质化的区域也有明显增加。
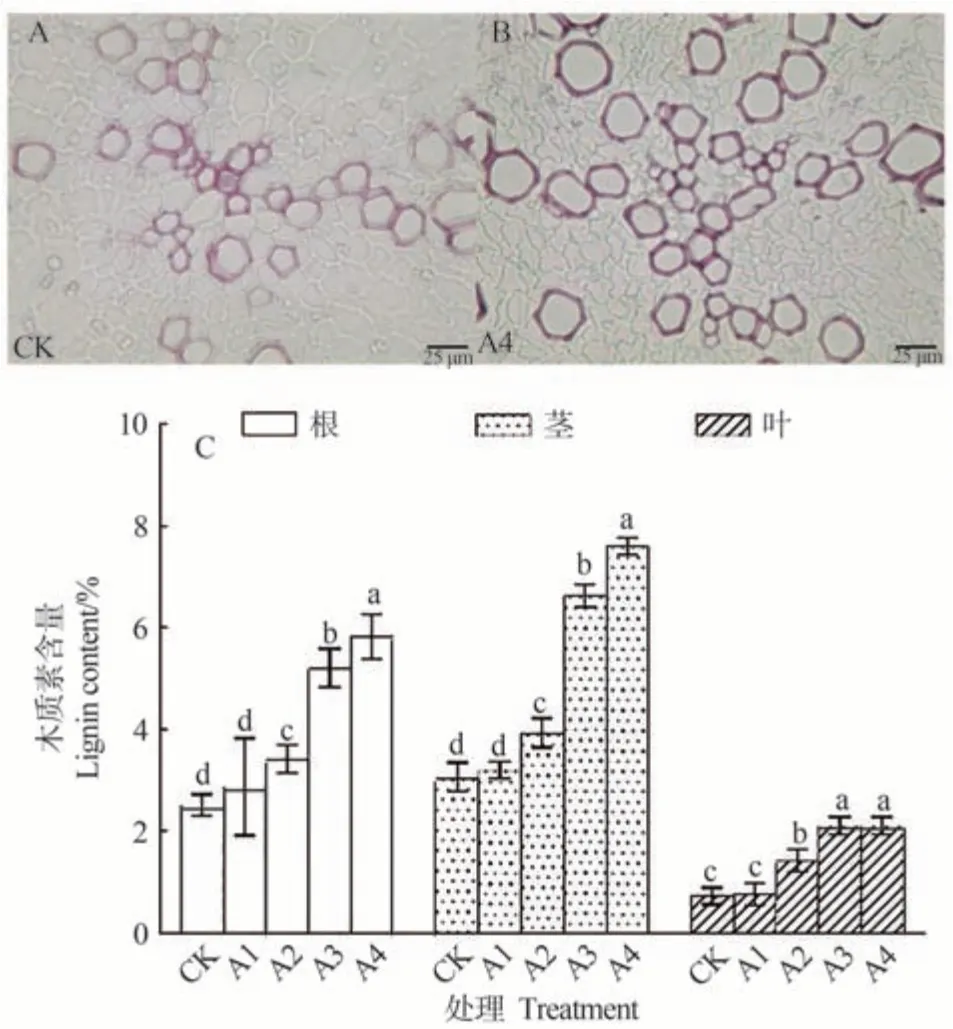
图5 不同浓度铜处理对人参木质素含量的影响Fig.5 Effect of copper treatment with different concentrations on the lignin content of P.ginseng
由图5-C 可知,人参各组织中木质素含量整体较对照显著增加,均在500 µmol·L-1CuSO4处理时含量最高。500 µmol·L-1CuSO4处理根茎叶中木质素含量分别较对照显著升高131.88%、131.88%和190.00%。同一浓度下,人参茎和根中的木质素含量高于叶,且在胁迫处理下表现出了更加大幅的沉积。
2.6 不同浓度铜处理对木质素相关合成酶活性的影响
由图6-A 可知,与CK 相比,铜胁迫显著提高了人参各部位PAL活性,各部位均以500 µmol·L-1CuSO4处理活性最强。500 µmol·L-1CuSO4处理根茎叶中PAL活性分别是CK 的3.07、4.55 和1.79 倍。叶片中PAL活性低于根和茎,可能与木质化程度有关。
由图6-B 可知,铜胁迫可以提高人参各部位CAD活性,均以500 µmol·L-1CuSO4处理时的活性最强。500 µmol·L-1CuSO4处理根茎叶CAD 活性分别是CK的2.07、7.93和2.42倍。
由图6-C 可知,铜胁迫可以提高人参各部位LAC活性,均以500 µmol·L-1CuSO4处理时的LAC 活性最强。50 µmol·L-1CuSO4处理根和茎LAC 活性与CK 无显著差异。人参各部位LAC活性在50 µmol·L-1CuSO4处理时分别是CK 的1.32、1.16 和1.17 倍。此外,茎的LAC活性始终高于根部和叶片。
2.7 不同浓度铜处理对人参总皂苷含量的影响
由图7 可知,随着铜处理浓度的增加,人参根和叶总皂苷含量呈现先上升后下降的趋势,低浓度时促进总皂苷合成,高浓度则抑制总皂苷合成。与对照相比,50、150 和300 µmol·L-1CuSO4处理叶总皂苷含量分别显著上升了39.34%、57.28%和42.79%,500 µmol·L-1CuSO4处理显著下降了23.95%;50 和150 µmol·L-1CuSO4处理根总皂苷含量分别显著上升了28.27%和61.69%,300 和500 µmol·L-1CuSO4处理显著下降了21.94%和43.70%。
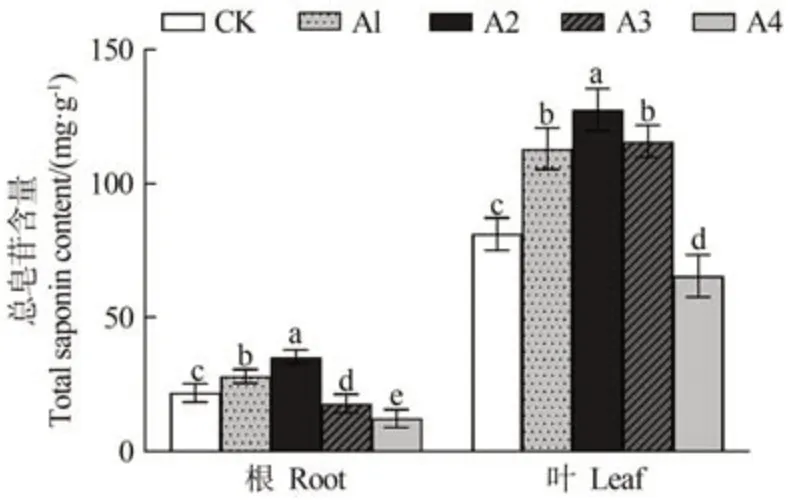
图7 不同浓度铜处理对人参总皂苷含量的影响Fig.7 Effect of copper treatment with different concentrations on the total saponin P.ginseng
3 讨论
3.1 不同水平铜胁迫对人参生长的影响
铜虽然是植物必需微量营养元素,对植物的生长发育至关重要,但在高浓度下对植物有毒害作用,铜离子的毒性主要是由Cu(Ⅰ)和Cu(Ⅱ)较易相互转变引起的[21]。有研究表明,高浓度铜胁迫显著抑制了小麦种子的萌发及幼苗的生物量、根长和叶绿素含量[22]。本研究结果表明,铜处理浓度增加使人参根茎叶中铜含量升高,铜胁迫对人参的毒害作用体现在高浓度会抑制人参的生长发育,表现为株高、地上部和地下部干重鲜重降低,且抑制程度随铜浓度的增加而不断加深。同时在光学显微镜下观察人参根部切片发现,高浓度铜胁迫会造成人参根部薄壁细胞松散、数量减少甚至破碎现象,充分证明高浓度铜胁迫会造成人参幼苗生长发育缓慢甚至死亡。
3.2 不同水平铜胁迫对人参各部位铜含量、铜亚细胞分布的影响
细胞壁结合Cu2+,抑制Cu2+在细胞质中的积累,是铜胁迫下植物的重要防御机制。亚细胞定位表明,大部分Cu2+位于外质体,特别是细胞壁,只有少量的Cu2+存在于原生质体中[23]。也有研究证明许多类型的植物通过将重金属结合到细胞壁上来减轻重金属胁迫[11]。本研究发现,随着铜离子浓度增加,人参各部位铜含量也随之增加,人参根部细胞壁铜含量最多可占根部总铜含量的55.27%,这可能是由于细胞壁中木质素等成分可以提供羧基等官能团,这些官能团可以吸附固定Cu2+,致使大部分Cu2+停留在细胞壁,从而缓解铜对细胞造成的伤害。
3.3 不同水平铜胁迫对人参抗氧化酶活性的影响
铜胁迫可诱导细胞产生大量活性氧,导致膜脂质过氧化,质膜选择透性降低,细胞内含物质外渗,丙二醛(MDA)含量升高,同时损伤光合细胞器,进而影响植物物质交换、光合作用等各种生理代谢过程的正常运行[23]。本研究显示,随着铜处理浓度的升高,人参根茎叶H2O2和MDA 含量整体显著升高,SOD 和POD活性则整体呈现先上升后降低的趋势,值得注意的是,茎和根中POD 活性高于叶,这可能是由于作为催化木质素生物合成最后一步反应的酶,过氧化物酶在此过程中起到的作用多样化。CAT 虽然能特异清除H2O2,但其与H2O2的亲和性并不高,因此CAT 活性在50µmol·L-1CuSO4处理反而下降,这与黄长干[24]的研究结果一致。
3.4 不同水平铜胁迫对人参木质素含量及其合成酶活性的影响
木质素作为细胞壁的组成部分,是植物组织和器官中最丰富的化合物[25]。木质素沉积为细胞壁提供了额外的强度和不透水性,可以保护植物组织免受损伤[26]。细胞壁木质化与植物对非生物胁迫的抵抗力有关[27]。本研究发现,铜胁迫在超过50 µmol·L-1CuSO4处理后显著促进了人参根茎叶中木质素的积累,且呈浓度依赖性。此外,Kovac 等[28]研究证实细胞壁中的木质素沉积增强了植物对铜毒性的耐受性,同时发现铜诱导的萝卜根尖中的木质素沉积可以防止木质部导管吸收外来有害物质。由此推测,在本试验中,铜胁迫促进木质素合成有利于铜固定在细胞壁上,从而减轻铜对人参细胞的毒性。合成木质素的苯丙素代谢途径对促进植物生长并增强其胁迫耐受性具有重要意义[29]。本研究发现,不同浓度铜胁迫促进了木质素合成,同时木质素合成途径上的相关酶活性上升,这是由于铜胁迫条件下刺激相关基因如TaPAL、Ta4CL、TaCAD和TaLAC的表达[30]。有研究表明上述几种酶活性的增加介导了铜胁迫小麦幼苗叶片和根细胞壁的木质化增强[14],与本试验结果一致。
3.5 不同水平铜胁迫对人参总皂苷含量的影响
三萜人参皂苷是人参的重要次生代谢产物,当生长环境的光照、温度、水分和营养等条件发生变化或受到外来侵害时,人参和西洋参等植物会通过调节体内的皂苷含量来应答这些环境胁迫[31]。有研究表明,铜和镉复合胁迫降低了三七中总酚、黄酮和皂苷含量[32]。本研究中,在低浓铜胁迫时,根和叶总皂苷含量随浓度增加呈上升趋势,在150 µmol·L-1CuSO4处理达到最大值,随后开始下降。最佳防御假说从植物生理学的角度很好地解释了这一现象,即植物在胁迫环境下生长缓慢,植物受损的补偿能力较差,而产生次生代谢产物的成本相对较低,次生代谢产物的防御收益增加,因此,植物在环境胁迫下将产生较多的次生代谢产物[33]。但因浓度过高时,细胞受损比较严重,总皂苷含量较空白组出现显著下降。
4 结论
本研究结果表明,铜胁迫抑制了人参幼苗的生长,降低了人参干重鲜重,破坏了细胞正常结构,与对照相比,低浓度时总皂苷含量显著上升,高浓度总皂苷含量显著下降。另一方面,人参各部位铜含量随着铜处理浓度的增加而显著上升,且铜离子主要分布在细胞壁中。人参通过激活抗氧化酶活性、提高非抗氧化酶活性来清除ROS 并降低膜脂过氧化水平;由于铜主要分布在细胞壁中,导致人参各部位木质素含量上升,从而增加人参抗性。综上,铜处理会增强人参抗氧化系统和增加木质素含量,同时生产上应限制高铜农药和肥料的过度使用。
