优质同源四倍体菜心新材料的创制及特性分析
2024-01-20荆禹铭嵇乐乐李孟杰张彦文侯喜林刘照坤刘同坤
荆禹铭 嵇乐乐 李孟杰 张彦文 侯喜林 李 英 刘照坤 刘同坤,*
(1南京农业大学作物遗传与种质创新全国重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室/园艺作物种质创新与利用教育部工程研究中心,江苏 南京 210095;2苏州市农业科学院,江苏 苏州 215000)
不结球白菜[Brassicacampestris(syn.Brassicarapa)ssp.chinensis],原产中国,古名“菘”,又称小白菜、青菜、青梗菜[1],在长江中下游地区占蔬菜总复种面积的30%~40%[2]。不结球白菜主要分为普通白菜、乌塌菜、菜心、菜薹等6个变种,其中菜心又称广东菜、菜花、薹心菜等[3],以嫩叶和嫩薹为主要食用部分。近年来,菜心的产业化布局快速发展,菜心逐渐成为一种全国性的大宗蔬菜[4]。
蔬菜多倍体种质创制是培育优质高产蔬菜新品种的重要途径,为蔬菜性状的遗传改良与种质创新提供了新思路[5]。多倍体植物由于染色体组加倍,往往具有器官巨大、可孕性低、生活能力强、内含物多、抗逆性强、耐贮运等特点[6]。而多倍体育种则是指利用人工处理使植物染色体组加倍从而获得多倍体材料,由于其诱导方法较简单,育出的品种经济价值高,还可有效克服远缘杂交不亲和等特点,因此应用较为广泛[7]。目前,多倍体诱导方式主要分为物理诱导、化学诱导、生物诱导三类,物理诱导主要有电离辐射、改变温度等方式,但由于其操作较为复杂,诱导率较低,且嵌合体多,会对植株有较大的生理损伤等缺点[8],目前应用较少;而化学诱导应用最为广泛,主要采用安磺灵、二甲戊灵、甲基胺草磷以及秋水仙素等化学诱变剂处理,通过与分裂细胞的微管蛋白结合,使细胞有丝分裂中断,从而实现细胞的染色体加倍[9-10]。其中,使用秋水仙素诱导多倍体具有诱导率高、对植株伤害小、处理方式较为简便等优点,被广泛应用于大蒜[11]、月季[12]、黄瓜[13]、西瓜[14]等育种。
菜心因其品质脆嫩、营养丰富、适应性强、生长期短、可周年供应等特点,深受广大消费者和生产者的喜爱[15]。但目前菜心的生产种植仍面临着多种问题,如推广品种在蔬菜品质性状与营养性状方面无法满足生产和市场的需求,长期种植单一品种导致出现品种退化、品质下降的现象,开展育种工作时优质遗传资源不够丰富等[16]。因此,创制具有优良性状的菜心材料,丰富菜心种质资源,对菜心产业的发展具有重要意义。目前,利用秋水仙素处理诱导已经在不结球白菜苏州青[17]、矮脚黄[18]等品种上取得成功,但鲜见应用于菜心。本研究采用秋水仙素诱导创制四倍体菜心新种质,以期获得营养丰富、优质丰产的同源四倍体菜心新材料,旨在为培育优质、高产的菜心提供新材料。
1 材料与方法
1.1 试验材料
本试验所用材料为菜心LCX017(2n=2x=20),由南京农业大学园艺学院白菜系统生物学实验室提供。试验于2021年9月—2023年5月在南京农业大学白马教学科研基地进行。
1.2 四倍体菜心LCX017诱导方法
参考赵建华等[19]的方法,待二倍体幼苗子叶完全伸展后,用0.2%(W/V)的秋水仙素溶液点滴幼苗子叶生长点,于每天9∶00 和17∶00 各处理1 次,共处理5次,每次20 µL,对照组用蒸馏水处理。
1.3 多倍体的鉴定方法
1.3.1 形态学鉴定 以同期生长的二倍体菜心LCX017植株作为对照,对诱变植株的形态进行初步的肉眼鉴定,观察诱变植株的株型、生长势、开展度、叶片形状、叶色、花器官形态等形态学变化,若有明显差异,则鉴定为疑似多倍体植株。
1.3.2 解剖学鉴定 选取同时期的二倍体植株以及疑似四倍体植株的完全开展叶片,避开叶脉部分用胶带撕取叶片部分下表皮,用刀片去除或用流水冲掉多余的叶肉细胞,置于光学显微镜下观察二者气孔大小及密度是否有差异;花粉鉴定时,在晴天上午选取同花期下二倍体和疑似四倍体植株花粉,将其均匀涂抹在载玻片上,置于光学显微镜下观察二者有无形态及大小差异。
1.3.3 细胞学鉴定 参考王炜等[20]的方法,将疑似四倍体植株的种子置于铺有滤纸的培养皿中催芽,待根长1~1.5 cm时切取根部置于4 ℃、0.002 mol·L-1的8-羟基喹啉溶液中浸泡3~3.5 h,蒸馏水洗净后,加入卡诺固定液于4 ℃冰箱固定9 h 左右,洗净,加入1 mol·L-1盐酸于60 ℃下水浴锅中解离4 min,洗净,切取根尖1~2 mm,用改良石碳酸复红染液染色7 min,制片,在DM6B正置荧光显微镜(Leica,德国)下观察拍照。
1.3.4 流式细胞仪倍性分析 参考罗庆等[21]的方法,选取二倍体以及疑似四倍体植株的新鲜幼嫩叶片,避开叶脉,称取约0.1 g 叶片,每组设置3 个重复,平铺在-20 ℃预冷过的培养皿上,加入4 ℃环境下事先配置好的解离液1~2 mL[5 mmol·L-14-羟乙基哌嗪乙磺酸(hepesfreeacid,HEPES)、50 mmol·L-1KCl、10 mmol·L-1MgSO4·7H2O、0.25%(V/V)Triton X-100(聚乙二醇辛基苯基醚,ethylancp)、1% 聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)配制而成,调节解离液pH 值至8.0,置于4 ℃冰箱保存备用],然后用预冷过的刀片迅速切碎,随后用500目纱布过滤至1.5 mL离心管中,向离心管中加入35 µL 的碘化丙啶染色液(propidium iodide,PI),再加入10 mg·mL-1RNase 10 µL。充分混匀,静置于冰上避光染色15 min后,使用CytoFLEX 流式细胞仪(Beckman Coulter,美国)检测其DNA含量。
1.4 二、四倍体菜心LCX017农艺性状统计
将被鉴定为同源四倍体的M0代菜心植株蕾期及花期套袋自交,单株收种,将M1代种子与对照二倍体种子同期播种定植。随机选取长势良好、无病虫害的二、四倍体植株各10株,对其株高、开展度、叶片数、叶长、叶宽、十叶厚、叶柄长、叶柄宽、叶柄厚等农艺性状进行测量与统计。
1.5 二、四倍体菜心LCX017营养品质测定
随机选取生长时期相同、长势良好的二、四倍体植株各3 株,避开叶脉,取每株植物较为靠近生长点的叶片,测量可溶性糖、可溶性蛋白、纤维素、叶绿素、有机酸以及硝态氮含量等营养指标。可溶性糖含量测定采用蒽酮比色法,使用植物可溶性糖含量检测试剂盒(BC-0030,北京索莱宝科技有限公司);可溶性蛋白含量测定采用考马斯亮蓝G-250 染色法,使用Bradford法蛋白浓度测定试剂盒(PC0010,北京索莱宝科技有限公司);纤维素含量测定使用纤维素(cellulose,CLL)含量检测试剂盒(BC4208,北京索莱宝科技有限公司);叶绿素含量采用丙酮乙醇提取法测定;有机酸含量测定采用维生素C(vitamin C,Vc)/抗坏血酸含量测试盒(A009-1-1,南京建成生物工程研究所);硝态氮含量测定使用植物硝态氮含量检测试剂盒(BC1505,北京索莱宝科技有限公司)。
1.6 二、四倍体菜心LCX017光合特性分析
参考杨航等[22]的方法,在晴朗的白天,采用LI-6800 便携式光合作用测量系统(LI-COR,美国)进行测定,使用CO2钢瓶为反应提供CO2,设置CO2浓度为400 µmol·mol-1,测定其在0、10、30、50、70、100、150、200、400、600、800、1 200、1 600、1 800、2 000 µmol·m-2·s-1光照强度下单位面积叶片的净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2concentration,Ci),随机在二、四倍体中各选取3 株植株,取位置、大小近似的叶片进行测定。参考王雪等[23]使用的非直角双曲线模型公式进行光合曲线拟合,根据拟合结果求得光饱和点(light saturation point,LSP)、光补偿点(light compensation point,LCP)、最大净光合速率(maximun net photosynthetic rate,Pmax)、暗呼吸速率(dark respiration rate,Rday)、表观量子效率(apparent quantum yield of photosynthesis,AQY)等光合指标。
1.7 数据分析
利用Excel 2021 软件对所得数据进行整理,采用SPSS Statistics 25 软件对试验数据分析并进行独立样本t检验,分析样本数据的差异显著性。
2 结果与分析
2.1 二、四倍体菜心LCX017倍性鉴定
2.1.1 形态学鉴定 由图1可见,与二倍体相比,同源四倍体植株株型以及开展度变大(图1-A);幼苗较小,叶片数较少,根系相对短小(图1-B);叶片叶长缩小,叶宽增大,叶片长宽比变小,叶片形状近圆形(图1-C);四倍体花器官整体变大,萼片、花瓣、雄蕊、雌蕊均明显变大(图1-D、E);种子直径略微增大,种荚由细长变至粗短(图1-F、G);菜薹变得更加粗壮,直径明显变大(图1-H、I)。

图1 二、四倍体菜心LCX017形态学比较Fig.1 Morphological comparison of diploid and tetraploid plants of Chinese flowering cabbage LCX017
2.1.2 解剖学鉴定 在解剖学方面,通过对二、四倍体植株叶片气孔进行上镜观察发现,四倍体植株叶片气孔孔径更大,保卫细胞长度、宽度明显增大,而单位面积上的气孔密度相比二倍体植株有所下降(图2-A、B);对二、四倍体盛花期的花粉进行上镜观察,发现二倍体植株花粉粒呈现出较为规则的长椭圆形(图2-C),四倍体植株花粉粒相较于二倍体略大(图2-D),且呈现出棒状、橄榄形等多种不规则的形状。
2.1.3 细胞学鉴定 将经过形态学鉴定的疑似四倍体植株蕾期单株套袋自交授粉,选取部分收到的种子进行催芽处理,并制成根尖染色体切片,在显微镜下观察根尖染色体数目。由图3 可知,对照组的二倍体根尖染色体数目为2n=2x=20,而同源四倍体的染色体数目为2n=2x=40。
2.1.4 流式细胞仪鉴定 为了进一步确定同源四倍体植株,利用流式细胞仪测定二、四倍体植株的DNA含量,得到DNA含量的分布曲线图。由图4可见,纵坐标为细胞数目,横坐标为DNA 含量荧光强度,图中第一个峰值代表G1期的DNA 相对含量,而第二个峰值则代表G2期的DNA 含量。由图4 可知,二倍体G1期的相对荧光强度约为25,而同源四倍体的G1期的相对荧光强度则为50左右,大约为二倍体植株的2倍,进一步证实了该植株为四倍体植株。
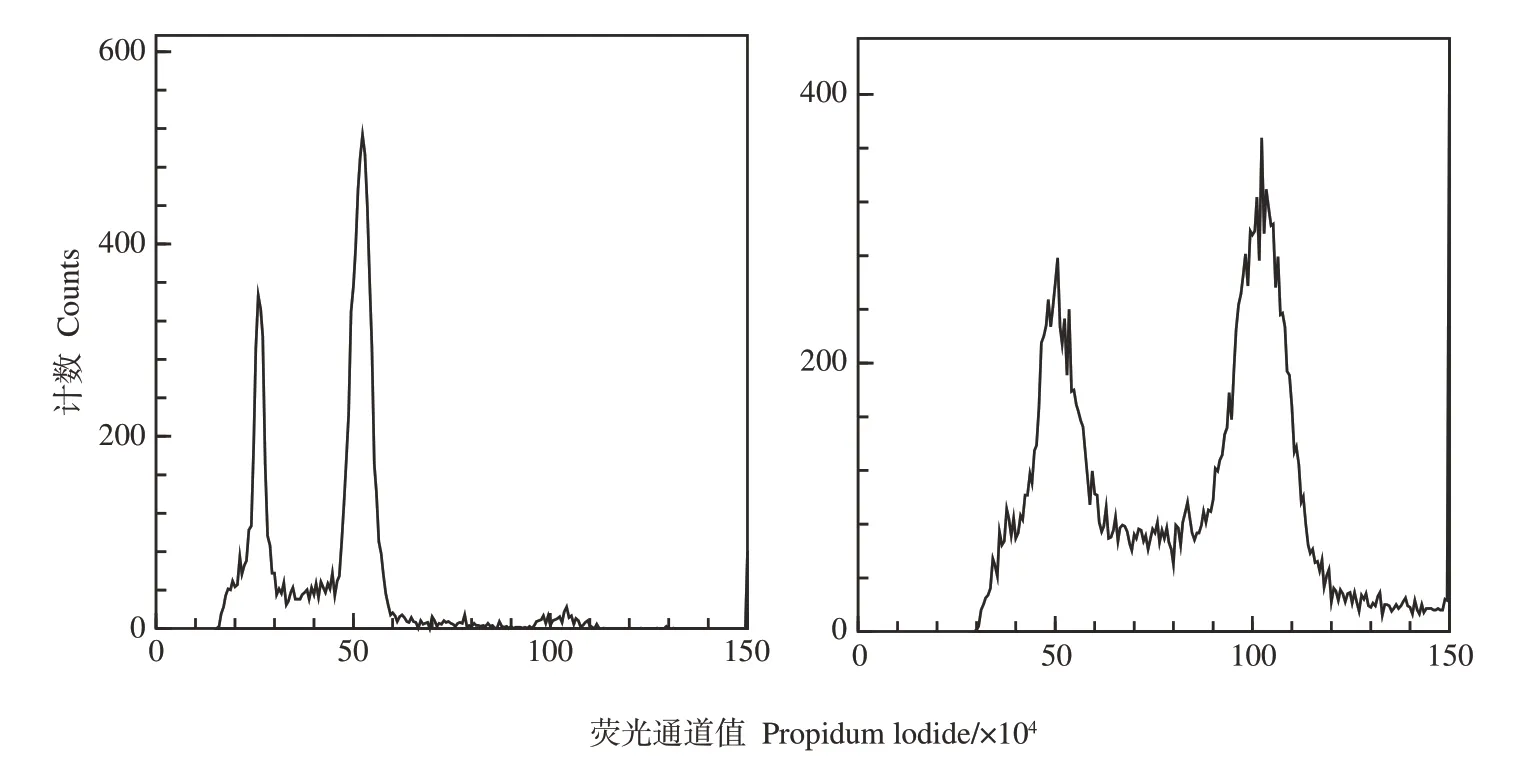
图4 二倍体(左)、四倍体(右)菜心LCX017流式细胞仪分析结果Fig.4 Identification results of diploid(left)and tetraploid(right)Chinese flowering cabbage LCX017 by flow cytometry
2.2 二、四倍体菜心LCX017农艺性状比较
由表1 可知,四倍体植株在株高、十叶厚、叶宽、叶柄宽、叶柄厚、薹粗、薹重方面相比二倍体分别增加了68.00%、17.27%、37.15%、50.77%、25.47%、29.13%、30.75%,差异极显著;叶片数相较于二倍体则增加了8.94%,差异显著;叶片开展度与叶柄长比二倍体分别增加了9.15%与5.91%,差异不显著;叶长则降低了3.14%,差异不显著。
2.3 二、四倍体菜心LCX017营养品质比较
由表2 可见,与二倍体相比,同源四倍体的纤维素含量、有机酸含量以及叶绿素含量分别提高了120.00%、169.37%、24.85%,差异极显著;四倍体的可溶性糖含量提高了19.40%,差异显著;而可溶性蛋白含量下降了8.82%,差异不显著;硝态氮含量相比二倍体则下降了22.92%,且差异显著。
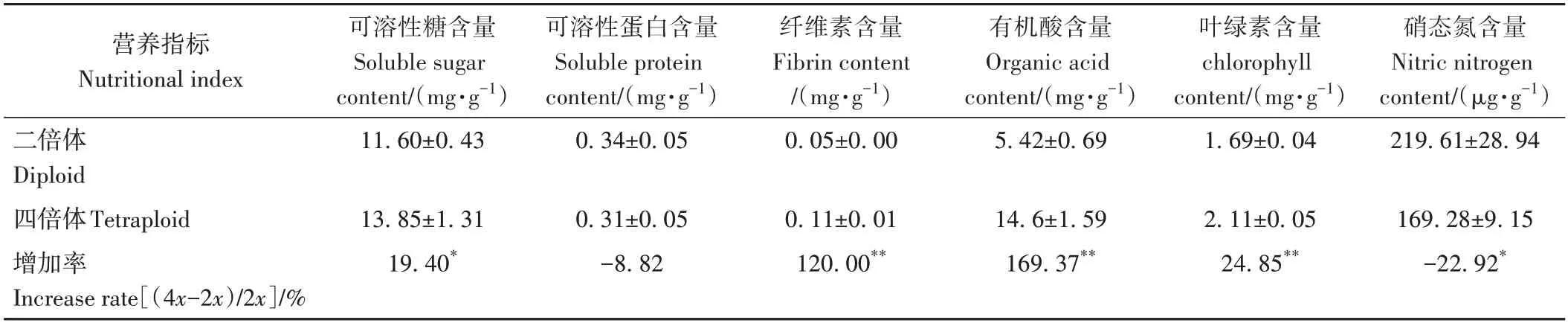
表2 二、四倍体植株主要营养品质比较Table 2 Comparison of content of nutritional substance of diploid and tetraploid plants
2.4 二、四倍体菜心LCX017光合特性分析
由图5可知,随着光照强度的增加,二、四倍体的净光合速率均呈现上升趋势,光照强度低于150 µmol·m-2·s-1时,二、四倍体的净光合速率相差并不大;当光强大于150 µmol·m-2·s-1时,四倍体净光合速率增加趋势明显高于二倍体,二者差距逐渐增大;当光照强度达到1 600 µmol·m-2·s-1时,二者基本达到饱和光强,其净光合速率不再随光照强度的增加而增加,达到最大净光合速率,但四倍体的最大净光合速率远高于二倍体。随着光照强度的增加,四倍体的气孔导度明显增大,而二倍体气孔导度的增加则较为平缓,且四倍体的气孔导度明显大于二倍体。二、四倍体的胞间CO2浓度均随着光照强度的增加呈现下降趋势,整体表现为,四倍体的胞间CO2浓度高于二倍体;在光照强度大于1 600 µmol·m-2·s-1时,二者的胞间CO2浓度值不再降低,趋于平缓。蒸腾速率则随着光照强度的增加而逐渐增加,四倍体蒸腾速率明显高于二倍体,这与气孔导度的变化趋势相似。
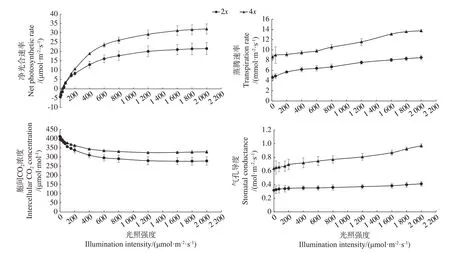
图5 二、四倍体光合特性比较分析Fig.5 Comparison of the photosynthetic characteristics of diploid and tetraploid plants
由表3 可知,相较于二倍体,四倍体的最大净光合速率(Pmax)、光饱和点(LSP)增加了3.91%、42.58%,差异均不显著;表观量子效率(AQY)、暗呼吸速率(Rday)、光补偿点(LCP)则分别降低了27.27%、41.73%、13.97%,差异均不显著。
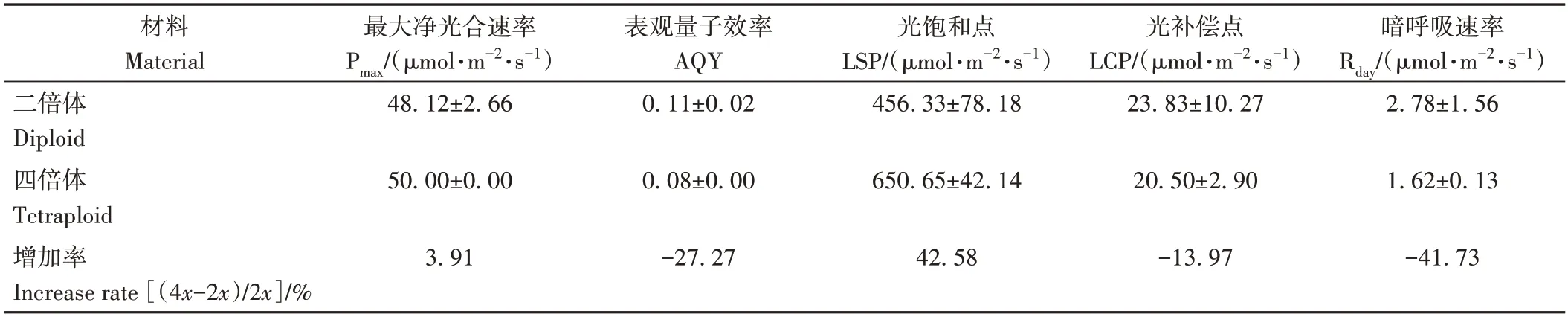
表3 二、四倍体植株的光响应曲线参数比较Table 3 Comparison of the parameters of response curves of diploid and tetraploid plants
3 讨论
多倍体是推动植物进化的重要因素之一,也是物种形成的途径之一[24]。植物多倍体通常具有营养生长优势和更强的环境适应性,因而多倍体育种是植物遗传改良的重要途径[25]。同时相较于传统杂交育种,多倍体育种目标较为明确,可以较快地创新种质资源,丰富育种材料[26],因此多倍体育种技术受到广泛关注与深入研究。赵建栋等[27]对不同生长阶段的甜荞采用不同浓度的秋水仙素处理,得出采用0.2%浓度的秋水仙素处理幼苗时诱导效果最佳,并得到了同源四倍体甜荞;张振超等[28]利用二倍体不结球白菜诱导得到同源四倍体不结球白菜,并对秋水仙素诱导浓度及处理次数进行探究,发现以0.2%浓度的秋水仙素处理四次诱导效果最好。本研究以二倍体菜心LCX017为材料,采用0.2%浓度的秋水仙素处理,经过形态学鉴定、解剖学鉴定、细胞学鉴定以及应用流式细胞仪鉴定,成功诱导得到同源四倍体的菜心LCX017。四倍体菜心LCX017 的创制,丰富了不结球白菜的种质资源,为不结球白菜遗传特性研究以及育种工作提供了重要材料。
本研究发现,农艺性状方面,四倍体相较于二倍体,在十叶厚、叶宽、叶柄宽、叶柄厚、菜薹直径等方面都具有增加趋势,这与李孟杰等[29]的研究结果一致;幼苗期时四倍体相比二倍体幼苗较小,根系较短,可能是四倍体种子发芽较晚,幼苗期生长发育较慢的缘故;在营养品质方面,四倍体在可溶性糖含量、纤维素含量、有机酸含量、叶绿素含量方面分别增加19.40%、120.00%、169.37%、24.85%,与张咪等[30]得到的部分营养物质含量上升的结果基本一致;而可溶性蛋白含量、硝态氮含量则分别下降了8.82%、22.92%,这与王新雅等[31]的研究中部分营养物质含量下降的结果一致,这些结果可能是由于四倍体植株在诱变过程中,随着染色体组的加倍,部分生理活动也随之发生了变化,加之秋水仙素的毒性影响,最终导致植株的营养物质含量出现不同的变化趋势,同时说明四倍体的营养物质含量并非一定高于二倍体。
植物的光合作用直接关系到作物的最终产量,是植物生命活动的基础,光合作用的效率,对植物的生长发育具有重要影响[32-33]。不同倍性作物的光合特性通常会出现差异,如钟程等[34]通过比较不同倍性白菜光合特性,发现白菜四倍体的光合作用强于二倍体;王峰等[35]发现四倍体青檀在光能转化效率和弱光下生长等能力优于二倍体青檀。本研究通过对二、四倍体植株的光响应曲线进行分析,根据非直角双曲线模型公式进行光合曲线拟合,并根据拟合曲线计算出相应参数。通过对二、四倍体光合特性的分析,四倍体植株的Pn、Tr、Gs、Ci均高于二倍体,这与在白榆[36]、草莓[37]多倍体中的研究结果基本一致。LSP、LCP、AQY及Rday是体现植物光合作用能力的重要指标,能够反映植物叶片对弱光和强光的适应能力[38-39]。通过对二、四倍体植株的光合特性进行对比发现,四倍体的Pmax、LSP 高于二倍体植株,说明四倍体在强光下相比二倍体能够更加高效地利用光能,有利于更加高效地积累有机物;而四倍体的AQY、LCP 和Rday低于二倍体植株,说明四倍体在弱光条件下的适应能力强于二倍体,能够更充分地利用较少的光能完成最基本的生理活动需求,这也符合四倍体在形态学上观察到的“巨大化”特征。综上,同源四倍体菜心LCX017 相比二倍体,在强光和弱光下都具有较强的光合能力,王婷婷等[40]在四倍体马铃薯中也得到了相似的结论。
在诱导过程中,由于秋水仙素的诱导效应与毒性作用,会引起四倍体植株遗传机理的紊乱,导致其第一代植株育性较低,因此仍然需要2~3代的自交培育,以获得能够稳定遗传的同源四倍体植株,从而为后续育种工作奠定基础。
4 结论
本研究利用秋水仙素诱导二倍体菜心LCX017,对得到的同源四倍体植株在形态外观、营养物质、光合特性等方面进行分析,发现同源四倍体在形态外观上总体呈变大趋势,其菜薹重量与直径等显著大于二倍体植株;在可溶性糖、硝态氮、有机酸等营养物质含量上相较于二倍体植株具有明显的优势;同种条件下,菜心LCX017 的四倍体植株对光环境和光照的适应力均强于二倍体植株,在强光和弱光环境下的光合能力均高于二倍体植株,但是其内在作用机理等仍有待进一步研究。
