化学诱变提高植物抗逆性的研究进展
2024-01-20吴正景职钤华刘素娟安冰洁武静静李辰方
吴正景 职钤华 刘素娟 张 昊 安冰洁 武静静 龙 圆 李辰方
(河南科技大学园艺与植物保护学院,河南 洛阳 471003)
化学诱变是通过化学诱变剂诱导植物DNA 序列随机突变,在植物抗逆育种方面受到很多育种家的青睐。随着组培技术的成熟,近年来利用化学诱变和植物组培技术相结合,获得了大批抗逆突变体;结合分子育种策略,为植物品种选育提供新途径。化学药剂诱变植物始于20世纪初,Ochlkers 在1943年用脲烷处理月见草取得了良好的诱变效果,此后化学诱变育种得以广泛应用[1]。通过离体培养方法筛选出抗性突变体,最早为Dix 等[2]在1976年用诱变剂甲基磺酸乙酯(ethyl methane sulfonate,EMS)处理林烟草和辣椒的耐低温研究。长期以来,利用化学诱变及逆境选择压筛选抗逆突变体在许多植物育种上得到了实现,如小麦[3-4]、绿豆[5]、水稻[6]、辣椒[7]、白菜[8]、马铃薯[9]、大豆[10]、甘薯[11]、棉花[12-13]、玉米[14-15]、拟南芥[16]、旱柳[17]等利用化学诱变,分别获得了抗旱、抗倒伏、耐涝、耐热、抗寒、耐盐、抗虫、耐密植、耐铵盐的高抗改良植物品种。
1 化学诱变育种的优势
常规育种在短期内难以获得新基因和新性状,诱变育种可拓宽遗传变异谱,在植物创造突变体种质库、遗传材料以及培育新品种等方面发挥作用。在无性繁殖植物中,由于其基因杂合程度高,且为多倍体或非整倍体,通过杂交方式很难快速获得理想性状[18]。化学诱变成本低,技术操作可控性强,应用植物种类广泛,通过筛选突变体后代可得到植物抗逆性品种。化学诱变适合改良综合性状良好品种的抗逆性状,如抗寒、抗病、耐盐碱等,育种周期短,后代性状稳定快[19]。
在植物育种研究中,化学诱变能引发较高频率的突变,与物理诱变相比,化学诱变剂可在一个基因组中作用于一个或多个位点同时引发基因突变,产生的突变频率和突变比例高[20]。化学诱变和自发突变均是DNA 水平上发生变异,但自发突变率较低。通过化学诱变与植物组培技术相结合,在体细胞无性系变异的基础上,化学诱变可进一步提高变异机率。利用组培技术可为化学诱变提供大量同质或基本一致的诱变基础群体,利于进行大量重复试验,降低常规诱变技术中产生复杂的难以鉴别突变细胞的嵌合体比例[21]。
2 化学诱变育种在植物抗逆方面的应用
植物在生存过程中,可能遭受低温、旱涝及盐碱等不良自然环境的影响,导致营养生长和生殖生长受到严重损害,用化学诱变剂处理植物可在育种早期增大选择群体的变异频率,获得较多突变材料。化学诱变在越来越多的植物抗逆育种研究中被应用,即通过筛选突变材料,最终可获得抗逆性增加的突变株。由表1可知,化学诱变能处理植物多部位的器官、组织,但是由于起源材料的不同,突变结果差别较大。愈伤组织和萌动的种子是最常用的诱变材料,随着植物组培再生体系日趋成熟,通过诱变处理获得完整突变植株的成功率大幅提高,能够为今后的抗逆育种研究提供理论基础。
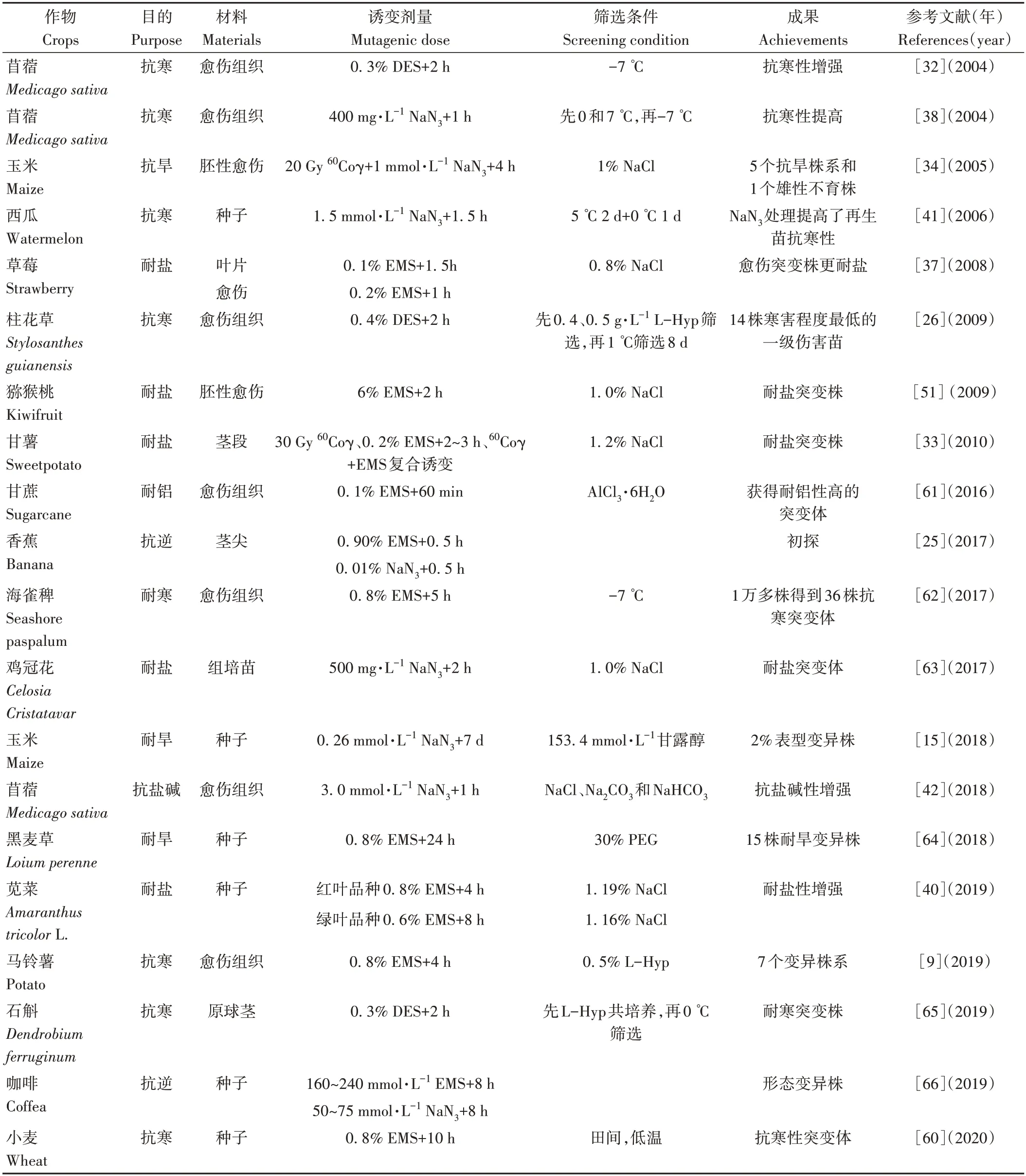
表1 化学诱变在部分植物抗逆育种方面的应用Table 1 Application of chemical mutagenesis in stress resistance breeding of some plants
3 常用化学诱变剂的诱变机制及处理方式
长期以来,研究者们发现有1 000多种化学物质对植物具有诱变作用[22],化学诱变剂被植物吸收后,进入细胞核内发生作用,导致DNA 受损,如不能完全修复,则形成突变。化学诱变剂可使植物染色体倍性改良或在植物细胞DNA 复制、转录过程中渗入细胞内,替代或嵌入碱基之间,造成染色体变异[23]。化学诱变剂通常分为四类:(1)烷化剂,能直接诱导DNA 分子结构发生变异,主要有EMS、乙烯亚胺(ethyleneimine,EI)、硫酸二乙酯(diethyl sulfate,DES)等;(2)碱基类似物,化学结构与核酸碱基类似,能充当DNA 的组成部分嵌入到DNA结构中,导致DNA复制时打破碱基互补配对原则造成碱基配对差错,由于该类物质与正常碱基在某些取代基团上不同,从而诱发突变,主要有5-溴尿嘧啶(5-bromouracil,5-BU)、5-溴去氧尿嘧啶核苷(5-bromodeoxyuridine,5-BUdR)等;(3)吖啶类与抗生素,为诱发移码突变的诱变剂,能结合到DNA 双链上并插入碱基引起单个碱基对结构发生变化从而导致突变,主要包括吖啶橙(acridine orange,AO)、溴化乙锭(ethidium bromide,EB)、平阳霉素(pingyangmycin,PYM)等;(4)叠氮化物,能与碱基替换从而影响DNA的正常合成,导致点突变的产生,如叠氮化钠(sodium azide,SA,NaN3)[24]。
烷化剂和叠氮化物广泛应用于各种植物诱变育种中,效果突出,烷化剂中的EMS 和叠氮化物中的NaN3是目前最具代表性的诱变剂[25],除此之外,常用的诱变剂还有DES[26]、EI、PYM[27]、甲基亚硝基脲(Nmethyl-N-nitrosourea,MNU),乙基亚硝基脲(N-ethyl-N-nitrosourea,ENU)等。
3.1 诱变剂作用机理
EMS 极易诱发高频率等位基因点突变,将烷基加到DNA 的核苷酸鸟嘌呤上,鸟嘌呤和糖之间的结合键断裂,从DNA 链上脱落造成DNA 链上碱基缺失,在复制时进一步转化或颠倒,最终导致突变[24]。EMS 诱变具有非定向性,能诱发任意一个基因位点发生突变,引起植物的叶、花、果实等发生明显变异,突变类型丰富,可建立新的植物突变体库[28]。EMS 诱变后一般到M3代即可得到稳定遗传的突变体[29]。
Spence 等[30]研究大麦时发现NaN3具有致突变性,可被用于诱变育种。NaN3是一种呼吸抑制剂,本身不具有诱变效应,不与DNA 直接相互作用,但被植物吸收后,在细胞中产生具有诱变活性的L-叠氮丙氨酸,进入细胞核后,在DNA 复制时导致碱基错配,从而产生点突变。NaN3在pH 值为3.0 的酸性环境下生成中性HN3,更容易进入细胞膜发生作用[31]。
DES 诱变处理植物愈伤组织时,在DNA 分子的复制和转录过程中渗入细胞,与核酸、核苷酸的中心位置鸟嘌呤N-7作用,诱发染色体变异,最终导致愈伤组织表现出突变类型[32]。
PYM抑制胸腺嘧啶核苷参与DNA复制,产生3'-磷酸末端引起DNA断裂,导致植物染色体畸变[23]。
3.2 单一处理诱变
在植物化学诱变中,单纯用一种诱变剂对植物材料进行诱变处理,做法相对简单,能深入研究该诱变剂对该材料的诱变规律,对于所使用的诱变剂种类而言,单一诱变能引发部分性状突变,但诱变谱较单一[33]。
3.3 复合处理诱变
与单一处理方法相比,复合处理可扩大突变谱,获得更丰富的突变材料,利用一种化学诱变剂与物理辐射或其他化学诱变剂复合使用,两种方法对于不同植物的处理效果不同。孙榕[33]用甘薯茎段为材料,采用60Coγ 辐射诱变、EMS 诱变以及二者复合诱变的方法,物理辐射破坏细胞膜,促进化学诱变剂渗透吸收,综合考虑存活率、变异率、损伤效应,确定30 Gy60Coγ射线与0.2% EMS 诱变2~3 h 的复合处理为最佳诱变处理,最终获得了甘薯耐1.2% NaCl 的突变体。付凤玲等[34]发现复合处理比单一使用60Coγ 射线效果好,用60Coγ 射线和NaN3复合诱变玉米的愈伤组织,最终筛选得到了耐旱株系和雄性不育株。相反,任学良等[35]发现单一使用60Coγ 射线对烟草M1代各性状的诱变效应更好,优于NaN3处理和两者的复合处理;但是,复合处理大大提高了M2代的突变频率。综上,不同诱变处理方式的结果各异,复合诱变对不同植物产生的诱变影响不同。
4 影响化学诱变育种的因素
4.1 遗传因素
化学诱变的起始材料直接关系到诱变的效率和结果,要考虑其整齐性,以及获得再生突变植株的难易程度。理想的诱变起始材料是原生质体和悬浮细胞,诱变上述单细胞或少数细胞产生不定芽,诱变率高,同质突变体易筛选,但是多数植物难获得再生植株,培养技术相对较难[36]。化学诱变处理的材料取决于植物本身,有性繁殖植物(如水稻)的首选材料是种子,易进行大量诱变处理,利于运输和储存;对于无性繁殖植物(马铃薯、木薯等),随着组培技术进步和经验积累,诱变植物的材料已发展到包括块茎、根茎、鳞茎、茎段、花粉、不定芽、枝条、愈伤组织以及细胞培养物[33]。
相比而言,愈伤组织是化学诱变的首选材料,利于诱变剂高效进入到细胞团内部发挥作用[34],例如EMS诱变草莓愈伤和叶片,经对比发现愈伤获得突变再生植株更耐盐[37]。也有研究建议愈伤组织的继代次数不宜过多,超过3代会影响诱变效果和植株分化[38]。
不同作物品种对诱变剂的敏感性不同,NaN3诱变处理两个燕麦品种,M1代各指标除旗叶宽和有效分蘖数外,青永久709 品种的指标变幅均大于爱沃品种,说明青永久709 品种对NaN3反应更敏感[39]。崔燕[40]用EMS诱变苋菜种子发现,0.8% EMS处理4 h,红叶苋菜种子的发芽率为46%;绿叶苋菜种子在0.6% EMS 处理8 h 时,发芽率为55%。对于诱变剂的敏感性,不同的品种间会表现出明显的差异。
诱变育种前需要对起源材料的遗传背景和次级代谢途径了解清楚,结合植物组织培养的环境条件,根据组培植物的细胞倍性、染色体大小、基因位点的杂合程度、细胞活性的生理状态以及诱变环境条件设计出有效的处理方案,提高突变体的诱变效率[41]。
4.2 诱变剂的处理方式
用诱变剂处理植物的方法主要有:液体浸泡法[42]、离体共培养法[43]、涂抹法[44]、滴苗法[45]、注射法[46]等,让诱变剂与植物材料充分接触。低剂量NaN3加入固体培养基共培养的处理方式,操作简便,可获得较多突变[43]。孙榕[33]将EMS 加入固体培养基和利用EMS 浸泡处理甘薯茎段,对比发现浸泡效果最好。相反,用EMS 溶液处理冰灯玉露胚性愈伤,分别采取浸泡法和混培法(共培养),结果发现浸泡法未能得出最佳诱变剂量,而混培法得到了理想的半致死剂量[47]。诱变剂加入培养基的方法相对简单,容易观察外植体在诱变剂不同浓度下的生长反应。究其未被广泛应用的原因,可能是由于EMS 不易溶于水,加入固体培养基的EMS 会分解形成有机酸,对处理材料作用时间较长,增强毒害作用,降低诱变效果,或无法控制长期接触造成的DNA损伤,后代无法获得生长植株。
根据不同育种目标,有针对性地选用诱变剂处理方式,液体浸泡法适合萌动的种子、愈伤等,涂抹法、滴苗法和注射法更适合在活体植株的幼苗或成熟花器官上进行诱变处理。EMS 对西瓜会产生诱变效应,分别采用浸种法和滴苗法构建了表型丰富的西瓜突变体库[45]。王传堂等[48]在花生盛花期将EMS 溶液注射到已开放花朵的龙骨瓣内,筛选获得了具有较强耐旱特性的优良突变系。NaN3处理种子最好在DNA 活跃状态,需要提前浸种,使种子处于萌动状态[31]。
4.3 诱变剂的处理浓度和时间
最佳剂量取决于植物物种和基因型,诱变剂浓度和处理时间影响诱变频率。经过多年研究发现,半致死剂量(median lethal dose,LD50)是用于诱变育种的最佳剂量,指经诱变处理后材料存活率为50%的剂量[49],半致死剂量一方面是为了保证材料有较高的突变率,另一方面保证材料不会因为过度诱变导致死亡,为后续筛选得到突变体做准备。
对于某些材料,为保证得到一定数量的突变体植株,也有观点认为LD20剂量适合自交系植物或综合性状良好的突变品种,用80%的存活率作为诱变剂适宜剂量的选择指标[18]。草莓愈伤组织经EMS 半致死浓度诱变后,不定芽再生率很低,会降低突变株选择的机会[37]。香蕉茎尖经半致死剂量EMS 处理,植株后续无法生根[25]。
不同材料对化学诱变剂的敏感性不同,不管是高浓度短时间处理或者低浓度长时间处理,都可以使诱变剂充分渗入到细胞中发挥作用,为了避免高浓度诱变剂对细胞生理毒性过强,实际操作中一般按照低浓度、长时间处理的原则[50]。但是,猕猴桃海沃德叶片在2% EMS处理6 h和6% EMS处理2 h的条件下,存活率接近50%,但其存活叶片的胚性愈伤组织分化率以6% EMS 处理2 h为最高,确定6% EMS 处理2 h为半致死浓度[51]。
同一种诱变剂,根据材料不同,采用不同的处理浓度和时间,以种子为诱变材料时要考虑到种子的种皮厚度、密度和硬度,向日葵种子需要较高浓度EMS 和长时间处理才能起到诱变效果,而种皮较薄的种子(小麦、水稻、芝麻等)需要低浓度短时间处理,由于向日葵类型不同,种皮也具有差异,油用向日葵适宜剂量为EMS 浓度1.0%~1.5%处理12~14 h,食用向日葵适宜剂量为同等浓度处理6~12 h[52]。
4.4 温度
化学诱变剂的水解速度受温度影响较大,诱变剂在低温条件下能较长时间保持稳定性,与被处理材料发生缓和作用,诱变过程中温度升高会加速诱变剂在培养材料内的作用能力,化学诱变温度通常选择在20~25 ℃范围内[21]。如化学诱变剂处理种子,可先将种子与诱变剂在低温下中浸泡足够时间,使诱变剂能进入胚细胞,再将种子移入稍高温度处理,以提高诱变剂在种子内部的反应速度[53]。在诱变剂浓度和处理时间相同的条件下,不同浸种温度对芝麻种子的萌发有明显影响,4 ℃浸种过夜的芝麻品种对EMS 和NaN3的敏感性比25 ℃浸种高,低温浸种能够更好发挥EMS和NaN3的作用[50]。王小华等[26]研究发现,在10、15、20、25 ℃不同温度下,DES 在10 ℃处理效果最佳,得到更多抗寒苗,诱变除了在室温下进行,其他温度对诱变效果的影响也不容忽视。
4.5 pH值影响
溶解化学诱变剂溶液的pH 值应选择中性或微酸性(pH 值为6.0~7.0),以减少诱变剂本身的分解。总体而言,化学诱变剂浓度和处理时间、温度、pH 值等条件,都要根据实际的植物材料进行调整。大部分烷化剂受水溶性限制,在水中不易溶解,需搭配一定酸碱度的磷酸缓冲液使用,一般现配现用,EMS在水中溶解度较低(8%),通常用pH 值7.0 的中性磷酸缓冲液作为EMS 的溶解剂,DES 用pH 值8.0 的磷酸缓冲液作为溶解剂。诱变剂受pH 的影响大,如NaN3在pH 值3.0 的酸性介质中诱变效果更好[34]。研究发现,pH 值3.0 的磷酸缓冲液对西瓜种子萌发和幼苗生长基本没有影响,和对照之间没有显著差异;但是NaN3加入pH 值3.0 的磷酸缓冲液后,抑制种子胚根和子叶开展,影响不定芽分化、再生、伸长和生根[41]。
4.6 组培环境
常规育种技术存在自然突变率低、育种周期长、不利于大规模育种等问题,利用快速、便捷的途径培育出新种质一直是育种中的热点问题,化学诱变可提高细胞有益突变率10~100 倍[22]。组培环境是外植体组培成功的关键,培养基成分及温度、光照、相对湿度等条件都会影响组培的效率,需在环境控制、人工操作等方面采取相应措施[54]。理论上认为,组培细胞通过有丝分裂产生基因型一样的细胞,但是无诱变剂情况下,组培环境本身就可导致后代植株出现大量变异,火龙果组培苗在扩繁到第4代已发生突变,突变率为9.1%[55]。若在培养过程添加辐射或化学诱变试剂,变异率会更高。
4.7 突变体筛选方式
对于诱变后的突变材料,进行定向筛选是必要环节,根据研究目的,合理设计筛选条件,比如在培养基加入病毒或其他化合物,淘汰正常细胞,留下突变细胞[33]。将诱变材料接种在加入高盐的培养基中,可筛选耐盐突变体[40],或改变温度条件,筛选耐低温突变体[32]。在耐旱植物的研究中,筛选剂有NaCl、PEG、HYP等。为避免突变材料全部死亡,筛选力度应逐步增加。多数研究者参考两步筛选法,如抗寒突变体先在0和7 ℃条件下筛选,再在-7 ℃条件下筛选[38]。为了得到DES 诱变后的抗L-Hyp 变异愈伤,先在较低剂量0.4 g·L-1L-Hyp下初筛,再在较高致死剂量0.5 g·L-1LHyp条件下复筛[26]。
为了防止生理适应性的假阳性植株,将诱变材料用不含盐和含盐的培养基交替2 次培养,最后在含1.0% NaCl的生根培养基上获得突变株[51]。为消除百合耐盐碱的生理适应性变异,EMS诱变处理后,将百合小鳞茎转接到含NaHCO3的培养基,1~2 个月后转接到MS 培养基,培养1~2 个月后再将其转接到含NaHCO3培养基,反复继代3~5次,对存活的材料进行耐盐碱比较[56]。通过筛选获得的突变植株,测定生理指标作为胁迫条件下再生植株的抗逆指标,建立生理指标与抗逆性状的相关性,能够在早期筛选出具有有利突变性状的再生苗,从而大幅度减少突变体筛选的工作量,为植物的抗逆育种提供基础研究数据[36]。
4.8 其他
由于化学诱变本身的不定向性,结果可能是有益突变、有害突变或者中性突变。突变后代群体也可能会出现有益突变和有害突变伴生的情况,例如玉米诱变后代的雄性不育株系,其抗纹枯病能力下降[34]。理论上诱变群体规模越大越利于筛出目标性状突变体,为了增加有利突变的频率,又能定向获得理想的突变体,可增加单一诱变处理次数,结合复合诱变增宽突变谱,与其他好的育种技术结合,取长补短扩大诱变群体,提升筛选概率[36]。利用基因编辑等技术诱发基因在指定位点发生特定突变,可以做到定向诱变[57]。
化学诱变剂可能具有不等同性,例如,利用EMS和NaN3分别处理大豆种子,对M4代进行鉴定,NaN3诱变获得了具有抗草甘膦的突变株系,EMS 处理没有筛出抗性植株[58],是否因为EMS浓度低且诱变时间短导致诱变率低,进而没有抗性突变体产生,值得进一步研究。
植物化学诱变可能会出现效应迟发现象,即诱变当代不表现而后代表现出目标性状,像诱变林木植物至少需要两代筛选才能获得性状稳定的新突变品种[59]。相反,武银玉等[60]用EMS 处理晋麦90 号小麦种子,对选择出的突变体M3代进行抗寒性鉴定,结果显示抗寒性强的突变体数目明显少于M2代,推测这是一种效应衰退现象。
5 展望
化学诱变技术被广泛应用于植物的性状改良,增加种质资源突变体库,是培育抗旱、抗寒、耐盐碱、广适、高产等优良抗逆新品种的有效手段。化学诱变产生突变的无方向性以及化学诱发的细微点突变,一般的检测方法难以快速识别,增加了后代筛选的难度,限制了化学诱变育种发展。关于植物在逆境环境下的生理变化及抗逆反应的研究已较成熟,但鲜有将所有生理生化变化的分子机制研究透彻。在化学诱变育种过程中,应当注意分子测序与分子标记选择技术相结合,在分子水平上检测突变的发生,通过转录组测序与分析,筛选和得到控制植物目标性状的关键基因。对植物在逆境下产生的许多与逆境反应相关的功能蛋白质进行定位,测序获得基因序列,利用基因工程的手段将其转化到植物中。通过分子手段将这些关键基因对植物进行遗传改良,加速植物改良进程,拓宽诱变技术在植物抗逆性状改良方面的应用,是提髙植物抗逆育种的有效途径之一。
