环状RNA同源性蛋白激酶3靶向微RNA-338促进胶质瘤细胞侵袭、迁移的实验研究
2024-01-18刘莹连海伟易伟张淑娣朱晓楠
刘莹,连海伟,易伟,张淑娣,朱晓楠
作者单位:武汉大学人民医院神经外科,湖北 武汉430060
胶质瘤是最常见的颅内原发性肿瘤,具有较高的病死率[1-2]。目前对于胶质瘤的治疗方法主要包括手术切除、放疗、化疗和肿瘤电场治疗(TTfields)等综合治疗方案,虽然取得了很大进展,但由于胶质瘤具有很强的转移能力,病人生存率依然很低[3]。所以探究胶质瘤转移的分子机制可能为胶质瘤的诊断和治疗提供更多的方向。越来越多的研究表明,circRNA 在各种疾病尤其是癌症的发展中发挥重要作用[4]。CircHIPK3 作为一种circRNA,已有研究报道,CircHIPK3 在神经胶质瘤组织和细胞中高表达,沉默CircHIPK3 抑制了胶质瘤细胞增殖和侵袭能力[5]。表明沉默CircHIPK3 可抑制胶质瘤的进展。但具体机制尚不完全清楚。本研究通过生物信息学分析发现CircHIPK3 与miR-338 存在结合位点。相关研究显示,上调miR-338 可抑制胶质瘤细胞增殖[6]。但CircHIPK3 能否通过调控miR-338 影响胶质瘤细胞的恶性生物学行为尚不清楚。因此,2021 年2—12 月进行本研究,旨在通过体外研究深入探究CircHIPK3 对胶质瘤细胞U251 细胞迁移、侵袭的影响以及其作用的分子机制。
1 材料与方法
1.1 细胞与试剂胶质瘤细胞(U251)(上海复祥生物 公 司,货 号CL-0014)。 胎 牛 血 清(货 号10100147)、DMEM 培养基(货号31331093)、0.25%胰蛋白酶(货号12605036)等,购自美国Gibco 公司;兔抗人基质金属蛋白酶(MMP)-2(货号ab92536)、MMP-9(货号ab228402)、GAPDH(货号ab181602)及山羊抗兔IgG 二抗(货号ab205718)购自英国Abcam公司。
1.2 方法
1.2.1 生物信息学分析 通过Circular RNA Interactome、RegRNA2.0、CircBank Database 网 站 预 测CircHIPK3(ID:hsa_circ_0000284)的靶向miRNA,然后将3个网站预测得到的靶向miRNA进行交集。
1.2.2 细胞培养 将U251 细胞株置于37 ℃水浴锅中快速融化,移至EP管中,悬浮接种于培养瓶,培养过程均用含1%双抗、10%胎牛血清的DMEM 培养液,于37 ℃、5%二氧化碳的条件下培养,每两天更换一次培养液,传代培养。
1.2.3 细胞转染及分组 将对数生长期的U251 细胞分别转染用羧基荧光素(绿色荧光)标记的sh-control、sh-CircHIPK3,并 命 名 为sh-control 组、sh-CircHIPK3 组,另取正常培养的U251 细胞作为空白(NG)组。转染48 h后,利用荧光显微镜观察细胞转染效率。转染效率=(绿色荧光细胞数∕总细胞数)×100%。
1.2.4 实时定量聚合酶链反应(quantitative realtime PCR,qRT-PCR)检测CircHIPK3、miR-338 表达水平变化 Trizol 试剂提取U251 细胞中总RNA,使用Nanodrop™ 2000 分光光度计测量RNA 的浓度和纯度。用RNA 逆转录试剂盒将RNA 逆转录为cDNA后,以cDNA为模板进行qRT-PCR反应。扩增条件如下:95 ℃,10 min;95 ℃,10 s;60 ℃,60 s;40个循环。GAPDH、U6 分别作为CircHIPK3、miR-338的内参,通过2-ΔΔCt法计算CircHIPK3、miR-338 的表达。引物序列见表1。

表1 CircHIPK3、miR-338、GAPDH、U6 qRT-PCR引物序列
1.2.5 Transwell法检测各组U251细胞侵袭、迁移能力 细胞侵袭的测定,按方法“1.2.2”进行分组,将各组细胞以2×105个∕孔悬浮于预涂有Matrigel 的Transwell 上室中。再将含有10%胎牛血清的500 μL DMEM培养基加入到下室中。孵育48 h后,用棉签除去上室下表面未侵袭的细胞,将侵袭的细胞用甲醇固定30 min,0.1%结晶紫染色20 min。利用倒置显微镜观察侵袭细胞数。
细胞迁移的测定,按方法“1.2.2”进行分组,将各组细胞以2×105个∕孔悬浮于Transwell上室中。再将含有10%胎牛血清的500 μL DMEM 培养基加入到下室中。孵育48 h 后,用棉签除去上室下表面未迁移的细胞,将迁移的细胞用甲醇固定30 min,0.1%结晶紫染色20 min。利用倒置显微镜观察迁移细胞数。
1.2.6 划痕愈合实验检测各组U251 细胞迁移能力 将1×106个细胞接种到6孔板中,当其汇合度达到90%时,使用10 μL 无菌移液管尖端刮擦细胞层表面以产生划痕。孵育24 h 后,利用倒置显微镜观察划痕宽度。用W0、W24分别表示0 h、24 h的划痕宽度。划痕愈合率(%)=(1-W24∕W0)×100%。
1.2.7 流式细胞术检测细胞周期 收集各组细胞,用PBS 洗涤1 次后用PBS 制成细胞悬液,再加入体积分数为70%的乙醇,在4 ℃下避光过夜孵育。次日,经1 000 r∕min 离心5 min 并收集细胞沉淀,用PBS重悬细胞,再加入PI染液,室温避光孵育15 min后,利用流式细胞仪检测细胞周期。
1.2.8 双萤光素酶报告基因
1.2.8.1 突变型载体的制备 TargetScan 数据库显示人CircHIPK3 基因3"UTR 区域含有miR-338 结合位点。对CircHIPK3 3"-UTR 区域进行扩增、酶切连至pGL4 萤光素酶报告载体,构建p-GL4-HIPK3-WT质粒,以此质粒为模板进行定点突变,测序确认突变成功,构建p-GL4-HIPK3-MUT质粒。
1.2.8.2 萤光素酶报告基因实验 U251 细胞铺48孔板,24 h 后,将miR-338 NC 和miR-338 mimics 分别与p-GL4-HIPK3-WT 和p-GL4-HIPK3-MUT 共转染,24 h后,观察萤光素酶相对活性变化。
1.2.9 蛋白质印迹法检测 RIPA 裂解液提取各组细胞总蛋白,使用BCA 蛋白测定试剂盒对总蛋白进行定量。10% SDS-PAGE 分离30 μg蛋白质,然后将分离的蛋白质转移到PVDF 膜上。将膜在室温下用5%脱脂牛奶封闭1 h,再向膜中加入一抗MMP-2(1∶1 000)、MMP-9(1∶500)、GAPDH(1∶500)在4 ℃中孵育过夜,用TBST 洗涤后添加兔二抗(1∶5 000)常温下孵育2 h。采用蛋白成像凝胶仪对MMP-2、MMP-9蛋白水平进行半定量分析。实验重复3次。
1.3 统计学方法采用SPSS 19.0(SPSS Inc.Chicago,IL,USA,2011)进行统计学分析。计量数据用±s的形式表示,多组间比较采用方差分析,组间两两比较采SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 CircHIPK3 靶向miRNA 的预测通过Circular RNA Interactome、RegRNA2.0、CircBank Database网站预测CircHIPK3(ID:hsa_circ_0000284)的靶向miRNA,然后将3 个网站预测得到的靶向miRNA 进行交集,发现3 个网站同时预测到的miRNA 中有感兴趣的miR-338,因此选用miR-338进行后续研究。
2.2 细胞转染效率的检测NG 组、sh-control 组、sh-CircHIPK3 组细胞转染效率分别为0%、(86.52±6.42)%、(89.73±7.21)%,见图1。

图1 荧光显微镜检测各组U251细胞转染效率(电转染×200) 图3 Transwell检测各组U251细胞迁移能力(结晶紫染色×200) 图4 倒置显微镜观察各组U251细胞侵袭能力(结晶紫染色×200)
2.3 qRT-PCR 检测CircHIPK3、miR-338 表达水平与NG 组相比,sh-control 组CircHIPK3、miR-338表达水平差异无统计学意义(P>0.05);与NG 组、shcontrol组相比,sh-CircHIPK3组CircHIPK3表达水平显著下降(P<0.05),miR-338 表达水平显著升高(P<0.05)。见表2。
表2 qRT-PCR检测CircHIPK3、miR-338表达水平∕ ± s

表2 qRT-PCR检测CircHIPK3、miR-338表达水平∕ ± s
注:NG 组为空白组,Sh-control 为转染对照组,Sh-CircHIPK3 为环状RNA 同源域相互作用蛋白激酶3 转染组,CircHIPK3 为环状RNA同源域相互作用蛋白激酶3,miR-338为微核糖核酸-338。①与NG组比较,P<0.05。②与sh-control组比较,P<0.001。
miR-338 1.00±0.00 1.12±0.19 1.89±0.28①②46.42<0.001组别NG组sh-control组sh-CircHIPK3组F值P值重复次数6 6 6 CircHIPK3 1.00±0.00 1.06±0.26 0.56±0.06①19.47<0.001
2.4 敲减CircHIPK3 对U251 细胞迁移、侵袭能力的影响与NG 组相比,sh-control 组U251 细胞划痕愈合率、迁移细胞数没有显著变化;与NG 组、sh-control 组比较,CircHIPK3 敲减组U251 细胞划痕愈合率、迁移细胞数显著降低(P<0.05),见表3;图2,3。

图2 划痕实验检测敲减CircHIPK3对U251细胞迁移能力的影响(结晶紫染色×200)
表3 敲减CircHIPK3对U251细胞迁移、侵袭能力的影响∕ ± s

表3 敲减CircHIPK3对U251细胞迁移、侵袭能力的影响∕ ± s
注:NG 组为空白组,Sh-control 为转染对照组,Sh-CircHIPK3 为环状RNA同源域相互作用蛋白激酶3转染组。①与NG组比较,P<0.001。②与sh-conqrol组比较,P<0.001。
重复次数6 6 6划痕愈合率∕%25.66±2.37 26.38±2.53 10.36±1.53①②组别NG sh-control sh-CircHIPK3迁移细胞数∕个196.72±18.75 194.65±17.86 95.58±8.66①②侵袭细胞数∕个164.89±12.55 165.77±12.16 80.13±11.37①②104.42<0.001 F值P值88.61<0.001 101.74<0.001
与NG 组相比,sh-control 组U251 细胞侵袭细胞数没有显著变化;与NG 组、sh-control 组比较,CircHIPK3 敲减组U251 细胞侵袭数明显减少(P<0.05),见表3,图4。
2.5 敲减CircHIPK3对U251细胞MMP-2、MMP-9蛋白表达的影响与NG 组、sh-control 组相比,sh-CircHIPK3 组MMP-2、MMP-9 蛋白表达显著降低(P<0.05),见表4,图5。
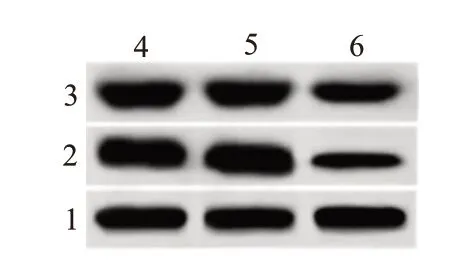
图5 敲减CircHIPK3对MMP-2、MMP-9蛋白表达的影响
表4 敲减CircHIPK3对MMP-2、MMP-9蛋白表达的影响∕ ± s
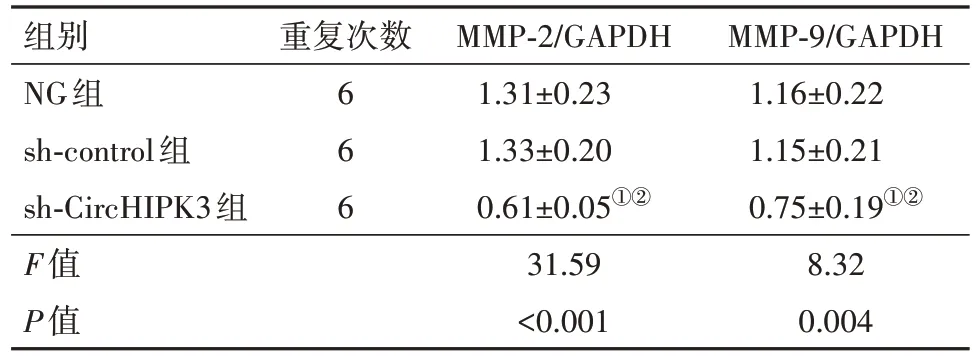
表4 敲减CircHIPK3对MMP-2、MMP-9蛋白表达的影响∕ ± s
注:NG组为空白组,Sh-control为转染对照组,Sh-CircHIPK3为环状RNA 同源域相互作用蛋白激酶3转染组,MMP-9为基质金属蛋白酶-9 ,MMP-2为基质金属蛋白酶-2,GAPDH为甘油醛-3-磷酸脱氢酶。①与NG组比较,P<0.05。②与sh-control组比较,P<0.05。
MMP-9∕GAPDH 1.16±0.22 1.15±0.21 0.75±0.19①②8.32 0.004组别NG组sh-control组sh-CircHIPK3组F值P值重复次数6 6 6 MMP-2∕GAPDH 1.31±0.23 1.33±0.20 0.61±0.05①②31.59<0.001
2.6 敲减CircHIPK3对U251细胞周期的影响与NG 组、sh-control 组相比,sh-CircHIPK3 组中G1期细胞比例升高,S 期细胞比例降低(P<0.05),而G2期细胞比例变化差异无统计学意义,见表5。
表5 敲减CircHIPK3对U251细胞周期的影响(n=6)∕(%, ± s)

表5 敲减CircHIPK3对U251细胞周期的影响(n=6)∕(%, ± s)
注:NG 组为空白组,Sh-control 为转染对照组,Sh-CircHIPK3 为环状RNA同源域相互作用蛋白激酶3转染组。①与NG组比较,P<0.001。②与sh-control组比较,P<0.001。
S期细胞比例26.45±0.39 26.57±0.41 20.72±0.18①②567.82<0.001组别NG组sh-control组sh-CircHIPK3组F值P值重复次数6 6 6 G1期细胞比例58.72±0.36 58.45±0.27 64.72±0.47①②588.06<0.001 G2期细胞比例14.83±0.15 14.98±0.14 14.56±0.16 10.26 0.002
2.7 CircHIPK3 靶向调控基因的关系验证TargetScan数据库预测结果显示,mir-338 在CircHIPK3 3"UTR 有相应的结合位点;萤光素酶报告实验结果显示,与p-GL4-HIPK3-WT+miR-338 NC 组相比,p-GL4-HIPK3-WT+miR-338 mimics 组U251 胶质瘤细胞荧光素酶活性显著降低(P<0.05),p-GL4-HIPK3-MUT+miR-338 NC 组与p-GL4-HIPK3-MUT+miR-338 mimics 组相比差异无统计学意义(P>0.05),见表6。
表6 荧光素酶报告实验检测mir-338与Circ HIPK3的靶向作用关系∕ ± s

表6 荧光素酶报告实验检测mir-338与Circ HIPK3的靶向作用关系∕ ± s
注:①与miR-338 NC+WT组相比,P<0.05。
组别MiR-338 NC+WT组MiR-338 mimics+WT组MiR-338 NC+MUT组MiR-338 mimics +MUT组F值P值相对荧光素酶活性1.00±0.24 0.51±0.11①1.01±0.23 0.97±0.22 32.36<0.001重复次数6 6 6 6
3 讨论
胶质瘤是最常见的侵袭性原发性脑肿瘤,由于其很强的侵袭性,导致预后较差[7-8]。CircHIPK3 是一种长度为1 099 bp的环状RNA,对多种癌症(包括肺癌,结肠直肠癌和神经胶质瘤)的进展具有显著的促进作用[9-11]。CircHIPK3 能够通过结合许多肿瘤的miRNA 来增强细胞生长和转移[12-13]。例如,在肝癌细胞中CircHIPK3可以吸附miR-124,从而调节miR-124 的靶基因PDK2 促进肝癌细胞的细胞增殖和侵袭[14];在非小细胞肺癌中,CircHIPK3 可以吸附miR-149 促进FOXM1 的表达,从而影响细胞增殖和凋亡[15]。尽管已有研究证明在神经胶质瘤组织中CircHIPK3 表达的增加可以作为预后生物标志物,但是CircHIPK3 在神经胶质瘤中的具体机制尚不完全清楚。本研究发现,与NG 组、sh-control 组相比,CircHIPK3 敲减组胶质瘤U251 细胞划痕愈合率、迁移、侵袭细胞数明显减少,G1期细胞比例升高,S 期细胞比例降低。说明沉默CircHIPK3 可能通过抑制胶质瘤U251 细胞侵袭、迁移能力与细胞周期,进而抑制胶质瘤的进展。
大量研究显示,环状RNA 可以与miRNA 相互作用来调节下游基因,进而促进许多癌症的发展。miRNA 是一类小分子单链RNA,广泛存在于真核生物中。已有研究证明,miRNA 可以直接参与肿瘤的发生发展[16]。有研究报道,过表达miR-338-3p 通过下调KIF2A 抑制非小细胞肺癌细胞增殖、侵袭[17-18]。miR-338 通过下调ZEB2 抑制肝癌细胞的侵袭与迁移[19-20]。本研究发现,miR-338 是CircHIPK3 潜在靶基因。当沉默CircHIPK3 时,qPCR 结果显示CircHIPK3 表达水平显著下调,而miR-338 表达水平显著升高。猜测CircHIPK3 可能通过调控miR-338 的表达进而在胶质瘤的发生发展中起到重要的作用。本研究通过双萤光素酶报告实验证实了CircHIPK3可靶向调控miR-338基因。此外,CircHIPK3敲减可显著抑制胶质瘤U251 细胞中MMP-2、MMP-9 蛋白表达,表明在胶质瘤U251 细胞中,CircHIPK3 敲减可显著促进miR-338 基因表达,并可能通过抑制MMP-2、MMP-9蛋白表达来细胞侵袭、迁移。
综上所述,CircHIPK3 在胶质瘤U251 细胞中高表达,其可能通过靶向miR-338 表达促进胶质瘤U251细胞的迁移、侵袭,并影响细胞周期,CircHIPK3可能成为治疗胶质瘤的潜在靶标。然而,本研究尚存在不足之处,关于胶质瘤中CircHIPK3 靶向miR-338具体调控过程,需深入研究并进行验证。
(本文图1,3,4见插图1-3)
