阻塞性睡眠呼吸暂停综合征对肥胖病人肺功能的影响分析
2024-01-18李文丽陈碧季磊张灿堂何军张文辉
李文丽,陈碧,季磊,张灿堂,何军,张文辉
作者单位:1徐州医科大学研究生院,江苏 徐州221000;2徐州医科大学附属医院呼吸与危重症医学科,江苏 徐州221000
阻塞性睡眠呼吸暂停综合征(OSAHS)是最常见的睡眠呼吸疾病,表现为打鼾、睡眠中断,白天嗜睡、记忆力下降,可能会并发各种心脑血管疾病,造成生活质量的明显下降。OSAHS 的严重程度与肥胖程度呈正相关[1-2]。这两种综合征可能有共同的危险因素,它们之间也可能存在双向因果关系,因此,在肥胖人群中筛查OSAHS 十分必要。OSAHS可加重肥胖病人的肺功能损伤,目前国内对患有OSAHS 的肥胖病人肺功能的损伤研究尚较少。本研究通过比较不同OSAHS 严重程度的肥胖病人的肺功能损害情况,分析OSAHS对肥胖病人肺功能的影响,为肥胖病人早期诊断OSAHS 及筛选高OSAHS风险人群提供临床参考。
1 资料与方法
1.1 一般资料选取2018 年9 月至2022 年4 月于徐州医科大学附属医院睡眠中心就诊的160例肥胖病人,记录性别、年龄、身高、体质量、身体质量指数(BMI)、Epworth 评分,行多导睡眠图(PSG)检查、肺功能测定。依据我国OSAHS分级标准分为:单纯肥胖组(A 组,33 例)、肥胖合并轻度OSAHS 组(B 组,31 例)、肥胖合并中度OSAHS 组(C 组,32 例)、肥胖合并重度OSAHS组(D组,64例)。
纳入标准:①BMI>28.0 kg∕m2;②年龄超过16 周岁;③经多导睡眠监测诊断为OSAHS,OSAHS 诊断标准依据2018年中华医学会呼吸病学会制定的《成人阻塞性睡眠呼吸暂停低通气综合征诊治指南》[3];④获病人本人及其近亲属同意。排除标准:①其他疾病引起的睡眠障碍,如单纯性鼾症、发作性睡病或中枢性睡眠呼吸暂停综合征;②严重心脑血管疾病、严重肝、肾功能不全、恶性肿瘤等;③接受持续正压通气(CPAP)治疗、减重手术或其他治疗;④上气道阻力综合征、慢性阻塞性肺疾病、肺间质疾病、哮喘等慢性呼吸系统疾病。本研究符合国家医学伦理学规范,经徐州医科大学附属医院医学伦理委员会批准(批号XYFY2022-KL049-01)。
1.2 研究方法
1.2.1 多导睡眠监测 PSG采用澳大利亚康迪公司Compumedice E 型,包含脑电图、眼电图(EOG)、心电图、肌电图(EMG)、口鼻呼吸气流及胸腹呼吸运动、血氧饱和度、睡眠时体位变化、睡眠时鼾声等,从夜间22 点至次日早晨6 点,连续监测7 h 以上。记录睡眠呼吸暂停低通气指数(AHI)、平均血氧饱和度(MSaO2)、最低血氧饱和度(LaSO2)、最长呼吸暂停时间(LAT)。
1.2.2 肺功能检查 肺功能指标:潮气量、深吸气量(IC)、补呼气容积(ERV)、肺活量、用力肺活量(FVC)、第一秒用力呼气容积(FEV1)、第一秒用力呼气量占所有呼气量的比例(FEV1∕FVC)、用力呼出75%肺活量时的平均呼气流速(MEF75)、用力呼出50%肺活量时的平均呼气流速(MEF50)、用力呼出25%肺活量时的平均呼气流速(MEF25)、最大呼气中期流量(MMEF)、呼气流量峰值(PEF)、每分钟最大通气量(MVV)、肺总量(TLC)、功能残气量(FRC)、残气容积(RV)、残气量∕肺总量(RV∕TLC)、肺一氧化碳弥散量(DLCO)、每升肺泡容积的一氧化碳弥散量(Kco)。肺功能测定采用德国耶格肺功能仪,参考全国肺功能正常值汇编和方法,以各指标在正常预计值的80%~120%为正常。
1.2.3 血液学及生化指标 血液学指标:白细胞计数(WBC)、血小板分布宽度(PDW)、中性粒细胞∕淋巴细胞百分比(NLR)、血小板∕淋巴细胞百分比(PLR)。
生化指标:超敏C反应蛋白(hs-CRP)、糖化血红蛋白(HbA1c)、尿素、肌酐、尿酸、胱抑素C(Cys-C)等指标。
1.2.4 分组 依据AHI 分成四组,比较各组别PSG参数及肺功能指标的差异,分析探讨肥胖病人中OSAHS 的病情严重程度对其肺功能的影响及各指标间的关系。
1.3 统计学方法采用SPSS 21.0 进行分析。计量资料符合正态分布的采用±s表示,组间比较采用单因素方差分析,进一步采用LSD 法进行两两比较。非正态分布计量资料采用中位数(第25、75 百分位数)、即M(P25,P75)表示,组间比较采用 Kruskal-WallisH检验。分类计数资料采用χ2检验。相关性分析用偏相关性分析,用多元线性逐步回归筛选影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较四组年龄、饮酒情况差异无统计学意义(P>0.05)。D 组吸烟及患有高血压、糖尿病、高脂血症、脂肪肝、高尿酸血症的比例均明显高于其他三组(P<0.05)。D 组BMI 明显高于A、B 两组,均差异有统计学意义(P<0.05)。C组和D 组ESS评分较A 组明显升高(P<0.05)。D 组的男性比例较别组明显升高,差异有统计学意义(P<0.05)。见表1。
2.2 四组血液学及生化相关指标比较四组PDW、尿素、肌酐差异无统计学意义(P>0.05)。D 组WBC 明显高于A 组(P<0.05),D 组PLR 均明显低于其他三组(P<0.05),D 组尿酸、HbA1c 明显高于A 组和B组(P<0.05)。A组NLR均明显低于其他三组(P<0.05)。A 组CysC 均显著低于其他三组(P<0.05),B组CysC 明显低于D 组(P<0.05)。相比于A 组,C 组和D组的hs-CRP明显升高(P<0.05))。见表2。
Pearson 相关 性 分析显 示,OSAHS 组AHI 与 尿酸、CysC 均呈正相关(r值分别为0.32、0.25,均P<0.01),在矫正BMI 后,OSAHS 组病人血清尿酸、CysC 水平仍与AHI 呈正相关(r值分别为0.31、0.18,均P<0.05)。OSAHS 组血清CysC 与LSaO2呈负相关(r=-0.20,P<0.05),矫正BMI 后,OSAHS 组病人血清CysC水平仍与LaSO2呈负相关(r=-0.18,P<0.05)。
OSAHS 组WBC、hs-CRP、PLT、NLR、PLR、肌酐与睡眠相关参数以及肺功能指标均无相关性(均P>0.05)。
2.3 四组PSG 监测结果比较D 组AHI 高于其他三组,LSaO2均低于其他三组,差异有统计学意义(P<0.05),且AHI 随OSAHS 的严重程度加重而升高,LSaO2则反之,差异有统计学意义(P<0.05)。较A、B两组,C 和D 组的MSaO2明显下降,均差异有统计学意义(P<0.05)。A 组LAT 均优于其他三组,差异有统计学意义(P<0.05)。见表3。
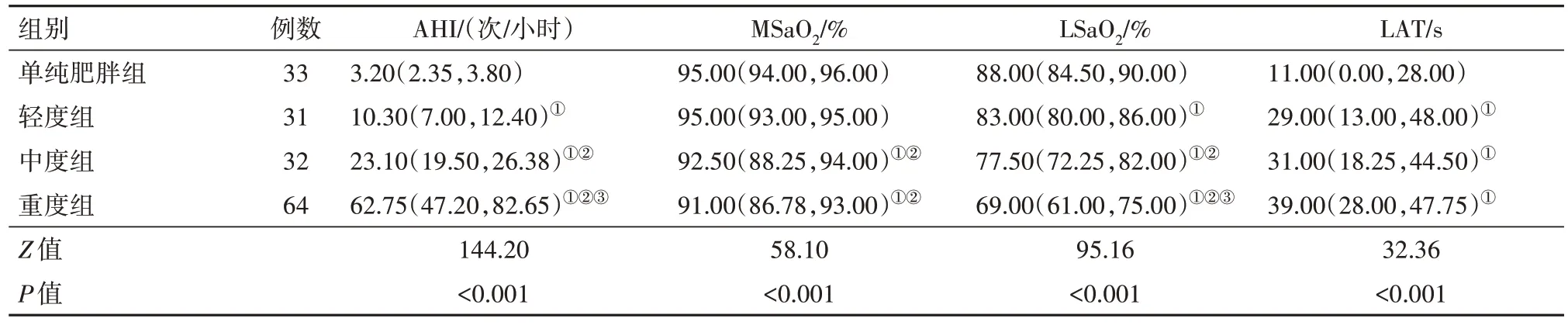
表3 阻塞性睡眠呼吸暂停综合征160例PSG监测结果比较∕M(P25,P75)
2.4 四组肺功能结果比较D 组ERV、肺活量、FVC、TLC 水平均低于A 组(P<0.05)。D 组RV 水平低于C 组(P<0.05)。D 组Kco 水平高于其他三组(P<0.05)。A 组肺活量水平明显高于C 组和D 组(P<0.05)。其余指标四组比较差异无统计学意义(P>0.05)。见表4。
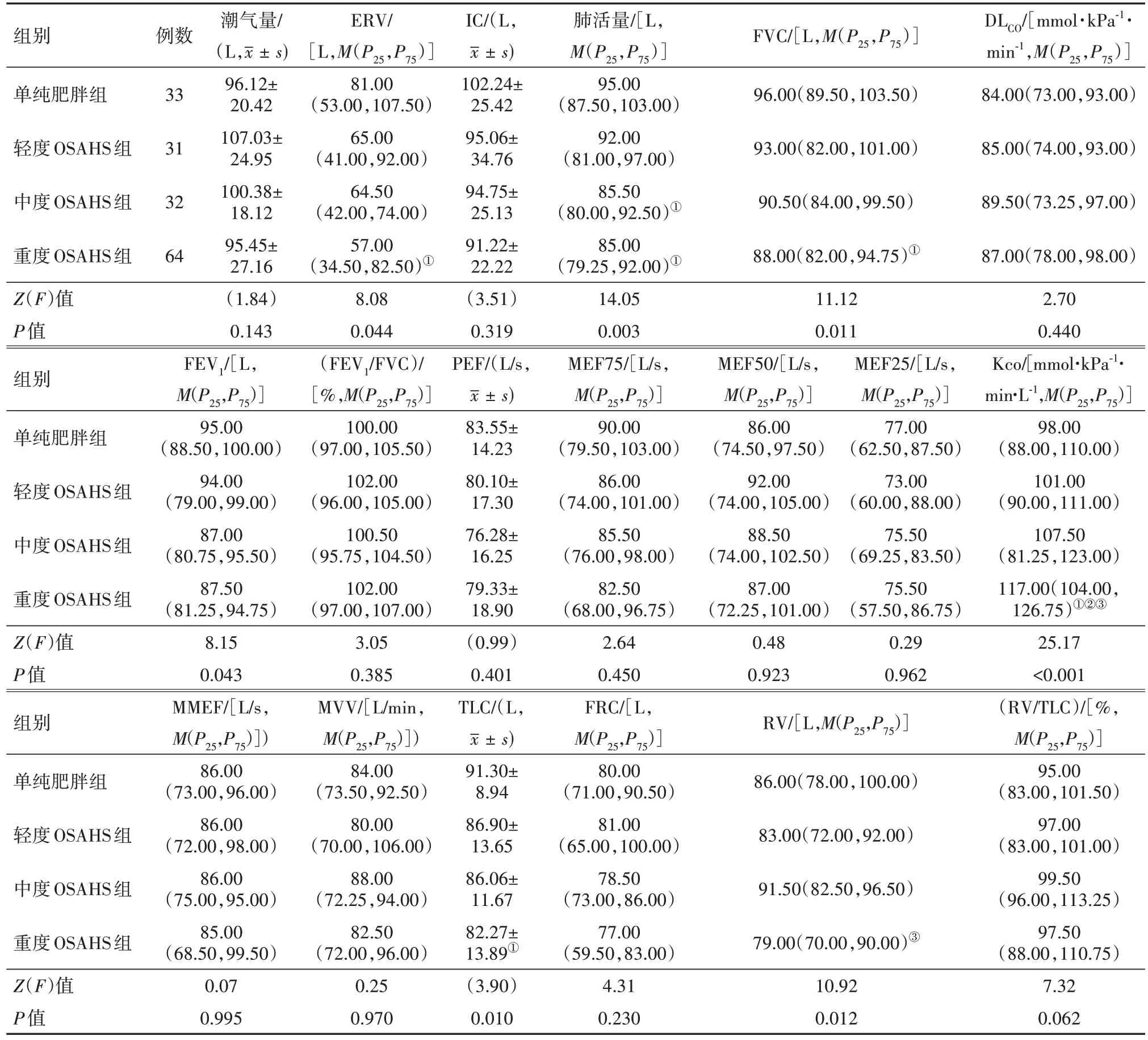
表4 阻塞性睡眠呼吸暂停综合征160例四组肺功能指标比较
2.5 PSG 结果与肺功能指标的相关性分析校正BMI、年龄后,AHI 与肺活量、FVC、TLC 及FRC 呈负相 关(P<0.05),与FEV1∕FVC、Kco 呈 正 相 关(P<0.05);MSaO2与肺活量、FVC、TLC 及FEV1呈正相关(P<0.05);LSaO2与肺活量、FVC、ERV、FEV1、TLC、FRC、PEF呈正相关(P<0.05),LSaO2与Kco呈负相关(P<0.05);ESS 评分与Kco 呈正相关(P<0.05),ESS评分与MEF75呈负相关(P<0.05)。见表5。
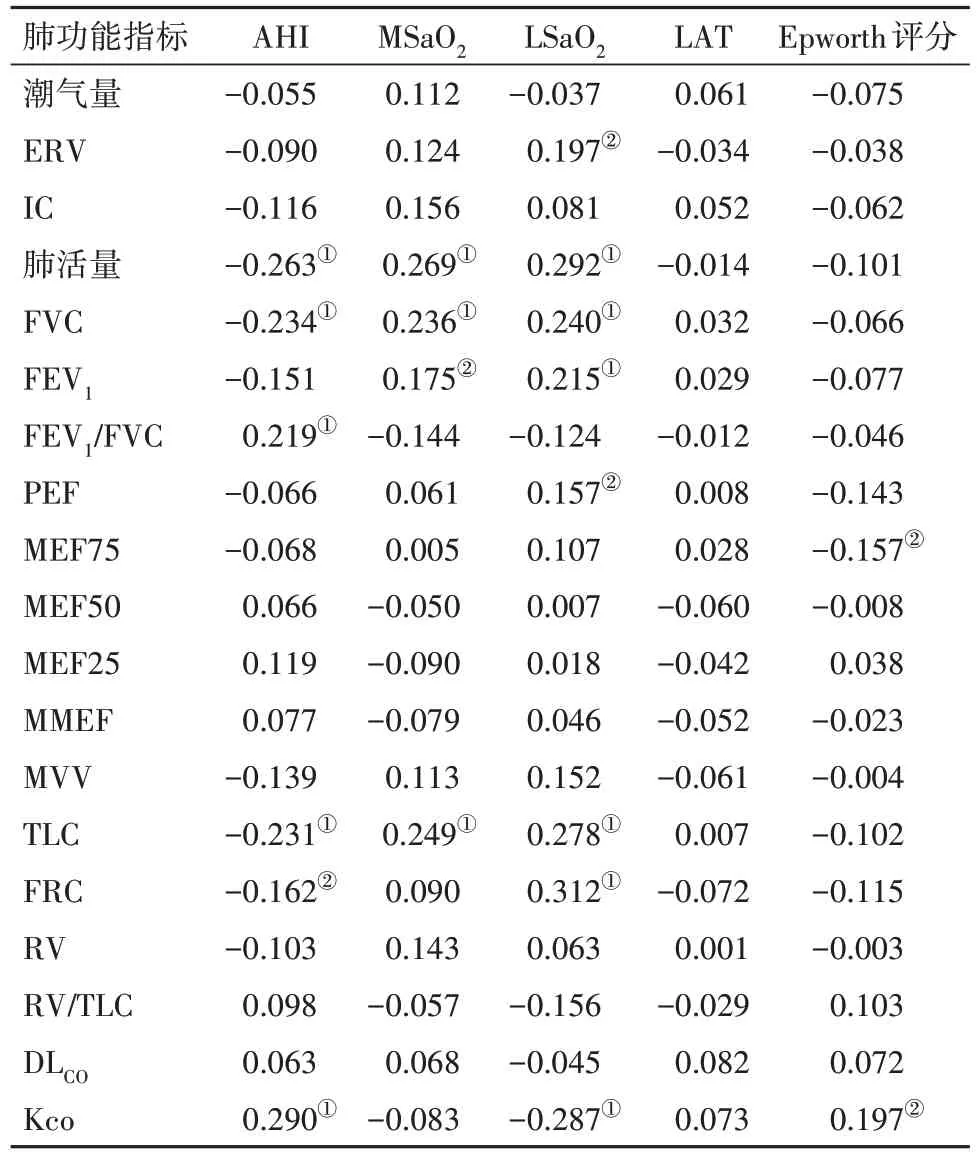
表5 OSAHS 160例多导睡眠监测与肺功能指标的偏相关性分析(r值)
2.6 影响肺功能的多元逐步回归分析以FVC 为因变量,以BMI、年龄及PSG相关参数为不同自变量进行多因素逐步回归分析:AHI 进入回归方程,对FVC 具有显著影响(P<0.05)。PSG 相关指标中的AHI是肥胖病人FVC损害的独立危险因子(表6)。

表6 阻塞性睡眠呼吸暂停综合征160例影响FVC水平的多元线性逐步回归
以肺活量、TLC 为因变量,以BMI、年龄及PSG相关指标为不同自变量进行多因素逐步回归分析:LSaO2、MSaO2进入回归方程,对肺活量、TLC 具有显著影响(P<0.05)。PSG 相关指标中的LSaO2、MSaO2是肥胖病人肺活量、TLC 损害的独立危险因子(表7)。

表7 阻塞性睡眠呼吸暂停综合征160例影响肺活量、TLC、FEV1、Kco水平的多元线性逐步回归
以Kco 为因变量,以BMI、年龄及PSG 相关参数为不同自变量进行多因素逐步回归分析:AHI、BMI进入回归方程,对Kco 具有显著影响(P<0.05)。AHI、BMI 是肥胖病人Kco 变化的独立影响因子(表7)。
综上所述,AHI 是肥胖病人肺功能指标FVC 损害和Kco 升高的独立危险因子,最低血氧是肥胖病人肺活量、TLC、FEV1损害的独立危险因子。
3 讨论
OSAHS 是公认的肥胖并发症。有研究报道[4],约70%的睡眠呼吸暂停病人患有肥胖,40%的肥胖病人患有睡眠呼吸暂停。肥胖人群中OSAHS的患病率则为普通人群的2倍,在进行减重手术治疗的病态肥胖病人中,OSAHS的患病率则达到60%~86%[5]。
肥胖病人胸腹的脂肪沉积降低肺、胸壁和整个呼吸系统的顺应性,并限制膈肌的向下运动和胸壁的向外运动,呼气储备容量(ERV)和肺的静息容量(FRC)都急剧减少[6-8]。在先前关于肥胖对气道的研究中,发现FEV1和FVC 在肥胖病人中略有降低,FEV1∕FVC 比值通常不受影响[9],但RV∕TLC 则为正常的或略有增加[10]。研究报道,肥胖病人体重减轻后,最大呼气流量(PEF)和肺活量指数(VC∕BMI)有所改善[11],肺容积也有显著增加,尤其是TLC、FRC和ERV[12]。例如,一篇于2021 年发表在ELSEVIER上的外科医学文献[13]通过测量病态肥胖病人术前和术后一年的静态和动态肺容量,发现术后1 年肺容积ERV、IRV、TLC、FRC、RV 均有明显变化,FEV1、FEV1%、FEF50%、PEF、MVV等动态容积均呈明显增加。国内则发现减重手术半年后OSAHS 病人的夜间MSaO2、LSaO2、MVV、MMEF、DLCO、FEV1、FVC、FEV1∕FVC较术前均有明显升高[14]。
有报告称OSAHS 病人的肺功能丧失与全因死亡率之间的显著关联[15],但睡眠呼吸障碍对肺功能指数的影响目前还没有得到很好的描述。OSAHS 是一种以上呼吸道完全或部分塌陷为特征的呼吸道疾病,有学者[8]称肥胖OSAHS 病人的总呼吸阻力和外周气道阻力明显增加,其反向呼吸道传导(Grs)降低,并且在矫正BMI 后,Grs 与OSAHS严重程度独立相关。Kunos 等[16]通过评估一组OSAHS 病人肺功能指数的日变化,并将肺功能变化与疾病严重程度联系起来,发现OSAHS 组的FEV1从夜间(全组数据的范围为1.54~4.46 L,中位数为2.18 L)到清晨(全组数据的范围为1.42~4.63 L,中位数为2.26 L)有明显上升,且夜间FEV1变化与RDI 有明显的直接相关趋势。该研究发现肥胖合并OSAHS 是FEV1昼夜变化的影响因素,BMI 是肺功能和OSAHS 严重程度关系的协变量。BMI 的增加与FEV1和FVC 的急剧下降有关。但该研究在纠正BMI 后发现OSAHS 症状评分仍与FEV1和FVC的明显下降有关。
随着BMI的增加,TLC略有降低,即使是严重肥胖的病人也是如此。在肥胖者中,RV 通常在正常范围内,RV∕TLC 也是正常的或略有增加,FEV1和FVC 在肥胖的情况下略有降低[10]。本研究显示,在肥胖合并OSAHS 的病人中,重度OSAHS 组病人FVC、肺活量、TLC、ERV 较单纯肥胖组明显下降;矫正年龄和BMI 后,AHI 与肺活量、FVC、TLC 及FRC呈负相关,MSaO2、LSaO2与FVC、肺活量、TLC呈正相关,这提示肥胖病人患OSAHS 后,FVC、TLC 及FRC进一步损害。此外,与前人研究不同的是,本研究并未发现OSAHS 病人的FEV1和FRC 较单纯肥胖病人有明显下降,但在矫正年龄与BMI 后,LSaO2与FEV1、ERV 及FRC 呈正相关,提示OSAHS 病人尽管AHI 未达到非常严重的程度,但LSaO2的严重程度也可以反映出FEV1、ERV 及FRC 的损害程度。此外,对低氧的耐受力与OSAHS 相关症状及OSAHS的病情严重程度密切相关,而LSaO2与FEV1、ERV及FRC 的明显下降有关,提示OSAHS 的症状表现、病情严重程度或许与肺功能的损害存在某种联系。重度OSAHS 病人较单纯肥胖病人肺活量、TLC 明显下降,提示OSAHS 加剧肺容积受损;FVC 明显降低,提示OSAHS加剧通气功能受损。FVC、肺活量、TLC或许可以作为辅助筛查OSAHS 及评估肥胖病人OSAHS 严重程度的预计指标。此外,关于肥胖病人DLCO扩散能力的研究呈现出矛盾的结果,一些研究显示这些受试者的DLCO增加,而另一些研究人员报告DLCO减少,可能是由于肺泡体积减小或脂质沉积增加引起的间质结构改变[17]。本研究发现Kco水平在肥胖合并重度OSAHS 人群有明显升高,且LSaO2与Kco呈负相关。
尿酸为慢性肾脏病的独立危险因素,尿酸排泄与夜间低氧血症有关[18],且尿酸排泄量越高,死亡率越高。高水平尿酸刺激IL-6、TNF-α 与CRP 等炎性因子升高,导致肾脏的炎症反应,尿酸水平可以反映OSAHS 病人肾损伤的程度[19]。CysC 因相对稳定,不易受代谢、生活方式等影响,已代替肌酐[20]逐渐成为早期肾功能损害评价与预测的标志物[19,21-22],本研究结果与前人相符,且矫正BMI 后,CysC 仍与AHI 呈正相关,与LSaO2呈负相关,提示相对于肌酐、尿素、尿酸,CysC 对慢性肾脏病的早期诊断更为灵敏。OSAHS 病人夜间上呼吸道塌陷和随后的慢性间歇性缺氧导致重复的缺氧和复氧循环,增强全身氧化应激,并导致全身炎症相关生物标志物的形成。全身炎症的发生是一个关键因素,它将肥胖和OSAHS 联系在一起,导致全身各器官系统受到损害,表现为不同时期不同的症状发生。本研究发现OSAHS 组NLR、hs-CRP 较单纯肥胖组明显升高,PLR 则相反,但组间差异无统计学意义,与AHI、LSaO2也无相关性,可能是受样本量所限。肥胖对肺功能的影响主要是由于对呼吸机机械结构的干扰以及对肺功能产生不利影响的炎性因子所致,肥胖导致限制性通气功能障碍,肥胖相关的炎症途径加重OSAHS病人的肺功能损害[23]。
本研究样本量较少,仍需扩大样本量进一步研究;样本人群大多为青年人,OSAHS 的患病率不高,肺功能损害较轻微,不能代表中老年人及肥胖症高发人群等;Bikov 等[24]发现长期CPAP 治疗与肺功能恶化有关,本研究未通过减重或持续正压通气等治疗后进一步评估肥胖OSAHS病人肺功能变化;本研究未能详细阐述性别在肥胖OSAHS 病人中的差异以及性别对OSAHS病人肺功能的影响;未能清楚阐明OSAHS 在肥胖的基础上对气道改变及肺功能损害的独立影响机制。
综上所述,随着OSAHS 严重程度的增加,肥胖病人的肺功能损害加剧,排除BMI 的影响后,OSAHS 病情严重程度与肺功能参数的明显下降密切相关。AHI 是肥胖病人肺功能指标FVC 的独立危险因子,LSaO2是肥胖病人肺活量、TLC、FEV1损害的独立危险因子,通过对肥胖病人进行PSG 检查,评估OSAHS 严重程度,可辅助判断肺功能损害程度。OSAHS 可能在肺功能下降中起作用,虽然肺功能损害不在OSAHS 的诊断标准里,但在OSAHS 病人,尤其是患有重度OSAHS 的肥胖病人中,肺功能下降明显,可能与气道的塌陷及肺容积减少有关,肥胖病人进行肺功能检查可早期评估OSAHS 高风险。
