甘露醇对草菇继代菌株生产性状和ROS 清除能力的影响
2024-01-17赵风云程志虹谭强飞朱嘉宁孙万合张紊玮贠建民
赵风云,程志虹,谭强飞,朱嘉宁,孙万合,张紊玮,贠建民
甘肃农业大学食品科学与工程学院,兰州 730070
0 引言
【研究意义】食用菌菌种相当于作物的种子,菌种质量直接影响食用菌的产量,但菌种退化是众多食用菌存在的共性问题,草菇(Volvariellavolvacea)也不例外。作为典型的高温型食用菌,草菇不耐贮藏的特性使其菌种退化尤为严重[1]。甘露醇是一种天然的六碳糖醇,在食用菌中承担着调节渗透压、清除活性氧(reactive oxygen species,ROS)、增强逆境抵抗力等重要的生物学功能[1]。本研究以同等质量的甘露醇替换传统马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)中的葡萄糖,并在栽培基质中添加甘露醇;测定草菇继代菌株的生产性状和ROS 清除能力相关指标,探索一种简便、有效的草菇退化菌种复壮方法,并挖掘其作用机制,为延缓草菇菌种退化提供理论依据和技术支持。【前人研究进展】草菇是我国主要出口菇类之一,产量约占世界总量的80%以上[2]。但据中国食用菌协会统计,近十年来草菇的年产量逐年下滑,菌种退化可能是其中的重要原因之一。ZHAO等[3]研究表明,草菇菌种退化可能与体内ROS 的过度积累有关。XIONG 等[4]通过过表达谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)基因提高蛹虫草的ROS清除能力,使其退化菌株重新长出了子实体。ROS是生物体内化学性质活泼、氧化能力很强的含氧物质的总称,如超氧阴离子()、过氧化氢(H2O2)等[5]。在生理稳态条件下,ROS 通过各种抗氧化防御机制解毒,但过量的ROS 生成会损害防御系统,导致氧化应激、细胞损伤甚至导致细胞死亡[6]。线粒体是真核细胞中制造能量的工厂,也是各种胁迫下ROS产生和积累的主要部位[7]。线粒体膜电位能够反映并影响线粒体结构的完整性[8]。为了避免ROS 对机体造成损伤,真菌通过体内的酶系统和非酶物质来清除多余的ROS[9]。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽还原酶(glutathione reductase,GR)、GPX 等抗氧化酶的活力[10]和抗坏血酸、谷胱甘肽、类胡萝卜素、甘露醇等抗氧化剂的含量可直接反映食用菌的ROS 清除能力[11],并影响着菌丝生长和子实体发育[12]。甘露醇是最常见的真菌代谢产物之一,它普遍存在于大多数食用菌中[13]。甘露醇在体外和体内均被证明是ROS猝灭剂,能够保护生物体细胞免受ROS 侵害[14]。在油橄榄中,甘露醇可抵抗因盐和干旱而产生的氧化应激[15]。ZHOU 等[16]发现退化的平菇菌丝体和子实体中的甘露醇含量明显少于正常菌株。张秀伟等[17]研究发现外源添加甘露醇可以促进鸡腿菇菌丝体生长,使菌丝更加浓密。【本研究切入点】菌种退化是一种普遍现象,严重制约了食用菌产业的健康发展。开展食用菌退化菌种复壮研究以降低因菌种退化导致的经济损失,具有重要科学意义和应用价值,但关于退化菌种复壮机制的研究鲜有报道。在常见的人工栽培食用菌中,草菇的生产周期最短,通常一个月内就可以长出子实体,以草菇作为食用菌菌种退化的研究材料具有典型性和代表性。【拟解决的关键问题】以笔者课题组前期获得的继代菌株T6、T12、T19 和草菇原种V844(T0)为试验菌株。将PDA 培养基中的葡萄糖替换为等质量的甘露醇,并在栽培基质中添加甘露醇,探究甘露醇对草菇退化菌株的复壮效果及复壮机制。
1 材料与方法
试验于2021—2022 年在甘肃农业大学食品微生物实验室进行。
1.1 菌种
草菇原种(T0):草菇V844 保藏于实验室。
草菇继代菌种(T6、T12、T19):由笔者课题组前期通过连续组织分离继代法获得;具体方法如下,将T0 进行栽培试验,获得蛋形期子实体,将子实体切开,在菌柄与菌盖交界处切取一小块进行第1 次组织分离,得到第1 代组织分离继代菌株(tissue isolation strain),标记为T1。将T1 进行栽培试验,获得子实体后进行组织分离,得到第2 代组织分离继代菌株,标记为T2。按照这种方法连续操作19 次获得T1—T19,继续对T19 进行栽培时,发现T19 失去了出菇能力。本研究选择不同继代次数的T6、T12、T19 作为试验菌株。
1.2 仪器与试剂
立式压力蒸汽灭菌锅 ES-315,日本 TOMY KOGYO 有限公司;超低温冰箱MDF-U443D,济南欧莱博仪器有限公司;正倒置一体荧光显微镜Axio Vert.A1,德国卡尔蔡司公司;冷冻离心机TGL-16,湖南湘仪仪器开发有限公司;实时荧光定量PCR 仪Quant Studio 5,美国赛默飞世尔科技公司;高效液相色谱仪(HPLC)Agilent 1100,美国安捷伦科技有限公司;艾科浦超纯水机AWL-1002-M,重庆颐洋企业发展有限公司。
高氯酸购自天津市鑫源化工有限公司;硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)购自上海蓝季科技发展有限公司;5'腺苷-三磷酸(ATP)二钠盐(含量≥98%)、5'腺苷-二磷酸(ADP)二钠盐(含量≥98%)、5'腺苷一磷酸(AMP)二钠盐(含量≥98%)、多聚甲醛、4′,6-二脒基-2-苯基吲哚(DAPI)、线粒体红色荧光探针(Mito-Tracker Red CMXRos)均购自上海源叶生物科技有限公司;甘露醇、葡萄糖、KH2PO4、MgSO4、KOH 均购自天津市光富科技发展有限公司。
1.3 试验方法
1.3.1 培养基制备
PDA 培养基:马铃薯20.0%,葡萄糖2.0%,KH2PO40.1%,MgSO40.1%,琼脂粉2.0%。
种子培养基(w/w):棉籽壳88%,麸皮10%,石膏1%,石灰1%,含水量65%,pH 8—9。
栽培培养基(w/w):废棉97%,石灰3%,含水量约70%,pH 9—10。
甘露醇处理组:将PDA 培养基中的2.0%葡萄糖替换为2.0%甘露醇;种子培养基中的试验用水替换为2.0%的甘露醇水溶液;栽培管理时,将喷洒用水替换为2.0%的甘露醇水溶液。
1.3.2 菌丝性状测定 菌落形态:将所有菌株接种到PDA 培养基上,30 ℃培养3 d 后,观察拍摄菌落形态。
菌丝生长速度:参照CHUNG 等[18]的方法。用打孔器取直径1 cm 的菌丝块接种于PDA 平板中心,30 ℃培养72 h 后,用记号笔在平板上通过十字交叉划线法标记菌落直径,计算菌丝生长速度。计算公式为:
菌丝生物量(g)参照沈林林等[19]的方法。对裁剪成略小于培养皿大小的玻璃纸灭菌处理,将无菌玻璃纸覆盖于凝固的PDA 平板表面。将菌株接种于无菌玻璃纸上,30 ℃培养3 d 后,用载玻片轻轻刮下菌丝体,在60 ℃下干燥至恒重并称重。
1.3.3 子实体农艺学性状测定 参考LI 等[20]的方法制作草菇栽培种,接种于装有1.2 kg 栽培培养基的栽培框(40 cm×20 cm×10 cm)中,用塑料袋套住栽培筐,放入栽培箱中,30 ℃恒温培养。待菌丝长满框后,去掉塑料袋,喷洒出菇水,并打开照明灯和加湿器,提高箱内温度至33 ℃,空气相对湿度保持在85%—90%[21]。每个菌株设3 个重复,在栽培过程中测定以下指标。
原基形成时间(d):记录栽培后,第一个原基萌出需要的时间。
生产周期(d):记录栽培后,子实体长成采收期(蛋形期)所需的时间。
平均单菇重(g):取随机选取的5 个蛋形期子实体,分别称重后,计算平均值。
1.3.4 细胞核数量的测定 参照GAO 等[22]的方法。取直径1 cm 的菌丝块接种于PDA 平板中心,将灭菌好的载玻片斜插入培养基中,30 ℃培养至菌丝占据载玻片约1/3 时,取出载玻片,将10 μL 5 μmol·mL-1DAPI染色液滴于载玻片上,盖上盖玻片,放置于荧光显微镜下观察并计数。
1.3.5 抗氧化酶相关基因的实时荧光定量 PCR(real-time quantitative PCR,RT-qPCR)分析
参照草菇基因组序列(http://jgi.doe.gov),利用Primer Premier 5.0 软件进行引物设计,由西安擎科泽西引物合成公司合成引物。以内体SPRY 结构域蛋白(endosomal SPRY domain protein,SPRYp)基因为内参基因,引物序列如表1 所示。参考王文沛等[23]的方法,进行RT-qPCR 扩增,使用2-ΔΔCT方法计算基因的相对表达量。
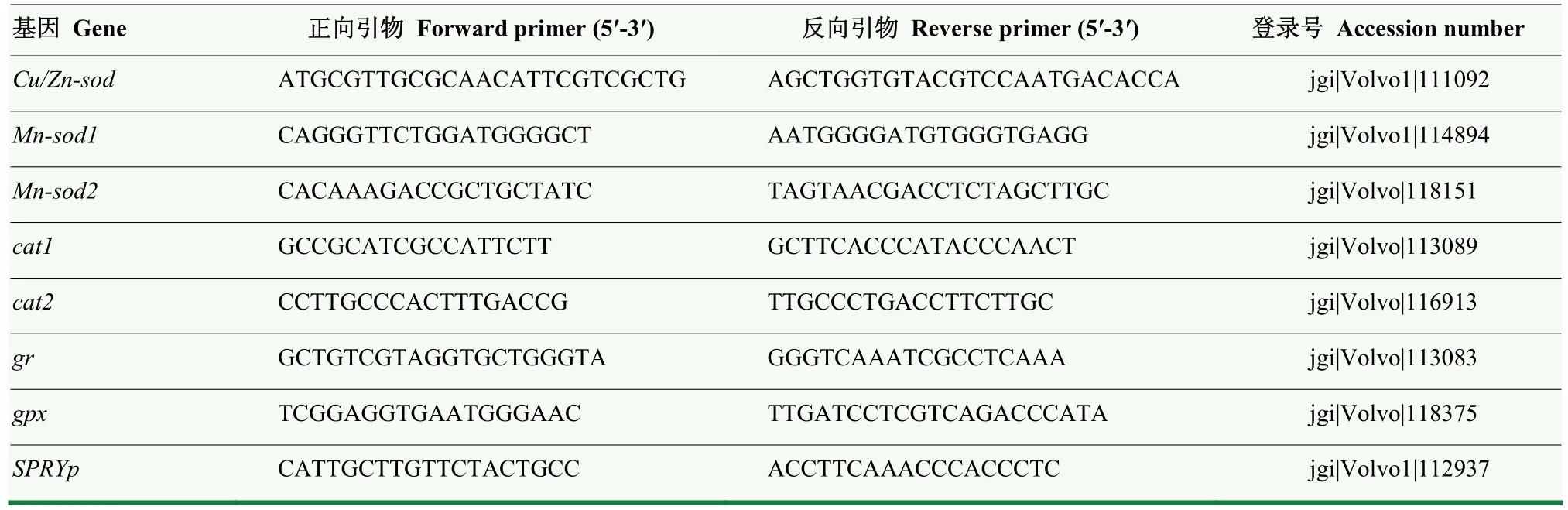
表1 RT-qPCR 分析的引物序列Table 1 Primers used for RT-qPCR
1.3.6 抗氧化酶活力和ROS 含量的测定 将菌丝块接种在PDA 培养基中培养3 d,收集菌丝。然后使用商业试剂盒(上海优选生物科技有限公司),参照说明书检测细胞内SOD、CAT、GPX、GR 活力水平和、H2O2的含量。
1.3.7 NBT 染色 载玻片菌丝制备方法同1.3.4,待菌丝长到占载玻片1/2 处时,取出载玻片,将20 μL 0.3 mmol·L-1NBT 溶液滴到载玻片的菌丝密集处,室温反应15 min,放置于光学显微镜下观察菌丝颜色[24]。
1.3.8 线粒体膜电位测定 载玻片菌丝制备方法同1.3.4,待菌丝长到占载玻片1/2 处时,取出载玻片,滴上 3.7%多聚甲醛,20 min 后用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3 次,随后滴加线粒体红色荧光探针染液,孵育20 min,再次冲洗3 次,放置于荧光显微镜下观察菌丝荧光强度[25]。
1.3.9 菌丝体能量的测定 参考PENG 等[26]的方法。称取0.2 g 草菇菌丝,冰浴研磨;然后加入2 mL 3%的高氯酸溶液,4 ℃下10 000 r/min 离心10 min 后,吸取1 mL 上清液,再加入60 μL 20%的KOH 溶液,混合均匀,4 ℃下静置20 min;然后在4 ℃下10 000 r/min 离心10 min,取上清液。采用HPLC 法进行ATP、ADP 和AMP 含量的测定。精确称取ATP、ADP 及AMP标准品20 mg,用超纯水溶解,配制成1.0 mg·mL-1作标准贮备液,进一步稀释成5、10、50、100、200、300 和400 μg·mL-1的标准液。标准品及样品均用φ0.45 μm 的聚四氟乙烯膜过滤。色谱柱为Eclipse Plus C18(5 μm,150 mm×4.6 mm),流动相为pH 4.1 的磷酸盐缓冲液(0.1 mol·L-1)与甲醇的混合溶液(99.9∶0.1),流速为1 mL·min-1,流动时间为10 min,每个样品进样量20 μL,柱温30 ℃,紫外检测器检测波长282 nm。
能荷(energy charge,EC)值的计算公式为:
1.4 数据处理
每个菌株的所有指标测定均重复3 次,取平均值。用Microsoft Excel 2010 软件对数据进行统计处理及作图,用SPSS 19.0 统计软件对数据进行单因素方差分析。
2 结果
2.1 甘露醇对草菇菌落形态和菌丝生长特性的影响
将PDA 培养基中的葡萄糖替换为同等质量的甘露醇进行草菇培养,在第3 天观察并拍摄菌落形态,结果如图1-A 所示。菌落直径的大小顺序依次为:T6>T0>T12>T19,T12、T19 的气生菌丝密度较T0、T6 稀疏。甘露醇处理后,T12、T19 的菌落直径和气生菌丝密度均明显大于对照组。

图1 草菇菌落形态(A)、菌丝生长速度(B)和菌丝生物量(C)的变化Fig.1 Changes of colony diameter (A), mycelium growth rate (B) and mycelium biomass (C) of Volvariella volvacea
随着继代次数的增加,菌丝生长速度和菌丝生物量均呈现先增加后降低的变化趋势(图1-B、C)。甘露醇处理后,T12、T19 的菌丝生长速度较对照组分别提高31.46%、20.99%;菌丝生物量较对照组分别提高97.33%、76.36%。甘露醇对继代菌株T12、T19 的菌丝性状均有显著增加(P<0.05)。T0、T6 的菌丝生长速度和菌丝生物量较对照组虽有一定提高,但差异不显著(P>0.05)。
2.2 甘露醇对草菇子实体农艺学性状的影响
对T0、T6、T12、T19 进行统一栽培,记录其生产特性。由图2-A 可知,T0、T6、T12 均能产生子实体,而T19 无法出菇;且T12 的子实体数量较T0、T6 减少,产量明显下降。经甘露醇处理后,T0、T6、T12 的子实体数目均多于对照组,T12 的增长最明显,并使无法出菇的T19 菌株恢复了出菇能力。

图2 草菇栽培性状(A)、原基形成时间(B)、平均单菇重(C)、生产周期(D)和生物学效率(E)的变化Fig.2 Changes in production trait (A), time of primordium formation (B), average weight of a fruiting body (C), production cycle(D) and biological efficiency (E) of V.volvacea
由图2 可知,随着继代次数的增加,草菇继代菌株的原基形成时间和生产周期逐渐增加,平均单菇重和生物学效率均呈现先升高后下降的趋势。甘露醇处理后,T0、T6 的各指标变化不显著;T12、T19 的原基形成时间分别比对照组缩短12.36%和14.29%(图2-B);T12 的平均单菇重、生物学效率分别比对照组显著提高28.57%、17.97%(图2-C、E),生产周期显著减少12.24%(P<0.05)(图2-D)。甘露醇处理后的T12 菌株生物学效率为20.29%,对照组T0 菌株的生物学效率为20.21%(图2-E)。说明经过甘露醇处理后,T12 菌株的产量可以恢复至原种T0 的水平;而且甘露醇使不能出菇的T19 重新长出子实体,其生产周期和生物学效率分别为14.80 d 和6.08%。
2.3 甘露醇对草菇细胞核数量的影响
随着组织分离继代次数的增加,草菇的细胞核数量整体呈逐渐减少的趋势。T0、T6 菌株的细胞核数目最多,T19 的细胞核数量最少。甘露醇处理后,T0、T6 的细胞核数量较对照组没有明显的变化,T12、T19的细胞核数量比对照组均有明显增多(图3)。

图3 草菇细胞核数量变化Fig.3 Changes of the nuclei number in V.volvacea
2.4 甘露醇对草菇抗氧化酶基因相对表达量的影响
在草菇基因组数据库中,发现草菇基因组含有3个sod(Cu/Zn-sod、Mn-sod1、Mn-sod2)、2 个cat(cat1、cat2)、1 个gr和1 个gpx,对7 个抗氧化酶相关基因进行RT-qPCR 分析,结果如图4 所示。随着继代次数的增加,Mn-sod1的相对表达量变化不明显,cat2的相对表达量逐渐降低,Cu/Zn-sod、Mn-sod2、cat1、gpx和gr的相对表达量则呈现出先升高后降低的趋势。甘露醇处理后,Cu/Zn-sod、Mn-sod2和gpx相对表达量在T0、T6 菌株中变化不显著,在T12、T19 菌株中均有显著提高(P<0.05)。在T12、T19菌株中,Cu/Zn-sod的表达量分别比对照组提高24.64%和61.54%,Mn-sod2分别比对照组提高19.76%和267.09%,gpx分别比对照组提高25.67%和55.82%;Mn-sod1、cat1、cat2和gr的相对表达量与对照组相比变化不显著(P>0.05)。

图4 草菇抗氧化酶基因的相对表达量变化Fig.4 Relative expression level changes of antioxidase genes in V.volvacea
2.5 甘露醇对草菇抗氧化酶活力的影响
随着草菇菌株继代次数的增加,SOD、CAT 和GR 的活力均呈下降趋势,GPX 则呈先上升后下降的趋势(图5)。甘露醇处理后,SOD 和GPX 的酶活力在T0、T6 菌株中变化不显著,在T12、T19 菌株中均显著提高(P<0.05);T12、T19 菌株的SOD 酶活力分别提高10.79%、72.32%(图5-A),GPX 分别提高16.98%和103.85%(图5-C);而CAT 和GR 酶活力与对照组相比变化不显著(P>0.05)。甘露醇对草菇抗氧化酶活力的影响结果与抗氧化酶基因相对表达量变化趋势基本一致。

图5 草菇SOD(A)、CAT(B)、GPX(C)和 GR(D)活力的变化Fig.5 Changes of SOD (A), CAT (B), GPX (C) and GR (D) in V.volvacea
2.6 甘露醇对草菇ROS 含量的影响
通过NBT 染色试验测定草菇的ROS 含量,颜色越深说明菌丝内ROS 含量越高。由图6-A 可知,相同的染色时间内,T0 和T6 菌株的菌丝颜色较浅,T12 菌株的颜色呈现深蓝色,而T19 菌株的菌丝颜色呈现靛青色。经甘露醇处理后,T0 的菌丝颜色没有明显变化,T6、T12 和T19 的菌丝颜色较对照组均明显变浅。

图6 草菇菌丝的NBT 染色(A)及含量(B)、H2O2含量(C)的变化Fig.6 Changes of NBT staining (A),content (B) and H2O2 content (C) in V.volvacea mycelium
2.7 甘露醇对草菇线粒体膜电位的影响
对草菇进行线粒体膜电位依赖性荧光染料探针染色,对照组的T0、T6 菌株均能呈现明亮的红色荧光,而T12 菌株的红色荧光明显变弱,T19 菌丝则观察不到红色荧光。与对照组相比,甘露醇处理后的T0、T6菌株荧光强度没有明显变化;而T12、T19 菌株的荧光强度均有增强,特别是T12 的荧光强度增加最明显(图7),表明甘露醇可以有效提高T12、T19 菌株的线粒体膜电位。

图7 草菇菌丝线粒体膜电位变化Fig.7 Changes of mitochondrial membrane potential in V.volvacea mycelium
2.8 甘露醇对草菇菌丝能量的影响
草菇菌丝体内的能量变化可以一定程度上反映线粒体的活力。由图8 可知,随着草菇菌株继代次数的增加,ATP 含量和EC 值呈现先升高后降低的趋势,ADP 和AMP 含量则呈现无规律变化。相较于对照组,甘露醇处理后的草菇ATP 含量和EC 值均有不同程度的提高;ATP 含量在T0、T6、T12 和T19 菌株中分别增加3.40%、7.52%、17.08%和14.55%(图8-C);EC 值则分别增加0.73%、1.21%、4.52%和0.92%(图8-D)。甘露醇显著提高了T12、T19 菌株的ATP 含量和EC值(P<0.05)。
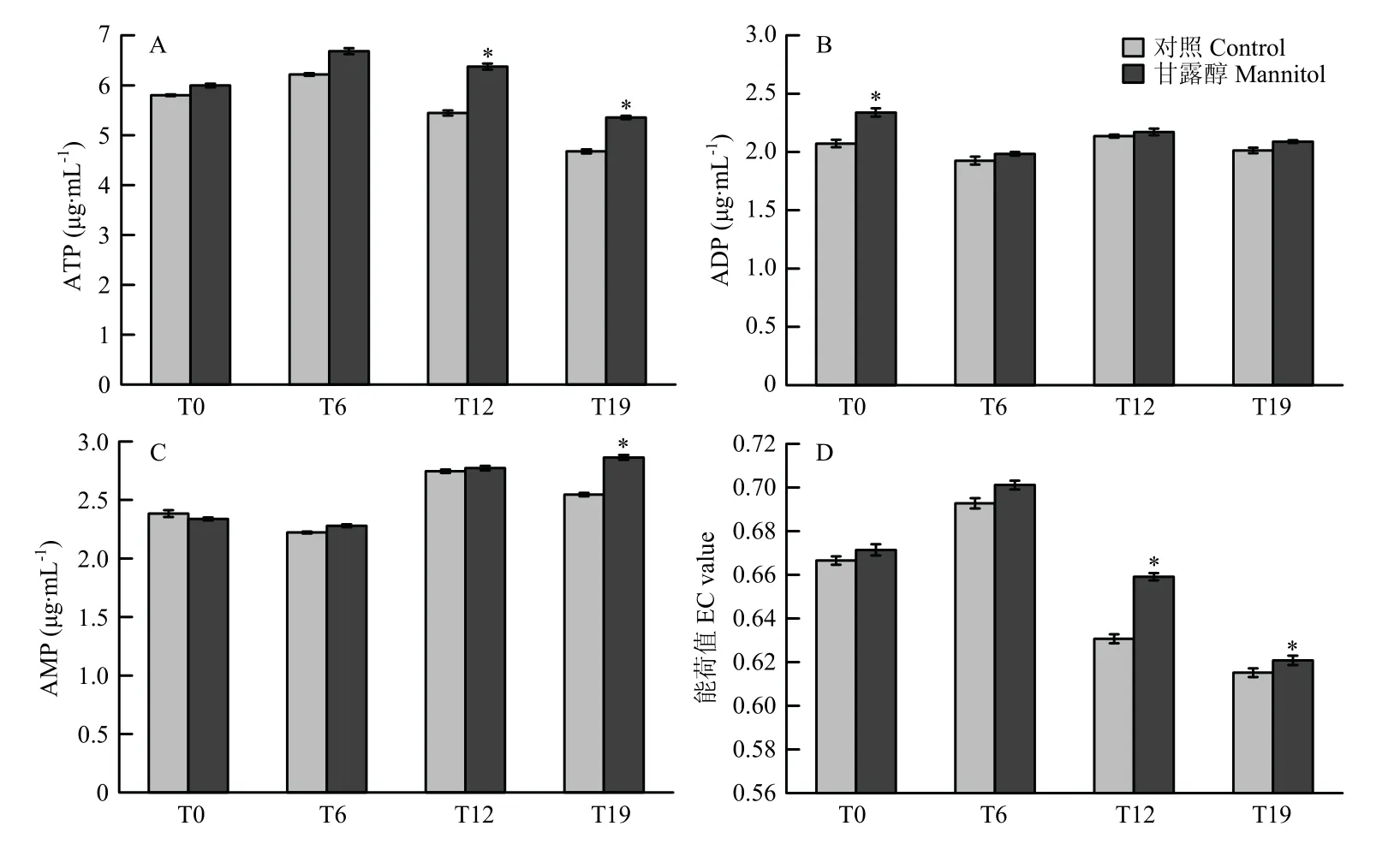
图8 草菇菌丝ATP 含量(A)、ADP 含量(B)、AMP 含量(C)和能荷值(D)的变化Fig.8 Changes of ATP content (A), ADP content (B), AMP content (C) and energy charges value (D) of V.volvacea mycelium
3 讨论
3.1 甘露醇提高了草菇继代菌株的生产性状
食用菌优良菌种选育是一项费时费力的工作,育种人员花费巨大的精力和物力选育出的优良品种,应用于生产1—2 年后,甚至是传种几代后就可能发生菌种退化。退化菌种的生产能力降低,优良性状变弱或丧失,给食用菌产业造成了巨大的经济损失[27]。在培养基中添加外源营养物质或更改培养基配方,均可以刺激菌丝生长、增加子实体产量,是退化菌种复壮的重要手段[28]。姜慧等[29]研究表明,外源添加矿质元素可以显著提高大球盖菇的生长活性并延缓其退化进程。牛宇等[30]发现白灵菇以麦芽糖、甘露醇、蔗糖为碳源比以葡萄糖为碳源时的菌丝生长更快。孔梓璇等[31]发现,在培养基中添加丝氨酸可以显著恢复草菇退化菌种的菌丝性状。本研究发现,甘露醇处理对T0、T6 菌株的生产性状影响不显著,但可使产量明显下降的T12 菌株生物学效率恢复至原种的水平;还能使丧失出菇能力的T19 菌株重新长出子实体,但产量未恢复至原种水平。需要说明的是,由于本研究中的草菇栽培试验是在实验室中以筐载模式进行,草菇的生物学效率略低于实际生产的床栽模式。
3.2 甘露醇增加了草菇继代菌株的抗氧化酶活力及相关基因表达量
虽然很久以来,真菌退化现象已经被发现,但对于菌种退化的原因还知之甚少。WANG 等[32]在对绿僵菌的退化研究时,首次提出丝状真菌的退化可能是老化的表征,这种老化是由于退化菌株内部积累的过量ROS 对细胞的氧化损伤造成[33],这与本研究结果一致。另外,本研究发现,随着继代次数的增加,草菇体内的抗氧化酶活力下降,ROS 含量逐渐增加。甘露醇是一种六碳多元醇,在细菌、真菌和许多植物中被用作碳源储能物质,还可以作为ROS 清除剂提高抗逆性[34]。PATEL 等[14]研究发现当真菌病原体侵染植物时,植物会产生大量ROS 来抵抗,而真菌会分泌甘露醇作为ROS 清除剂。MOHAMED 等[35]发现甘露醇处理可以消除绿豆中H2O2诱导的氧化损伤,使绿豆幼苗生长的生理属性得到改善。XIONG 等[4]通过提高蛹虫草退化菌株的抗氧化能力,成功恢复了退化菌株的出菇能力。本研究结果也表明,甘露醇可以提高退化菌株T12、T19 的Cu/Zn-sod、Mn-sod2和gpx表达量,增加SOD、GPX活力,降低ROS 积累,并提高退化菌株的生产性状。
3.3 甘露醇促进草菇继代菌株的能量代谢
线粒体是细胞内ROS 产生的主要场所,但过量ROS 造成的氧化胁迫会损伤线粒体,从而导致更多的ROS 产生,使线粒体进一步受损,这种恶性循环正是“线粒体导致衰老”学说的理论依据[36]。线粒体膜电位能够反映线粒体结构的完整性,进一步影响线粒体的呼吸链电子传递、内外膜完整性、物质运输及线粒体形态[37]。HAGEN 等[38]研究发现老年大鼠干细胞线粒体膜电位的荧光强度明显低于年轻大鼠,线粒体膜电位随细胞的衰老而降低。LI 等[33]在绿僵菌退化菌株的菌丝细胞中发现线粒体膜电位显著下降。本研究发现,草菇退化菌株的线粒体膜电位降低,甘露醇处理可使退化菌株T12、T19 的线粒体膜电位增加。同时,线粒体作为细胞的“动力工厂”,通过氧化磷酸化作用进行能量转化,将有机物中储存的能量转化为细胞生命活动的直接能源ATP,为机体提供能量[39]。本研究发现通过改变培养基配方,以甘露醇替代PDA 培养基中的葡萄糖可使草菇退化菌株T12、T19 的ATP 含量和EC 值显著增加,可能是因为甘露醇作为ROS 清除剂,能够保护线粒体结构免遭ROS 的破坏,使线粒体能量代谢加快,从而产生更多的ATP。
3.4 甘露醇提高了草菇继代菌株的细胞核数目
草菇是初级同宗结合的真菌,萌发后不通过异核化就可以完成整个生活史。不同于高等植物,草菇能在同一细胞内进行有丝分裂和无丝分裂,细胞核分裂后不能立即形成隔膜将两个子细胞核分离,所以草菇的菌丝细胞为多核细胞[40]。细胞核是细胞的控制中枢,控制着细胞的代谢、生长及分化等功能,同时是遗传物质存储的主要部位。SHAHI 等[41]发现尖孢镰刀菌菌丝体细胞核的数量越多,菌丝的生长速度就越快。胡锋黎等[42]发现草菇退化菌株的细胞核数目明显少于正常菌株的细胞核数量,菌丝细胞核数目的减少可能与细胞衰老而引起的细胞凋亡等因素有关。张志光等[43]发现普通的草菇菌丝细胞约含15—30 个细胞核,而老化的菌丝细胞中细胞核数量很少,甚至出现无核细胞,这与本研究结果一致。另外,本研究发现,草菇继代菌株的细胞核数量随着退化程度增加而逐渐减少,甘露醇处理能使草菇退化菌株的细胞核数目明显增加,可能与甘露醇是一种抗氧化剂,能清除衰退细胞内多余的ROS 有关,具体机理还有待进一步研究。
3.5 甘露醇恢复草菇继代菌株生产性状的原因探讨
本研究初步推测甘露醇恢复草菇继代菌株生产性状的可能原因为:甘露醇作为一种ROS 清除剂,可使草菇清除ROS 的相关抗氧化酶基因如Cu/Zn-sod、Mn-sod2、gpx的表达量上调,增加了抗氧化酶如SOD、GPX 的活力;使草菇退化菌株T12、T19 的ROS 积累量如、H2O2含量显著降低,因ROS 积累而受损的细胞功能得以修复,有效提高了线粒体能量代谢和线粒体膜电位,增加了菌丝能量和细胞核数目;从而促进草菇菌丝生长,提高子实体产量,在一定程度上恢复了草菇退化菌株的生产能力(图9)。

图9 甘露醇复壮草菇退化菌株示意图Fig.9 Schematic representation of degenerating strain rejuvenated by mannitol
4 结论
甘露醇处理对草菇T0、T6 的影响不显著,但能有效恢复草菇退化菌株T12、T19 的菌丝性状;显著缩短T12 的生产周期,恢复其生物学效率至T0 水平;并使不能出菇的T19 重新长出子实体。同时,甘露醇可提高T12、T19 的SOD、GPX 活力,并上调其基因表达量,使T12、T19 中的ROS 积累量显著降低,细胞核数目增加;并提高了线粒体膜电位和菌丝体能量。研究结果可为草菇及其他食用菌的复壮和延缓菌种退化提供理论依据。
