维奈克拉联合阿扎胞苷治疗初诊不适合强化疗的急性髓系白血病患者的疗效观察
2024-01-17韦梦红夏海龙
韦梦红 夏海龙

[摘要] 目的 觀察VA方案(维奈克拉+阿扎胞苷)治疗初诊不适合强化疗的急性髓系白血病(acute myeloid leukemia,AML)患者的疗效及安全性。方法 回顾性分析2021年4月至2023年2月于安徽医科大学第一附属医院接受VA方案治疗的初治不适合强化疗的AML患者55例,评估该方案的治疗疗效及安全性。结果 AML患者中位治疗疗程3(1~10)个,第一疗程结束后完全缓解(complete response,CR)/完全缓解伴血液学未完全恢复(CR with incomplete blood count recovery,CRi)率为78.2%,微小残留(minimal residual,MRD)转阴率61.8%;CR/CRi率和MRD转阴率均随着疗程增加而逐渐增加,有IDH1/IDH2、NPM1、ASXL1突变及无TP53突变的患者对VA方案的治疗反应较好。中位随访时间9.1(1.2~24.0)个月,生存39例,死亡16例,中位总生存(overall survival,OS)时间17.4个月,CR/CRi患者的OS时间显著长于部分缓解或未缓解患者(P<0.001)。几乎所有患者都出现不同程度的贫血、血小板减少和白细胞减少;在非血液学不良事件方面,感染最为常见。结论 VA方案在初诊不适合强化疗的AML患者中获得较高的治疗反应率,部分缓解患者可快速获得MRD转阴。IDH1/IDH2、ASXL1、NPM1、TP53突变可能是影响患者疗效的预测因素。
[关键词] 维奈克拉;阿扎胞苷;急性髓系白血病;总生存;不良事件
[中图分类号] R733.7 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.01.018
Efficacy of venetoclax combined with azacitidine in the treatment of patients with newly diagnosed unfit acute myeloid leukemia
WEI Menghong, XIA Hailong
Department of Hematology, the First Affiliated Hospital of Anhui Medical University, Hefei 230000, Anhui, China
[Abstract] Objective To observe the efficacy and safety of VA regimen (venetoclax + azacitidine) in the treatment of patients with newly diagnosed unfit acute myeloid leukemia (AML). Methods From April 2021 to February 2023, 55 unfit AML patients who were treated with VA regimen in the First Affiliated Hospital of Anhui Medical University were retrospectively analysed. The therapeutic efficacy and safety of VA regimen were evaluated. Results The median treatment courses of AML patients was 3 (1-10), and complete response (CR)/ CR with incomplete blood count recovery (CRi) rate was 78.2% and minimal residual (MRD) negative conversion rate was 61.8% after the first treatment course. CR/CRi rate and MRD negative conversion rate increased gradually with the increase of treatment course. Patients with IDH1/IDH2, NPM1, ASXL1 mutations and without TP53 mutations responded well to the VA regimen. The median follow-up time was 9.1 (1.2-24.0) months. 39 patients survived and 16 patients died. The median overall survival (OS) was 17.4 months. Patients with CR/CRi had significantly longer OS duration than patients with partial response or non-response (P<0.001). Almost all patients had different degrees of anemia, thrombocytopenia, leukopenia. In terms of non-hematological adverse events, infection was the most common. Conclusion The VA regimen achieved a higher treatment response rate in newly diagnosed unfit AML patients, and partial response patients could quickly obtain negative MRD. IDH1/IDH2, ASXL1, NPM1, TP53 mutations may be the predictors of patient outcomes.
[Key words] Venetoclax; Azacitidine; Acute myeloid leukemia; Overall survival; Adverse events
急性髓系白血病(acute myeloid leukemia,AML)是一种源于髓系造血干/祖细胞恶变的恶性克隆性疾病,常导致无效造血,从而发生血细胞减少危及生命[1]。AML患者使用常规化疗方案治疗的长期生存率低,高龄、高危及复发难治的患者预后较差。近年来,国际上已有多项临床试验证实维奈克拉联合去甲基化药物在AML患者中可获得较高的治疗应答和无病生存率[2-4]。本研究分析使用VA方案(维奈克拉+阿扎胞苷)治疗的55例初诊不适合强化疗的AML(unfit-AML)患者的疗效及安全性,为临床治疗AML提供依据。
1 资料与方法
1.1 一般资料
选取2021年4月至2023年2月于安徽医科大学第一附属医院诊治的初诊unfit-AML患者55例。纳入标准:①AML的诊断符合WHO标准[5];②接受VA方案治疗并完成1个以上疗程;③年龄≥75岁,或18~74岁且至少符合以下条件之一:美国东部肿瘤协作组体能状况评分2~4分;严重的心、肺、肝、肾功能不全或合并重症感染;存在任何医生判断不适合接受强化疗的合并症[6-7];④临床资料完整者。排除标准:①同时伴有其他恶性肿瘤需化疗者;②急性早幼粒细胞白血病者;③合并精神疾病、认知障碍或无法正常沟通者。本研究经安徽医科大学第一附属医院伦理委员会批准(伦理审批号:PJ2023-11-19),所有患者均签署知情同意书。
1.2 治疗方案
采用VA方案。口服维奈克拉(注册证号:国药准字HJ20200055,生产单位:AbbVie Ireland NL B.V.,规格:100mg),第1~3天依次给予100mg、200mg、400mg,1次/d,第4~28天维持剂量400mg,28d为1个疗程,治疗中依据患者的耐受情况调整剂量;阿扎胞苷(注册证号:国药准字HJ20170238,生产单位:Baxter Oncology GmbH,规格:100mg)75mg/(m2·d)连续皮下注射,7d为1个疗程,依据患者情况进行一定调整,同时给予碱化/水化等治疗;其后所有疗程,阿扎胞苷给药方法同前,维奈克拉400mg,1次/d,疗程28d。当联用伏立康唑时,调整维奈克拉剂量为100mg或200mg,1次/d。部分合并FLT3突变的患者联合使用FLT3抑制剂。
1.3 疗效及安全性评估
完全缓解(complete response,CR)定义为骨髓原始细胞比例<5%,临床无白血病浸润症状和体征,脱离输血,中性粒细胞计数>1.0×109/L,血小板计数>100×109/L;除中性粒细胞减少或血小板减少外符合CR标准定义为完全缓解伴血液学未完全恢复(CR with incomplete blood count recovery,CRi);部分缓解(partial response,PR)定义为骨髓原始细胞比例5%~20%,同时骨髓原始细胞较治疗前降低50%以上;未缓解(non-response,NR)定义为治疗后未达到CR或PR标准[8]。客观缓解率(objective remission rate,ORR)=(CR+CRi+PR)/总例数×100%。使用流式细胞术检测微小残留(minimal residual,MRD),MRD水平<0.1%定义为阴性[9]。总生存(overall survival,OS)时间是指患者从诊断到死亡或到末次随访的时间。不良事件评估标准参照美国国家癌症研究所(National Cancer Institute,NCI)4.0版不良事件进行分级。
1.4 统计学方法
采用SPSS 27.0软件进行数据统计分析。符合正态分布的计量资料以均数![]() 標准差(
標准差(![]() )表示,比较采用t检验;计数资料以例数(百分率)[n(%)]表示,比较采用χ2检验或Fisher确切概率法;使用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
)表示,比较采用t检验;计数资料以例数(百分率)[n(%)]表示,比较采用χ2检验或Fisher确切概率法;使用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
共纳入55例患者,男32例,女23例;中位年龄66(46~88)岁;FAB分型:M1型6例,M2型15例,M4型6例,M5型28例;原发性AML 47例,继发性AML 8例;ELN预后分层低中危21例,高危34例;NPM1突变13例,IDH1/IDH2突变14例,FLT3-ITD/TKD突变18例,TP53突变12例,RUNX1突变9例,ASXL1突变12例,RAS突变14例,DNMT3A突变10例,TET2突变12例,CEBPA突变9例;不适合强化疗的原因:年龄≥75岁14例,合并活动性感染26例,合并脏器功能不全15例。其中22例因联用伏立康唑而调整维奈克拉剂量为100~200mg,另有12例患者合并FLT3突变联合使用索拉非尼或吉瑞替尼。中位治疗疗程3(1~10)个。
2.2 疗效评估及影响患者疗效的单因素分析
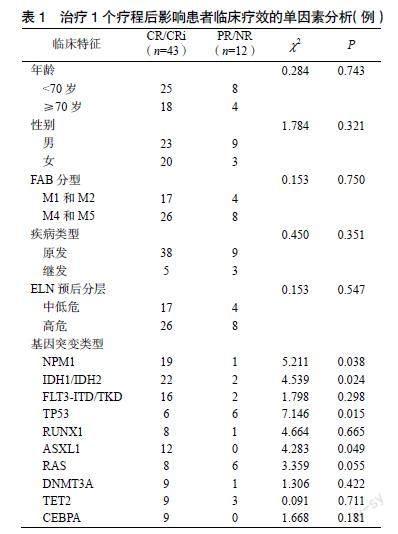
55例患者经1个疗程VA方案治疗后,43例(78.2%)患者达CR/CRi,3例(5.4%)达PR,ORR为83.6%,34例(61.8%)患者实现MRD转阴。47例患者接受第2疗程治疗,CR/CRi 37例(78.7%)。第1疗程达CR/CRi而MRD未转阴的9例患者,其中4例在2个疗程后MRD转阴。与PR/NR患者相比,CR/CRi患者在年龄、性别、白血病类型、原发/继发AML、ELN危险分层等方面差异均无统计学意义(P>0.05)。CR/CRi患者IDH1/IDH2、ASXL1、NPM1基因突變占比均显著高于PR/NR患者,TP53基因突变占比显著低于PR/NR患者(P<0.05),见表1。
2.3 复发与生存
截至2023年3月,中位随访时间9.1(1.2~24.0)个月。其中生存39例,死亡16例,死亡原因包括感染(3例)、原发病进展或复发(13例)。中位OS时间17.4个月,见图1;CR/CRi患者的OS时间显著长于PR/NR患者(P<0.001),见图2。
2.4 安全性评估
在血液学不良事件方面,几乎所有患者都出现不同程度的贫血、血小板减少和白细胞减少。≥3级的白细胞减少发生率83.6%(46/55),治疗所致者为49.1%(27/55);≥3级的中性粒细胞减少发生率81.8%(45/55),治疗所致者为21.8%(12/55);≥3级的血小板减少发生率72.7%(40/55),治疗所致者为9.1%(5/55);≥3级的贫血发生率85.5%(47/55),治疗所致者为16.4%(9/55);52.7%(29/55)的患者出现中性粒细胞减少伴发热。
在非血液学不良事件方面,感染最为常见,60%的患者出现感染,其中肺部感染29例,软组织感染4例;电解质紊乱9例,轻度肝/肾功能损伤12例;恶心14例,呕吐8例,腹泻5例,便秘11例;5例患者发生出血性事件,消化道出血3例,脑出血1例,鼻出血1例;1例患者发生心室血栓;2例患者发生败血症。所有患者均未发生肿瘤溶解综合征。
3 讨论
unfit-AML是AML治疗的难点之一。但随着靶向药物的不断研发应用,其治疗方案得到优化。
B细胞淋巴瘤2(B cell lymphoma 2,Bcl-2)蛋白是一类线粒体凋亡途径依赖的抗凋亡蛋白,可通过阻断促凋亡蛋白表达,使AML细胞逃避细胞凋亡。研究表明,Bcl-2抑制剂可抑制AML细胞的增殖[10]。既往对老年初治AML患者,指南推荐使用减少剂量的化疗方案或去甲基化进行治疗,但该方案有效率低,预后较差[11]。国内外指南推荐维奈克拉联合治疗为老年初诊unfit-AML的一线治疗。
本研究采用VA方案治疗unfit-AML患者,1个疗程后CR/CRi率达78.2%,MRD阴性率达61.8%;疗效明显优于传统化疗。此外,本研究分析不同遗传学特征患者对VA方案的治疗应答,结果发现IDH、ASXL1、NPM1突变为初诊AML患者高应答率的预测因子,这与国外研究报道一致[12-15]。TP53突变一直以来被认为与不良预后相关,它可预测AML患者的低CR率,高复发率[16-17]。在本研究中,合并TP53突变患者的CR/CRi率为50.0%,这与Aldoss等[18]报道一致。达到CR/CRi的6例患者中,3例在短期内复发,考虑与维奈克拉耐药有关,但目前其耐药机制暂不明确,还需进一步研究以改善VA方案的治疗效果。研究报道维奈克拉联合FLT3抑制剂具有协同抗AML作用,在合并FLT3突变的AML患者中有较好的治疗前景[19]。本研究提示可将VA方案联合FLT3抑制剂作为该亚型患者的长期维持治疗方案,但仍需更多研究证明其相关性。而有无RUNX1、DNMT3A、TET2、CEBPA、RAS突变在本研究中未能观察到有益结果,可能与样本量较小有关。VA方案使用中非血液学不良事件以肺部感染最为常见,几乎所有患者均发生血液学不良事件,及时给予对症支持治疗可有效预防病情进一步加重。这与既往研究报道的安全性特征一致。
综上,VA方案可提高老年初治unfit-AML患者的治疗效果,明显改善患者预后,延长其生存期,且安全性良好。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] NAZHA A, KANTARJIAN H, RAVANDI F, et al. Clofarabine, idarubicin, and cytarabine (CIA) as frontline therapy for patients ≤60 years with newly diagnosed acute myeloid leukemia[J]. Am J Hematol, 2013, 88(11): 961–966.
[2] DINARDO C D, PRATZ K W, LETAI A, et al. Safety and preliminary efficacy of venetoclax with decitabine or azacitidine in elderly patients with previously untreated acute myeloid leukaemia: A non-randomised, open-label, phase 1b study[J]. Lancet Oncol, 2018, 19(2): 216–228.
[3] WEI A H, MONTESINOS P, IVANOV V, et al. Venetoclax plus LDAC for newly diagnosed AML ineligible for intensive chemotherapy: A phase 3 randomized placebo-controlled trial[J]. Blood, 2020, 135(24): 2137–2145.
[4] GERSHON A, MA E, XU T, et al. Early real-world first-line treatment with venetoclax plus HMAs versus HMA monotherapy among patients with AML in a predominately US community setting[J]. Clin Lymphoma Myeloma Leuk, 2023, 23(5): e222–e231.
[5] ARBER D A, ORAZI A, HASSERJIAN R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127(20): 2391–2405.
[6] SENAPATI J, DHAWAN R, AGGARWAL M, et al. Venetoclax and azacitidine (VenAZA) combination therapy in young unfit patients with AML: A perspective from a developing country[J]. Leuk Lymphoma, 2021, 62(6): 1514–1517.
[7] DINARDO C D, PRATZ K, PULLARKAT V, et al. Venetoclax combined with decitabine or azacitidine in treatment-naive, elderly patients with acute myeloid leukemia[J]. Blood, 2019, 133(1): 7–17.
[8] DÖHNER H, WEI A H, APPELBAUM F R, et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN[J]. Blood, 2022, 140(12): 1345–1377.
[9] XU J, JORGENSEN J L, WANG S A. How do we use multicolor flow cytometry to detect minimal residual disease in acute myeloid leukemia?[J]. Clin Lab Med, 2017, 37(4): 787–802.
[10] LEVER J R, FERGASON-CANTRELL E A. Allosteric modulation of sigma receptors by BH3 mimetics ABT-737, ABT-263 (Navitoclax) and ABT-199 (Venetoclax)[J]. Pharmacol Res, 2019, 142: 87–100.
[11] DOMBRET H, SEYMOUR J F, BUTRYM A, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts[J]. Blood, 2015, 126(3): 291–299.
[12] MORSIA E, MCCULLOUGH K, JOSHI M, et al. Venetoclax and hypomethylating agents in acute myeloid leukemia: Mayo clinic series on 86 patients[J]. Am J Hematol, 2020, 95(12): 1511–1521.
[13] CHERRY E M, ABBOTT ;D, AMAYA M, et al. Venetoclax and azacitidine compared with induction chemotherapy for newly diagnosed patients with acute myeloid leukemia[J]. Blood Adv, 2021, 5(24): 5565–5573.
[14] LACHOWIEZ C A, LOGHAVI S, KADIA T M, et al. Outcomes of older patients with NPM1-mutated AML: Current treatments and the promise of venetoclax-based regimens[J]. Blood Adv, 2020, 4(7): 1311–1320.
[15] ALDOSS I, YANG D, PILLAI R, et al. Association of leukemia genetics with response to venetoclax and hypomethylating agents in relapsed/refractory acute myeloid leukemia[J]. Am J Hematol, 2019, 94(10): E253–E255.
[16] RÜCKER F G, SCHLENK R F, BULLINGER L, et al. TP53 alterations in acute myeloid leukemia with complex karyotype correlate with specific copy number alterations, monosomal karyotype, and dismal outcome[J]. Blood, 2012, 119(9): 2114–2121.
[17] HOU H A, TIEN H F. Genomic landscape in acute myeloid leukemia and its implications in risk classification and targeted therapies[J]. J Biomed Sci, 2020, 27(1): 81.
[18] ALDOSS I, ZHANG J, PILLAI R, et al. Venetoclax and hypomethylating agents in TP53-mutated acute myeloid leukaemia[J]. Br J Haematol, 2019, 187(2): e45–e48.
[19] BYSTROM R, LEVIS M J. An update on FLT3 in acute myeloid leukemia: Pathophysiology and therapeutic landscape[J]. Curr Oncol Rep, 2023, 25(4): 369–378.
(收稿日期:2023–08–06)
(修回日期:2023–11–25)
