lnc-ob1通过促进白色脂肪棕色化改善肥胖小鼠胰岛素抵抗
2024-01-13郑鸿宇李雪杨甘麦邻沈林園
吴 霜,郑鸿宇,李雪杨,甘麦邻,沈林園,朱 砺*
(1.四川农业大学动物科技学院,四川省畜禽遗传资源发掘与创新利用重点实验室,成都 611130;2.四川农业大学动物科技学院,农业农村部畜禽生物组学重点实验室,成都 611130)
肥胖造成脂肪组织异位沉积,脂肪组织功能失调伴随了游离脂肪酸、炎症物质、ROS的分泌,会促使全身低度炎症[1]。过量的脂质在不同器官中沉积,产生脂毒性扰乱细胞器正常功能,发生线粒体、溶酶体、内质网功能失调,进一步加剧炎症物质和ROS 的释放,进而扰乱胰岛素的信号传导途径[2]。此外,脂质过度沉积会干扰葡萄糖平衡,推动了胰岛素抵抗的进程[3]。
长链非编码RNA(lncRNA)是长度通常大于200 个碱基没有特定蛋白编码能力的核苷酸序列。随着对非编码RNA 探究的深入,逐渐揭示了lncRNA 参与转录调控、表观遗传修饰、蛋白质翻译后修饰以及稳定性等广泛的生物调节[4]。在脂肪的发育调控中,长链非编码RNA(lncRNA)发挥着关键的作用,其调控机制在脂肪分化、代谢和功能方面有显著意义。研究指出lncOb家族参与瘦素调节基因的定性和定量表达[5],lnc-BATE1的反式作用是BAT 发育和维持产热功能的必需lncRNA[6],lnc uc.417则会通过抑制p38/MAPK 通路的磷酸化阻碍UCP1的激活负向调节棕色脂肪产热[7]。
ENSMUSG00000092381 在成骨细胞中高度富集,在小鼠组织中被命名为lnc-ob1(lncRNA osteoblastogenesis associated 1),特异性敲入lnc-ob1能够上调成骨转录因子Osterix,促进成骨细胞钙化[8]。
本课题组前期研究发现,在肥胖小鼠模型的不同类型脂肪组织中观察到lnc-ob1的差异表达,这提示lnc-ob1可能在脂肪细胞的分化以及功能履行中发挥特定调控作用。为了进一步探究这种可能性,本试验采用生物信息学结合活体注射的方式,初步探究了lnc-ob1对脂肪组织棕色化的调控作用。
1 材料和方法
1.1 数据PC库及软件
NCBI数据库(https://www.ncbi.nlm.nih.gov)中下载lncRNA-seq 转录组数据;ensembl 数据库(http://asia.ensembl.org/index.html)中获取lnc-ob1序列信息;UCSC 数据库(https://genome.ucsc.edu)分析lncob1的保守性;RNAfold 网站(http://rna.tbi.univie.ac.at//cgi-bin/RNAWebSuite/RNAfold.cgi)预测lncRNA二级结构;CPC(http://cpc2.gao-lab.org/)编码潜能预测;image J软件统计脂肪细胞面积。
1.2 试验材料
1.2.1 实验动物
雄性6 周龄C57BL/6J 小鼠购于成都达硕实验动物有限公司。试验获四川农业大学动物科技学院实验动物护理和使用委员会批准。
1.2.2 试验试剂
牛胰岛素购置于北京索莱宝科技有限公司;TRlzol RNA抽提试剂购置于Invitrogen公司(美国);Hiscript Ⅲ RT SuperMix for qPCR购置于Vazyme公司;TB GreebTMPremix Ex TapTMⅡ购置于Takara公司;甘油三酯(TG)、总胆固醇(T-CHO)和高密度脂蛋白胆固醇(HDL-C)测试盒均购置于南京建成生物工程研究所;BCA 蛋白浓度测定试剂盒、ECL 显色液购置于上海碧云天公司;Anti-UCP1(ab209483)抗体购置于abcam,β-actin(200068-6D7)购置于成都正能生物技术公司,Goat anti-rabbit IgG(AS070)购置于ABclonal生物公司。
1.2.3 试验仪器设备
试验所用主要仪器设备见表1。
表1 试验主要仪器设备表Table 1 Main test instruments and equipment
1.3 试验方法
1.3.1 过表达载体构建与引物设计合成
lnc-ob1过表达pCDNA3.1(+)质粒购置于上海擎科生物有限公司。ENSMUSG00000092381 是位于小鼠第七号染色体(Chromosome 7:19 448 941~19 455 656)的反义lncRNA,转录本长度618 bp。对应人源lnc-ob1(ENSG00000267282)位于人19 号染色体(Chromosome 7:44 882 027~44 890 876),转录本长度426 bp,序列如表2。
lnc-ob1引物序列设计于Primer3Plus 在线网站(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)。脂肪棕色化、产热等相关基因参考序列信息从Genbank 中检索下载,用Primer 5.0软件设计9对引物(表3)。引物由擎科生物公司(成都)合成。

表3 引物序列Table 3 The primer sequences
1.3.2 实验动物分组及处理
健康C57Bl/6J 雄性6 周龄小鼠18 只,随机分为3 组:正常饮食对照组(normal diet,ND)、高脂饲喂组(high fat diet,HFD)、高脂饲喂+lnc-ob1过表达试验组(HFD+lnc-ob1),3 组小鼠均自由采食饮水,其中n=6。HFD 组通过高脂饲喂构建肥胖小鼠模型,饲喂4 周后超过对照组平均体质10%为构建成功。lnc-ob1过表达通过腹腔注射过表达载体实现,且ND组和HFD组注射等体积生理盐水。
饲喂4 周后进行组织样本采集,眼球取血法采取全血,室温静置2 h后3 000 rpm离心15 min,取上清置-80 ℃冰箱保存。采血后对小鼠进行断颈处死法,采取肝脏(liver)、腹股沟脂肪(inguinal white adipose tissue,iWAT)、肩胛棕色脂肪(brown adipose tissue,BAT)和性腺脂肪(gonadal white adipose tissue,gWAT)并称量,部分组织去除血污后利用4%多聚甲醛固定,用于制作H&E 染色切片;部分组织置于液氮速冻后迅速转移至-80 ℃冰箱保存,用于后续试验检测。
1.3.3 逆转录-实时荧光定量PCR(RT-qPCR)检测
组织样本用高速研磨仪破碎,用Trizol法提取组织mRNA,在ND-2000 分光光度计(NanoDrop)上检测mRNA完整性和浓度。使用Hiscript Ⅲ RT Super-Mix for qPCR 试剂盒将mRNA 逆转录为cDNA,随后用TB GreebTMPremix Ex TapTMⅡ进行RT-qPCR 检测,反应体系配比为:5 µL TB Green,3 µL DEPC水,上下游引物各0.5 µL和1 µL cDNA。CFX96荧光定量仪反应条件:95 ℃预变性5 min;95 ℃变性 10 s,60 ℃退火30 s,反应39 个循环,72 ℃延伸1 min。mRNA的内参基因为β-actin,基因表达量采用2-△△Ct法计算[9]。实时荧光定量PCR所用引物序列见表3。
1.3.4 Western blot
冻存的小鼠脂肪组织用研磨仪破碎,加入RIPA裂解液冰上裂解30 min,BAC 试剂盒(碧云天)检测蛋白浓度,变性后按照25 ug 蛋白量上样,15%SDS-PAGE 电泳,转膜、封闭后,孵育UCP1 一抗(1∶2 000)、β-actin一抗(1∶5 000) 4 ℃过夜,TBST震荡清洗后加入二抗,室温孵育2 h,TBST 震荡清洗3次,ECL显色法在凝胶影像分析仪成像。
1.3.5 GTT和ITT检测
腹腔注射葡萄糖耐量试验(GTT)操作如下:试验处理4周后,试验提前12 h对小鼠禁食,试验当天检测小鼠体重,按照2 g/kg 根据体重计算20%葡萄糖溶液注射量,在0、15、30、60、90、120 min 时间点用罗氏试纸血糖仪检测小鼠尾静脉血糖。
腹腔注射胰岛素耐量试验(ITT)操作如下:操作同GTT,根据小鼠体重将胰岛素(4 U/mL)按照0.75 U/kg剂量注射,在0、15、30、60、90 min 5个时间点检测小鼠尾静脉血糖。
1.3.6 苏木素-伊红(hematoxylin-eosin staining,HE)染色
小鼠部分组织用4%多聚甲醛固定,经脱水、石蜡包埋、切片,二甲苯浸泡后置于无水乙醇脱蜡,随后依次置于95%、85%、70%乙醇中水化样本。PBS清洗3次后,苏木素染色5~10 min,蒸馏水洗去多余染色液后用1%盐酸乙醇分化,细胞核反蓝后蒸馏水清洗5 min。伊红染液染色3 min,随后脱水封片,显微镜镜检,进行图像采集分析。
1.3.7 生化指标检测
血浆总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)经试剂盒检测含量。肝脏组织样本按照肝脏重量(g)∶体积(mL)=1∶9的比例加入无水乙醇,在冰浴下机械研磨为匀浆,2 500 r/min 离心10 min,取上清用于后续检测。TC检测操作:在96 孔酶标板上分别加2.5 µL 蒸馏水、标准品、待测样本,再分别加入250 µL工作液,37 ℃孵育10 min,酶标仪检测510 nm 波长处吸光度值。TG 检测操作同TC,检测波长为500 nm。HDL-L 检测操作:96 孔酶标板上分别加2.5 µL 蒸馏水、标准品、待测样本,再分别加入180 µL 工作液R1,37 ℃孵育5 min,酶标检测546 nm 波长吸光度A1,各孔添加60 µL 工作液R2,37 ℃孵育5 min,酶标检测546 nm波长吸光度A2,根据公式计算浓度。
1.3.8 数据处理与分析
试验数据采用GraphPad Prism 9.0 (GraphPad software,San Diego,CA,USA)分析,相关性分析采用D'Agostino-pearson 进行相关分析。试验结果采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 lnc-ob1 在肥胖小鼠脂肪组织中差异表达,进化上具有高度保守性
lnc-ob1(ENSMUSG00000092381)位于小鼠第七号染色体(Chromosome 7:19 448 941~19 455 656)的反义lncRNA(图1A-B)。随后鉴定了lnc-ob1在猪、人、鼠等多个物种中高度保守,进化上的序列保守为lnc-ob1的功能保守提供了基础条件(图1C-E)。且编码能力预测显示lnc-ob1不具备编码潜能(图1F)。此外,我们从NCBI 数据库下载了高脂诱导肥胖小鼠及其对照的LncRNA-seq 数据,差异表达分析鉴定出lnc-ob1在高脂诱导小鼠的肩胛脂肪中表达量异常下降,为了进一步确定lnc-ob1对脂肪发育的潜在影响,我们在高脂饲喂小鼠中腹腔注射裸质粒过表达lnc-ob1。通过RT-qPCR 检测不同脂肪组织(n=5)中lnc-ob1表达量变化,结果显示过表达组lnc-ob1表达量显著高于对照组和高脂饲喂组。在HFD诱导肥胖小鼠的腹股沟脂肪中lnc-ob1表达量显著降低,表明lnc-ob1表达与脂质代谢相关,同时证明腹腔注射质粒显著增加了lnc-ob1在脂肪组织中的表达(图1G)。

图1 lnc-ob1保守性分析以及不同脂肪组织中差异lncRNA分析Figure 1 Conservative analysis of lnc-ob1 and differential lncRNA analysis in different adipose tissues
2.2 lnc-ob1 过表达抑制小鼠肥胖症发展,缓解肥胖小鼠的胰岛素抵抗
初始体重趋于一致的小鼠,饲喂高脂日粮小鼠的体重从饲喂起第2 周呈现显著差异(图2A,P<0.05),高脂饲喂组葡萄糖耐量试验(GTT)曲线下面积(AUC)显著升高(图2B~C)且HFD组胰岛素耐量试验的AUC 也显著增加(图2D-E),说明高脂饲喂造成小鼠葡萄糖稳态的破坏和胰岛素敏感性降低,且该现象被lnc-ob1过表达挽救。
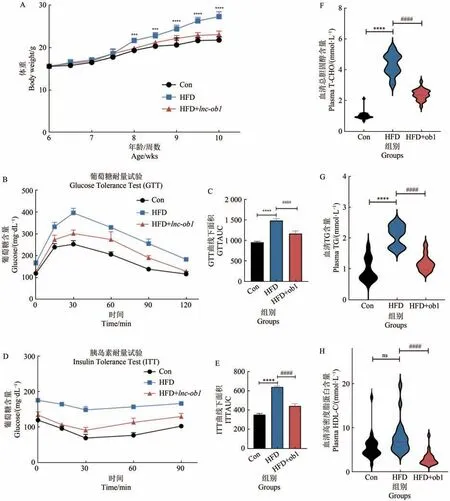
图2 过表达lnc-ob1高脂诱导肥胖小鼠以及对照组的体重以及血液指标检测Figure 2 Effects of lnc-ob1 overexpression on body weight and blood indexes
与对照组相比,HFD组在总甘油三酯(图2F)和总胆固醇(图2G)两项血液生化指标检测中都显著升高,lnc-ob1过表达组的TG、T-CHO 和HDL-C 与HFD组相比均显著下降(图2F~H)。
过表达lnc-ob1显著抑制了高脂饲喂导致的小鼠肝脏重量增加(图3A),改善了肥胖诱导的肝脏细胞间距增加的NAFLD样变化(图3D)。同时极显著地降低了肝脏总甘油三酯和胆固醇的含量(图3B-C)。以上结果证明,过表达lnc-ob1具有调节小鼠脂肪代谢、缓解肥胖小鼠胰岛素抵抗的功能。
2.3 lnc-ob1过表达降低肥胖小鼠的脂肪质量和脂肪细胞面积
HFD 小鼠肩胛脂肪和性腺脂肪相对于对照组增加(图4A),肩胛和性腺脂肪的器官指数显著增加(图4B~C)。lnc-ob1过表达显著降低了HFD诱导的性腺白色脂肪重量增加,同时抑制了性腺白色脂肪的脂肪面积增大,与HFD 相比lnc-ob1过表达的脂肪组织间毛细血管增加。

图4 lnc-ob1对小鼠肩胛和性腺脂肪组织的影响Figure 4 Effect of lnc-ob1 on the adipose tissue of interscapular and gonadal
HFD 处理组的腹股沟白色脂肪(iWAT)的脂肪细胞面积和重量显著高于对照组(图5A~D),表现出了更严重的脂肪堆积。lnc-ob1的过表达显著抑制了iWAT 的脂肪面积增加(图5B~D),HE 染色表现出更明显的脂肪棕色样变化的血管分布(图5A)。且Pearson相关性分析(Pearsonr=0.912 2)显示lnc-ob1表达量与腹股沟脂肪细胞面积呈现强相关(图5E)。
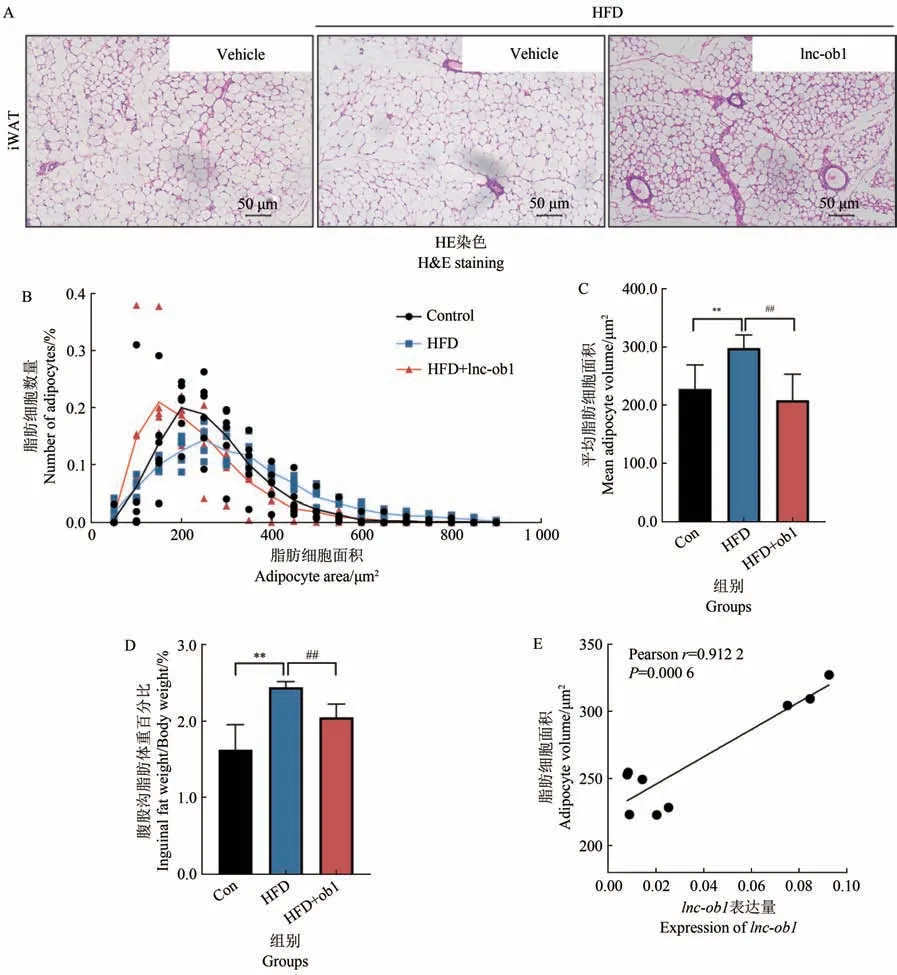
图5 lnc-ob1对小鼠腹股沟脂肪组织的影响Figure 5 Effect of lnc-ob1 on the inguinal fat in mice
2.4 lnc-ob1 通过促进白色脂肪棕色化缓解脂质聚集
在过表达lnc-ob1的腹股沟脂肪中检测到,白色脂肪棕色化传统调控通路的UCP1基因表达和蛋白活性加强(图6A~B)。q-PCR 结果显示,与高脂饮食(HFD)组相比,过表达组脂肪细胞产热相关基因表达量增加,包括解偶联蛋白1(UCP1)、PR 结构域蛋白16(PRDM16)、过氧化物酶体增殖物激活受体γ 辅助激活因子-1α(PGC-1α)。同时,线粒体β 氧化调控基因过氧化物酶体增值无激活受体-α(PPAR-α)、过氧化物酶体增值物激活受体-γ(PPAR-γ)以及上游调控因子LPIN1和HSL表达量呈现相同趋势,差异具有统计学意义。
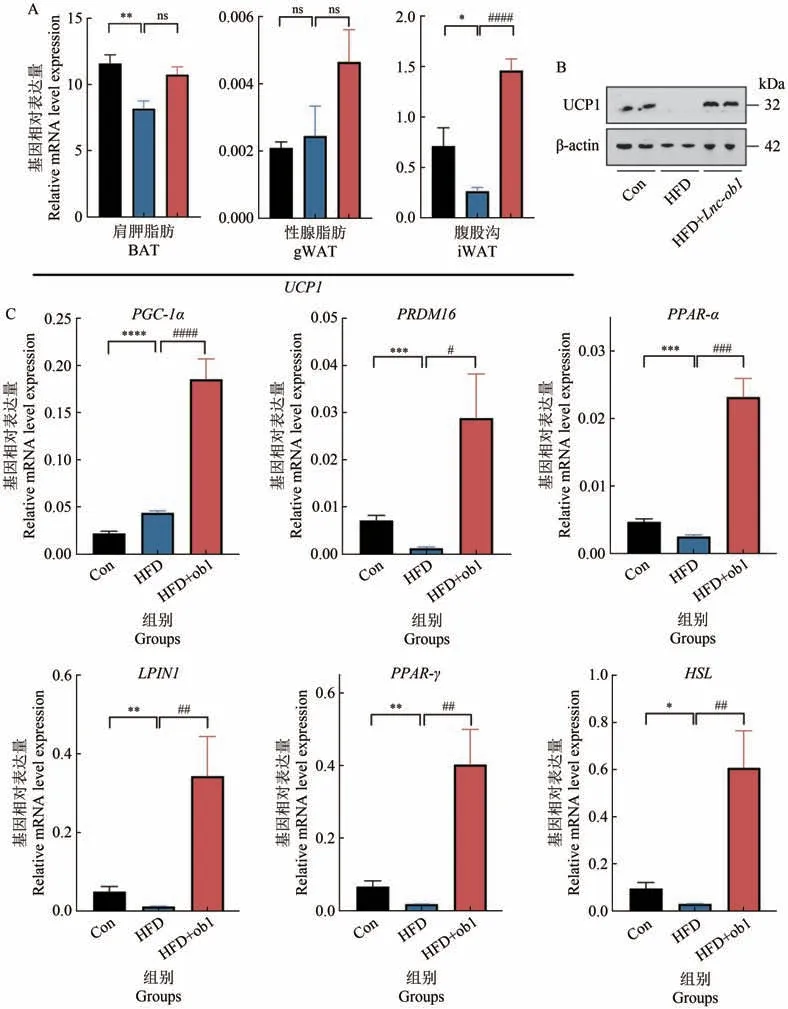
图6 lnc-ob1调控小鼠脂肪代谢和棕色化基因表达变化Figure 6 lnc-ob1 regulates lipid metabolism and browning gene expression in mice
3 讨论与结论
动物能量摄取超过能量消耗量时,多余的能量会以脂质的形式储存在脂肪细胞和其他代谢组织中,长期慢性能量摄入过剩则可能导致肥胖并诱发2型糖尿病[10]。棕色脂肪组织(BAT)通过UCP1解偶联呼吸链与ATP合成,甘油三酯储存的能量在氧化后以热量的形式耗散从而产热[11]。多项研究指出,在特定刺激下,如冷刺激、低氧、肾上腺素能激动剂,WAT内的部分脂肪细胞发生棕色样的变化行使BAT的功能,被称为第三类脂肪组织“米色脂肪”[12-13]。
lnc-ob1功能保守,在多个物种(小鼠、猪、人)中基因组位置、全长已知。从超级保守区(UCR)转录的RNA(T-UCR),拥有较高的进化保守性,在不同哺乳动物的进化中都得到了保留,暗示了其在疾病或生理功能中的重要调控作用[14]。
C57Bl/6J 小鼠品系在高脂饮食饲喂条件下,容易出现胰岛素抵抗、肝脏脂肪变性的变化。肥胖带来胰岛素和葡萄糖代谢紊乱,lnc-ob1外源性过表达抑制了高脂日粮饲喂的小鼠的体重增长,降低了小鼠的空腹血糖水平,增加了小鼠的胰岛素敏感性,缓解了高脂饲喂诱发的肥胖和胰岛素抵抗。葡萄糖经由肝脏代谢转化为甘油三酯和脂肪酸,作为极低密度脂蛋白的成分被脂肪细胞摄取,随后存储于白色脂肪组织[15]。慢性营养过剩造成的肥胖,促使小鼠肝脏脂肪生成和糖异生作用增强,发生显著的肝脏脂肪性病变[16]。脂肪组织功能障碍伴随的慢性炎症和脂肪因子的释放,进一步促使肝脏脂质代谢紊乱产生脂毒性,共同加剧胰岛素抵抗[15]。通过H&E染色和肝脏甘油三酯、胆固醇水平的检测,明确了lnc-ob1对脂肪细胞的调控作用。试验结果表明,lnc-ob1抑制了高脂饲喂对于脂肪沉积的不良影响,缓解了肝脏的NAFLD样变化。
肩胛和甲状腺周围脂肪棕色化标志基因表达量高,腹股沟脂肪(WAT)为代表的皮下脂肪高度表达成脂功能相关基因,性腺脂肪(肾周、肠系膜等内脏脂肪)高度表达炎症因子[17]。围绕3 个具有代表性的部位脂肪展开研究,探究lnc-ob1对于胰岛素抵抗的作用。试验中观察到lnc-ob1过表达显著减弱腹股沟脂肪细胞的细胞面积,表明脂肪细胞的大小或是区别于数量导致腹股沟白色脂肪垫重量减少的原因,进一步证明lnc-ob1调控脂质代谢而非脂肪细胞形成。
经典组成棕色脂肪的细胞存在于肩胛和肾周脂肪中,源自myf-5肌肉样细胞系,白色脂肪和棕色化的白色细胞源于的脂肪前体细胞[18]。白色脂肪组织的UCP1基因基础表达量非常低,但经过寒冷或c-AMP等途径长期刺激,会促发细胞产生多房性的棕色脂肪特征,并激活UCP1表达开启产热功能[19]。PRDM16促进白色脂肪棕色化阻断脂肪细胞纤维化,同时能够刺激骨骼肌成肌细胞向棕色脂肪细胞分化,驱动完整脂肪棕色化的基因表达程序[18]。lnc-ob1通过增加棕色脂肪的含量/活跃度从而增加能量消耗,减少脂质囤积,改善胰岛素抵抗,降低肥胖小鼠的体重量。产热基因UCP1、PGC-1α的激活,代表线粒体β氧化功能的PPAR-α表达量上升,证明lnc-ob1促进iWAT 棕色化转变为具有产热功能的米色脂肪组织[20]。
临床上利用胰岛素增敏剂促进前脂肪细胞向脂肪细胞的转化,促进脂肪细胞对血液游离脂肪酸和甘油三酯的摄取,从而降低血液中脂肪酸含量,缺点是易造成肥胖的副作用[21]。利用基因调控脂肪代谢,促进白色脂肪棕色化从而增强胰岛素敏感性的方法能降低药物的副作用,对于胰岛素抵抗和肥胖症或许有更大的治疗潜力[22]。
综上所述,本试验验证了在高脂饲喂诱导的肥胖小鼠脂肪发育中,不同脂肪组织的lnc-ob1表达量差异,过表达lnc-ob1促进了腹股沟脂肪的棕色化,减轻了小鼠的胰岛素抵抗,为后续研究lnc-ob1在白色脂肪棕色化中的作用机制提供了理论基础。
