GSTT1、GSTM1基因多态性与急性淋巴细胞白血病易感性及大剂量甲氨蝶呤血药浓度、所致急性肝损伤的相关性
2024-01-13林升禄余慧玲陈秋林吴雪梅
林升禄,余慧玲,陈秋林,吴雪梅
急性淋巴细胞白血病(ALL)主要表现为B系或T系淋巴细胞因增殖、分化、凋亡过程失调在骨髓等造血组织中恶性克隆增殖,抑制了正常造血功能,并可累积、浸润其他非造血组织[1]。该病治疗常用大剂量甲氨蝶呤(HD-MTX)配合亚叶酸钙解救疗法。MTX主要作用于细胞分裂S期,通过抑制二氢叶酸还原酶,阻止其转化为四氢叶酸,抑制嘌呤和嘧啶的合成进而干扰DNA合成从而减弱恶性细胞增殖,而HD-MTX指MTX给药剂量>500 mg/m2,相较于常规剂量,其可渗透血脑、血睾及血眼屏障,极大降低肿瘤髓外复发风险,提高患者长期生存率;但其对细胞的抑制作用也是产生不良反应的主要原因,其不良反应包括骨髓抑制、肝肾损伤及消化系统与神经系统毒性等[2]。
人类谷胱甘肽硫转移酶(GSTs)是一组主要参与体内外毒素代谢或促排毒素的超基因蛋白酶家族,广泛参与机体自我保护机制,对药物不良反应有较强的拮抗作用。GSTT1、GSTM1是GSTs家族的重要类型,已有研究表明GSTM1、GSTT1基因多态性与多种疾病的发生、药物所致肝损伤有关[3-4]。本研究观察GSTT1、GSTM1基因多态性与ALL易感性及HD-MTX血药浓度、所致急性肝损伤的相关性,报道如下。
1 资料与方法
1.1 资料来源 选取2016年6月—2021年2月福建医科大学附属协和医院血液科收治的ALL患者92例为病例组,另选取体检中心的健康体检者185例为对照组。病例组男64例,女28例;年龄(12.9±11.9)岁;B淋巴细胞型71例,T淋巴细胞型21例,经HD-MTX治疗后发生急性肝损伤53例。对照组男71例,女114例;年龄(13.6±16.7)岁。本研究通过医院伦理委员会审核批准。
1.2 病例组选择标准 纳入标准:均经骨髓病理活检及免疫组织化学检验确诊为急性淋巴细胞白血病患者;化疗前肝、肾功能均正常;排除标准:肾功能异常,甚至死亡者。
1.3 治疗方法 根据不同淋巴瘤分类及临床危险程度评分给予HD-MTX[澳大利亚Pfizer(Perth)Pty Limited生产]治疗,剂量为2~5 g/m2,前30 min快速静脉滴注总剂量的10~15%,余量23.5 h内匀速滴注完毕。治疗期间予5%碳酸氢钠注射液充分碱化处理,予5%葡萄糖注射液或0.9%氯化钠注射液充分水化处理。滴注结束12 h后采用注射用亚叶酸钙进行常规解救,常规监测用药第44小时的血药浓度,根据MTX血药浓度监测结果调整亚叶酸钙的解救次数与剂量。
1.4 DNA提取 采用EDTA抗凝管收集外周血2 ml,严格按EasyPrue血液基因组提取套件说明书用法执行。
1.5 GSTT1、M1基因型测定 采用课题组前期研究结果[5],即课题组改良的多重PCR法测定。GSTT1上下游引物序列分别为5′-TTCCTTACTGGTCCTCACATCTC-3′、5′-TCACCGGATCATGGCCAGCA-3′,GSTM1上下游引物序列分别为5′-GAA CTC CCT GAA AAG CTA AAGC-3′、5′-GTT GGG CTC AAA TAT ACG GTGG-3′,均采用β珠蛋白基因扩增结果作为阳性对照,上下游引物序列分别为5′-CAACTTCATCCACGTTCACC-3′、5′-GAAGAGCCAAGGACAGGTAC-3′;PCR反应体系(20 μl):DNA模版2 μl,T1或M1上下游引物各0.5 μl(10 μmol/L),β珠蛋白基因上下游引物各0.5 μl(10 μmol/L),EasyTap DNA PCR扩增混合液10 μl,d2H2O 6 μl。
1.6 不良反应判定标准 依据《急性药物性肝损伤诊治建议(草案)》[6],ALT或DBil值达正常值上限2倍以上或AST、ALP、DBil同时上升且至少1项达正常值上限2倍以上,判断为肝损伤。
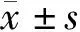
2 结 果
2.1 GSTT1、GSTM1基因分布情况及单基因多态性与ALL易感性分析 GSTM1基因多态性与ALL易感性相关(P=0.001),GSTM1(-)ALL患病风险较高,OR=2.451,95%CI(1.462~4.116);GSTT1基因型与ALL易感性无显著相关性(P>0.05),见表1。
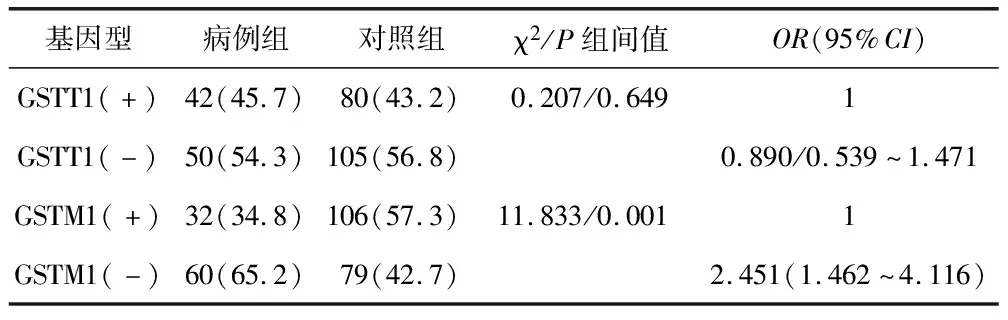
表1 GSTT1、GSTM1基因分布情况及单基因多态性与ALL的易感性分析 [例(%)]
2.2 GSTT1、M1联合基因多态性与ALL的易感性分析 GSTT1、M1双缺失型患病风险较高(P=0.038),OR=2.181,95%CI(1.037~4.587),见表2。
表2 GSTT1、M1联合基因多态性与ALL的易感性分析 [例(%)]
2.3 GSTT1、GSTM1基因多态性与MTX血药浓度的相关性 不同基因型C44 h/D组间比较差异均无统计学意义(P>0.05),见表3。
表3 GSTT1、GSTM1基因多态性与C44 h/D的相关性
2.4 GSTT1、GSTM1基因多态性与HD-MTX所致肝损伤的相关性 GSTM1基因多态性与HD-MTX所致肝损伤显著相关(P=0.004),GSTM1(-)肝损伤发生风险较高,OR=3.596,95%CI(1.464~8.836);未发现GSTT1基因多态性与肝损伤不良反应的相关性,见表4。
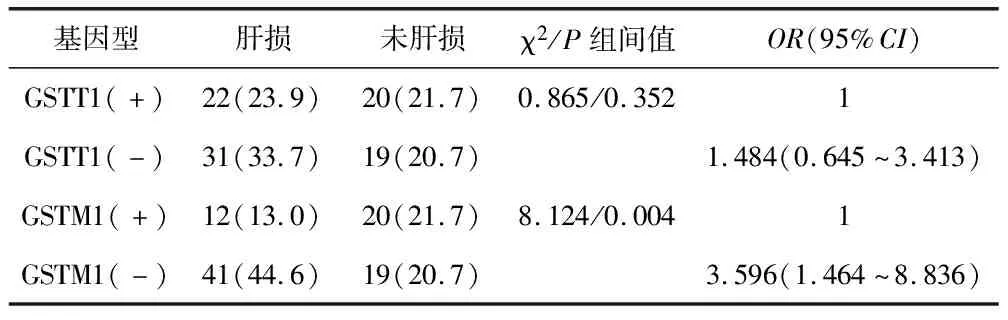
表4 GSTT1、GSTM1基因多态性与HD-MTX所致肝损伤的相关性 [例(%)]
3 讨 论
GSTs是重要的Ⅱ相代谢酶,其功能主要是催化亲电性的内、外源性毒物与GSH结合,增加疏水性以促其排出胞外、体外,起到解毒作用;部分GSTs具有过氧化物酶和异构酶活性,可发挥抗氧化损伤作用[6]。根据GSTs亚基结构、底物特异性及免疫原性等特征,人GSTs可分α、θ、μ、π、ω、σ、ζ、κ八大类,广泛分布于肝、肾、肺、血液、皮肤等组织器官的胞质中[7-8]。GSTM1、GSTT1分别是θ、μ类的GSTs,是GST蛋白家族重要成员,二者的基因多态性均表现为相应功能基因片段的缺失,从而导致相应GST蛋白缺失,失去对相应毒物的解毒作用,也更易导致毒物蓄积产生长期危害。
ALL是一种常见血液循环系统恶性肿瘤,发病机制尚未完全明确,可能与环境因素、遗传因素等相关;ALL占急性白血病的30%~40%,儿童最为常见,占儿童白血病75%;但儿童ALL治愈率较高(可达90%),而成年人治疗效果明显低于儿童[8]。因此对发生ALL的高危因素进行筛查研究,进而对ALL实现早预防、早发现、早治疗意义重大。GSTT1、M1基因多态性对ALL易感性研究倾向于GSTM1(-)增加ALL发病风险,而GSTT1对ALL易感性的相关性存在较大争议,仅在部分亚洲人群研究中发现GSTT1(-)增加ALL发病风险[9]。这可能与地域环境及种族遗传特征差异有关。本研究发现GSTM1(-)显著增加ALL患病风险(P=0.001,OR=2.451),GSTT1与ALL易感性不相关,与李娟等[10]的研究结果基本一致,因本研究人群主要来源福建地区汉族人群,具有较好地域代表性。目前,基于中国人群相关研究相对较少,且受地域、样本量限制,有必要进一步增加样本量扩大人群研究以明确。
急性肝损伤是HD-MTX治疗过程中最为常见的药物不良反应,发生率高达60%[2]。药物肝损伤发生因素众多,包括肝内Ⅰ、Ⅱ、Ⅲ相代谢酶的种类及活性水平、肝细胞氧化损伤情况、药物及其代谢物引发的机体免疫应激水平(如各信号通路的交互作用等),以及在此基础上融合药物剂量和个体特异性的影响,复杂性较高[11]。本研究发现GSTM1(-)增加急性肝损伤发生风险(P=0.004,OR=3.596),与多数研究结果一致;未发现GSTT1基因多态性与肝损伤不良反应的相关性;同时也未发现GSTT1、M1基因多态性与血药浓度C44 h的相关性,与刘俊闪[12]的研究结论不一致,可能与MTX主要经肾排泄及MTX代谢机制(GSTs并非MTX代谢的主要参与者)有关,也可能C44 h为消除相取值,且受亚叶酸钙解救、水化、碱化处理的个体差异影响较大,有待进一步研究证实。
综上所述,GSTM1(-)显著增加ALL及HD-MTX治疗所致肝损伤的发生风险,提示GSTM1酶蛋白在血液疾病发生和机体抵抗药物与环境毒物损伤方面的重要作用。
利益冲突:所有作者声明无利益冲突。
