SARS-CoV-2不同毒株在K18-hACE2小鼠体内的毒力比较
2024-01-02张秋王如玉范慧芬孙凯丽刘元浪夏云翔徐秀丽卢佳李新国
张秋,王如玉,范慧芬,孙凯丽,刘元浪,夏云翔,徐秀丽,卢佳,李新国
武汉生物制品研究所有限责任公司,湖北 武汉 430207
冠状病毒属于冠状病毒科,为包膜阳性单链RNA病毒,在人类和动物中可引起轻度至重度的呼吸道、肠道和神经系统疾病[1]。严重急性呼吸系统综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)是一种β 冠状病毒,也是引起2019年新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)的病原体[2-3]。自2019 年12 月COVID-19大流行暴发以来,SARS-CoV-2 的变种反复出现。一些变异已在世界范围内传播,并对不同地区发生周期性的感染传播具有重大影响。在2020 年10—12月期间,全球出现了高关注变异株(variant of concern,VOC),这些VOC(Alpha、Beta、Delta)表现出更强的传播能力或免疫逃逸特性,并在许多国家推动了疫情的复苏,增加了全球大流行的控制难度,其中高传染性的Delta 变异株随后取代了世界大多数地区的所有其他VOC[4]。直至2021 年11 月,世界卫生组织(World Health Organization,WHO)报告了新的突变株Omicron,Omicron 变异株与原型株比较,发生了53个突变点,仅刺突糖蛋白(spike glycoprotein,简称S 蛋白)编辑基因序列上即有30 个突变位点,且其中13个在其他VOC 中很少见,这些突变点聚集在刺突基因的3 个功能上重要的区域,这些区域可能会影响S蛋白三聚体亚基之间的相互作用以及亚基从下向上转变的倾向,S 蛋白与血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)受体的相互作用,以及S 蛋白启动膜融合,这些位点的突变可能彼此相互作用,这些相互作用的综合效应可能是适应性的,鉴于Omicron相对于所有先前已知的SARS-CoV-2变异株具有明显的流行上升优势,继而在全球SARSCoV-2 感染中占据主导地位[5-7]。截至2022 年10 月,全球已向WHO 报告了超过6.17 亿例确诊病例和653万例死亡病例(https://covid19.who.int/)。
迄今为止,虽然相继报道了几种动物模型(小鼠、金黄地鼠、雪貂、狗和猫、非人灵长类动物等)易感SARS-CoV-2,其中金黄地鼠、雪貂和非人灵长类动物感染后会发展为轻度至中度病毒性疾病,并会自发恢复,但无一种动物模型能完整地概括COVID-19 所有病理特征[8-13]。SARS-CoV-2 通过病毒S 蛋白与ACE2 之间的相互作用与靶细胞结合,ACE2 被认为是主要的宿主进入受体[14-16]。ACE2与S蛋白的相互作用对于宿主趋向性至关重要,ACE2的小鼠同源物与SARS-CoV-2 的S 蛋白不相容,因此,典型的野生型小鼠品系对SARS-CoV-2 不敏感,需在小鼠体内异源表达人ACE2(hACE2)。K18-hACE2 小鼠是在人细胞角蛋白18(keratin 18,K18)启动子调控下在上皮细胞中表达hACE2[17],不同于其他动物模型感染后只产生短暂的、轻度或中度肺部感染等非致死性特征[13],K18-hACE2小鼠通过鼻内接种感染SARSCoV-2 后会致死,与人类严重COVID-19 具有许多共同特征,感染后除肺部能检测到高病毒载量,其他器官(如大脑、鼻甲等)也能检测到不同水平的病毒[8,18-19],早期报告显示,致死率主要与重度肺部炎症和呼吸功能受损有关[13,20]。但神经侵入和神经传播的混杂影响及其在SARS-CoV-2 感染K18-hACE2 小鼠临床衰退中的作用也逐渐得到进一步认可[21-22]。因此,K18-hACE2 小鼠感染SARS-CoV-2 后观察到的疾病严重程度为研究疾病和评价抗病毒药物提供了有效的模型。
本研究通过滴鼻途径探讨SARS-CoV-2 不同毒株(Prototype、Delta、Beta、Omicron BA.1)对K18-hACE2小鼠的感染效果,现报道如下。
1 材料与方法
1.1 病毒株 SARS-CoV-2 原型株(Prototype)及VOC株Delta(B.1.617.2)、Beta(B.1.351)、Omicron BA.1(B.1.1.529)均由武汉生物制品研究所有限责任公司生物安全三级实验室提供。
1.2 实验动物 SPF 级K18-hACE2 小鼠,雄性,6~8周龄,体质量22~25 g,由江苏集萃药康生物科技股份有限公司提供,动物许可证号:SCXK(苏)20180008。动物饲养于武汉生物制品研究所有限责任公司生物安全三级实验室ABSL-3小动物室,动物使用许可证:SYXK(鄂)2021-0117,并获得武汉生物制品研究所有限责任公司实验动物福利伦理审查委员会批准(批准文号:WIBP-AⅡ442021007)开展相关动物实验。
1.3 主要试剂及仪器 4%多聚甲醛固定液购自武汉塞维尔生物科技有限公司;异氟烷购自深圳瑞沃德生命科技有限公司;新型冠状病毒2019-nCoV 核酸检测试剂盒和全自动核酸提取仪均购自广州达安基因股份有限公司;冷冻型高通量组织研磨器购自宁波新芝生物科技股份有限公司。
1.4 动物分组及处理 共选取112 只K18-hACE2 小鼠,随机分为4 组:SARS-CoV-2 原型株Prototype 组(攻毒剂量分别为1、5、25、125 CCID50)、变异株Delta组(攻毒剂量分别为1、5、25 CCID50)、变异株Beta 组(攻毒剂量分别为1、5、25、125 CCID50)和变异株Omicron BA.1组(攻毒剂量分别为1、5、25、125、625 CCID50),每组每个剂量均6只,未感染小鼠每组4只。小鼠用异氟烷麻醉后,采用滴鼻方式进行攻毒,每日监测体质量,并观察感染后小鼠的状态,观察周期变异株Beta组为6 d,其他3组为14 d。
1.5 半数致死量(LD50)的计算 利用IBM SPSS Statistics 26 软件[19],采用机率单位加权回归法(Bliss 法)计算LD50。
1.6 组织病毒核酸载量检测 小鼠死亡或感染后第14天进行解剖,取肺和脑组织各50 mg、鼻甲100 mg,加入1 mL PBS 和适量钢珠,通过冷冻型高通量组织研磨器充分匀浆(4 ℃,50 Hz),匀浆后的组织在4 ℃条件下,11 292×g离心10 min,取上清,-80 ℃保存。按照核酸检测试剂盒说明书提取组织匀浆上清RNA,通过全自动核酸提取仪对组织病毒RNA 载量进行检测。
1.7 肺组织病理检测 组织用4%多聚甲醛固定液充分固定后,进行石蜡包埋和切片,切片用苏木精和伊红染色(HE 染色),显微镜下观察,对组织切片进行病理评分,评价其组织病理损伤及病毒感染致病情况。
1.8 统计学分析 应用GraphPad Prism 8.4.0 软件进行统计分析,体质量和病毒载量组间比较采用单因素方差分析、双因素方差分析、t tests检验等方法,以P<0.05为差异有统计学意义。
2 结果
2.1 不同毒株感染小鼠的体质量变化及存活情况
2.1.1 Prototype 株感染小鼠 感染第4~5 天小鼠体质量开始下降,出现弓背,颤抖等临床症状。攻毒剂量≥5 CCID50的小鼠感染后第5 ~ 8 天全部死亡,死亡率为100%,小鼠死亡时体质量下降范围为7.25%~20.06%;1 CCID50剂量组小鼠存活1只,存活小鼠的体质量在感染14 d 后恢复至感染前,且增加2.68%,同组内死亡小鼠体质量下降范围为14.03%~ 16.13%。各攻毒剂量组与空白对照组体质量变化比较,差异均有统计学意义(P=0.010 6~0.045 5)。见图1A、图2A 和表1。经计算,感染SARS-CoV-2 Prototype 株的LD50为0.60 CCID50。

图1 SARS-CoV-2不同毒株感染后小鼠体质量的变化Fig.1 Change of body mass of mice infected with different strains of SARS-CoV-2

图2 SARS-CoV-2不同毒株感染后小鼠的存活情况Fig.2 Survival of mice infected with different strains of SARS-CoV-2

表1 小鼠攻毒后SARS-CoV-2不同毒株的LD50Tab.1 LD50 of different strains of SARS-CoV-2 after challenge in mice
2.1.2 Delta株感染小鼠 感染第5天小鼠体质量下降,出现弓背,颤抖等临床症状。感染后第7天,25 CCID50剂量组小鼠全部死亡,死亡率为100%,体质量平均下降13.0%;感染后第14 天,5 CCID50剂量组小鼠只有1只存活,死亡率为83.33%,存活小鼠的体质量在感染14 d 后恢复至感染前,且增加5.72%,同组内死亡小鼠体质量下降范围为2.08%~8.83%;1 CCID50剂量组小鼠在感染后第14 天有2 只存活,死亡率为66.67%,存活小鼠的体质量在感染14 d 后恢复至感染前,且增加(7.56±2.11)%,同组内死亡小鼠体质量下降范围为5.55%~13.92%。各攻毒剂量组未死亡的小鼠在感染后第8 天体质量恢复至感染前。5和25 CCID50剂量组与空白对照组体质量变化比较,差异均有统计学意义(P分别为0.033 2 和<0.000 1)。见图1B、图2B和表1。经计算,感染SARS-CoV-2 Delta株的LD50为0.52 CCID50。
2.1.3 Beta株感染小鼠 感染第3天小鼠体质量开始下降,出现弓背,颤抖等临床症状。攻毒剂量≥1 CCID50的小鼠感染后第4~6 天全部死亡,死亡率为100%,小鼠死亡时体质量下降范围为8.58%~21.65%。各攻毒剂量组与空白对照组体质量变化比较,差异均有统计学意义(P均<0.000 1)。见图1C、图2C和表1。经计算,感染SARS-CoV-2 Beta株的LD50为<1 CCID50。
2.1.4 Omicron BA.1 株感染小鼠 感染第4~6 天小鼠体质量开始下降。625 CCID50剂量组小鼠感染后第5~8 天全部死亡,死亡率为100%,小鼠死亡时体质量下降范围为7.81% ~ 20.65%;125 CCID50剂量组小鼠感染后第6~9天死亡4只,死亡率为67%,体质量下降范围为11.57%~21.00%,存活的2只小鼠感染14 d 后体质量恢复至感染前,且增加(6.06 ±0.91)%;5 和25 CCID50剂量组小鼠分别在感染后第7、8天死亡,且体质量分别下降18.03%和14.93%,存活的小鼠在感染14 d后体质量恢复至感染前,且分别增加(5.16 ± 3.57)%和(4.47 ± 2.08)%;625 CCID50剂量组与空白对照组体质量变化比较,差异有统计学意义(P<0.000 1)。见图1D、图2D 和表1。经计算,感染SARS-CoV-2 Omicron BA.1 株的LD50为52.92 CCID50。
小鼠体质量及存活情况显示,在相同攻毒剂量条件下,SARS-CoV-2 Beta 株感染后第4 天小鼠即出现死亡,表明与其他毒株相比病毒毒力强,且1 CCID50的攻毒剂量感染小鼠死亡率即达100%,致死率高。病毒毒力强弱其次是Delta株、Prototype株和Omicron BA.1株。感染后未死亡的小鼠在观察周期末期体质量基本均恢复至攻毒前。
2.2 不同毒株感染小鼠的组织病毒核酸载量
2.2.1 Prototype株感染小鼠 各攻毒剂量组小鼠组织(肺、脑、鼻甲)病毒拷贝数与对应空白对照组组织相比,差异均有统计学意义(P<0.000 1~0.037 2)。且攻毒后肺组织和鼻甲组织中病毒拷贝数随着攻毒剂量的增加而递增,攻毒后脑组织中病毒拷贝数平均值均在108copies/mL以上。见图3和表2。

图3 SARS-CoV-2 Prototype株感染小鼠的肺(A)、脑(B)、鼻甲(C)组织病毒核酸拷贝数Fig.3 Viral nucleic acid copy number in lung(A),brain(B)and turbinate(C)tissues of mice infected with Prototype strain of SARS-CoV-2

表2 SARS-CoV-2不同毒株攻毒后小鼠组织中的病毒核酸拷贝数(Log10 copies/mL,Mean±SD,n=6)Tab.2 Viral nucleic acid copy number in tissues of mice challenged with different strains of SARS-CoV-2(Log10 copies/mL,Mean ±SD,n=6)
2.2.2 Delta 株感染小鼠 各攻毒剂量组小鼠组织(肺、脑、鼻甲)病毒拷贝数与对应空白对照组组织相比,差异均有统计学意义(P< 0.000 1 ~ 0.039 6)。脑组织病毒核酸拷贝数随着攻毒剂量的增加呈正相关,相同攻毒剂量组死亡小鼠的脑组织病毒核酸拷贝数高于存活小鼠。见图4和表2。

图4 SARS-CoV-2 Delta株感染小鼠的肺(A)、脑(B)、鼻甲(C)组织病毒核酸拷贝数Fig.4 Viral nucleic acid copy number in lung(A),brain(B)and turbinate(C)tissues of mice infected with Delta strain of SARSCoV-2
2.2.3 Beta 株感染小鼠 各攻毒剂量组小鼠组织(肺、脑、鼻甲)病毒拷贝数与对应空白对照组组织相比,差异均有统计学意义(P<0.000 1~0.000 7)。攻毒后肺组织中病毒拷贝数随着攻毒剂量的增加而递增,攻毒后死亡小鼠脑组织中病毒拷贝数平均值可达1011copies/mL以上,攻毒后鼻甲组织中病毒拷贝数平均值均在106copies/mL以上。见图5和表2。
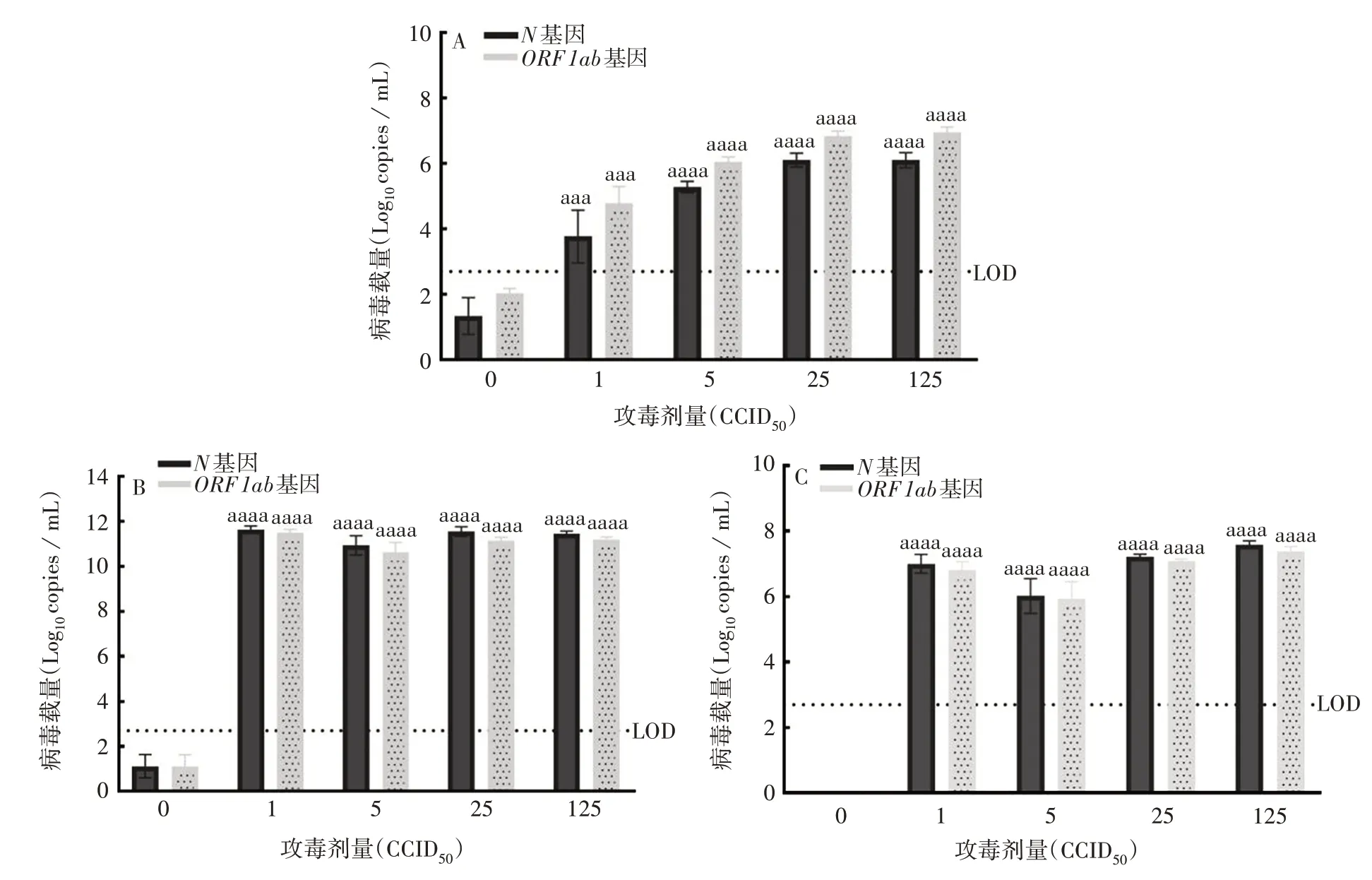
图5 SARS-CoV-2 Beta株感染小鼠的肺(A)、脑(B)、鼻甲(C)组织病毒核酸拷贝数Fig.5 Viral nucleic acid copy number in lung(A),brain(B)and turbinate(C)tissues of mice infected with Beta strain of SARSCoV-2
2.2.4 Omicron BA.1株感染小鼠 625 CCID50攻毒剂量组小鼠组织(肺、脑、鼻甲)病毒拷贝数与对应空白对照组组织相比,差异均有统计学意义(P均<0.000 1)。且攻毒后肺和鼻甲组织中病毒拷贝数随着攻毒剂量的增加而递增;攻毒剂量≤25 CCID50脑组织中病毒拷贝数平均值均低于106copies/mL,攻毒剂量≥125 CCID50组死亡小鼠脑组织中病毒拷贝数平均值高于108copies/mL。见图6和表2。

图6 SARS-CoV-2 Omicron BA.1株感染小鼠的肺(A)、脑(B)、鼻甲(C)组织病毒核酸拷贝数Fig.6 Viral nucleic acid copy number in lung(A),brain(B)and turbinate(C)tissues of mice infected with Omicron BA.1 strain of SARS-CoV-2
组织病毒核酸拷贝数分析结果显示,在所有死亡小鼠大脑中均可检测到很高的病毒核酸拷贝数,表明受感染小鼠严重疾病的发作与大脑中的病毒水平相关,SARS-CoV-2 在鼻内感染后通过某种途径进入大脑。不同病毒株感染后,各剂量组小鼠肺组织病毒核酸拷贝数整体趋势呈随着攻毒剂量的增加而递增。但与脑组织比较,肺组织病毒载量相对较低。除Omicron BA.1 外,其他毒株(Prototype、Delta、Beta)的肺组织病毒拷贝数比其相应鼻甲组织病毒拷贝数低。
2.3 不同毒株感染小鼠的肺组织病理损伤情况 感染SARS-CoV-2 不同毒株的各剂量组小鼠肺组织出现不同程度的肺部损伤,攻毒剂量越高,病理损伤程度越严重。低剂量未死亡小鼠肺组织主要是肺间质淤血、部分肺泡呈肺气肿、部分弥漫性的肺静脉淤血,肺泡壁淤血伴有少量的炎症细胞浸润等症状;死亡小鼠肺组织损伤主要涉及肺泡、间质和血管周围室,以轻度至中度淋巴组织细胞和轻度中性粒细胞性间质性肺炎为特征;可见局部肺泡坏死,肺泡腔内可见红细胞淤积及坏死细胞碎片,肺泡壁充血、水肿,部分血管内可见炎症细胞团。结合肺组织病理情况分析,病理损伤严重程度:Beta 株> Delta 株>Prototype 株>Omicron BA.1株,其中Omicron BA.1株肺组织损伤程度相较于其他毒株明显减轻,表明Omicron BA.1 株病毒感染主要集中于上呼吸道。见表3和图7。

图7 SARS-CoV-2不同毒株感染后小鼠肺组织病理损伤情况(HE染色,×20)Fig.7 Pathological damage of lung tissue in mice infected with different strains of SARS-CoV-2(HE staining,×20)

表3 SARS-CoV-2不同毒株感染小鼠肺组织病理结果分析Tab.3 Pathological results of lung tissue in mice infected with different strains of SARS-CoV-2
3 讨论
SARS-CoV-2 已发现多种突变株,给全球公共卫生安全带来巨大挑战。SARS-CoV-2 感染后可引起肺炎、急性呼吸窘迫综合征、急性肺损伤、细胞因子风暴综合征,甚至死亡[23-24]。动物模型的发展有助于深入了解其发病机制以及加快药物和疫苗的研发,特别是VOC 的不断出现,对于控制COVID-19 疫情蔓延至关重要。K18-hACE2 小鼠模型已成为一种使用广泛的实验室动物模型,适用于研究SARSCoV-2发病机制以及评估针对COVID-19的医学对策的有效性[25]。本研究利用K18-hACE2 小鼠,结合各毒株的流行趋势(主要以致死率及传播感染能力为主),设置不同滴度的攻毒剂量,通过滴鼻感染途径比较SARS-CoV-2 不同毒株(Prototype、Delta、Beta、Omicron BA.1)的感染情况,根据动物存活情况分别计算SARS-CoV-2 不同毒株的LD50并进行比较,发现Beta 株的毒力最强,致死性高,传播性较其他毒株较弱,这也是Beta 株渐渐被其他传播感染能力强的毒株取代的原因。本研究表明,K18-hACE2 小鼠感染后,病毒在肺组织中有一定的复制能力,且在肺组织发生了轻度至中度肺部病变,同时在所有死亡小鼠的大脑组织中检测到较高水平的病毒复制,可能神经传播相关的致命性疾病导致了死亡。其中,在K18-hACE2 小鼠的肺组织病毒核酸复制相对较低,表明hACE2 表达可能不是SARS-CoV-2 易感性的唯一宿主决定因素。虽然之前报道在K18 调控下,hACE2基因主要在肺和肠中表达,在肾脏、肝脏、脾脏和小肠中表达程度较低,在大脑中的表达水平相对较小[26],但hACE2在K18-hACE2 小鼠组织中的细胞分布在很大程度上仍未确定,此前相关报道表明,K18-hACE2 小鼠模型中疾病的性质、严重程度和结果不仅由hACE2的表达和组织分布决定,且与神经传播的致死性有关,部分原因是嗅神经上皮中的区域ACE2过表达,通过嗅神经的轴突运输促进神经侵入,导致神经元变性和坏死[27]。本研究进一步验证了导致小鼠死亡的原因可能是病毒通过某种途径进入脑组织中,引起神经传播相关的致命性疾病。
自疫情暴发以来,SARS-CoV-2 就表现出明显的突变多样性,病毒突变株不断出现。2021 年11 月,WHO首次报道了Omicron变异株,其引发了新一波感染,迅速席卷全球,并在全球SARS-CoV-2感染中占主导地位。相关研究评估了Omicron BA.1 株与包括人类在内的27个物种的ACE2受体的结合,发现Omicron BA.1已将其受体结合谱扩展到了果子狸、啮齿动物、多种蝙蝠以及一些刺猬中,进而发现Omicron BA.1的宿主范围比SARS-CoV-2 原始毒株更广[28]。随着Omicron 变异株的不断更新,仅Omi-cron BA.2 在全球引起激增的几周后,BA.4 和BA.5 也在全球出现,是Omicron不断增长的冠状病毒亚型家族最新成员,与Omicron BA.1 株相比,这两种变体与BA.2 更为相似,但BA.4和BA.5携带自己独特的突变,包括病毒S蛋白中L452R 和F486V 的突变点,这些突变点可能会改变其与宿主细胞结合的能力,从而绕过某些免疫反应[29]。因此,应加强对Omicron 突变株的监测,以监测其与更广泛物种的受体结合,防止其进一步向其他潜在宿主的溢出和扩张,从而导致SARS-CoV-2的长期大流行。
