探究益正方对反复呼吸道感染模型大鼠肺泡上皮细胞焦亡的影响*
2023-12-28周怡锦田新磊祝志朋赵文锦
周怡锦,田新磊,祝志朋,赵文锦,朱 珊
(河南省中医院(河南中医药大学第二附属医院) 郑州 450053)
反复呼吸道感染(Recurrent respiratory tract infection,RRTI)是儿童和青少年最常见的疾病之一,多发生于5 岁以下儿童,占所有儿科呼吸道感染的10%-30%,其病理和病因机制复杂[1]。临床上认为,该病的发病与免疫功能障碍、维生素缺乏、营养不良、微生物感染和护理不当有关。在大多数情况下,呼吸道感染发展迅速,儿童通常有典型的症状,如打喷嚏和咳嗽、流鼻涕和充血、发烧,这些症状随年龄而异。除上述症状外,RRTI通常伴有面黄消瘦、食欲不振等症状,如不及时采取有效措施,还可能引发心肌炎、哮喘等疾病,严重影响儿童的身体发育和健康[2]。RRTI免疫缺陷的儿童可以通过抗体替代疗法治疗,但费用巨大[3]。因此,为RRTI 开发安全、有效和负担得起的药物是当务之急。
中医经过2000多年的发展,形成了从诊断到预后的完整保健体系,为临床应用和医学研究积累了宝贵的经验。中医药的功效已被越来越多的人和国家所认可,世界多个国家进行了中医药缓解症状功效的研究[4]。研究表明,中药可以降低RRTI 的发生率,显著改善RRTI 的临床症状[5]。中医药有效治疗RRTI 一直是许多研究人员和儿科专家关注的焦点。益正方主要由黄芪、茯苓、清半夏、川芎、炒鸡内金、甘草、西洋参、五味子、醋鳖甲、砂仁等中药组成,已被证实是治疗RRTI的有效方药,且疗效显著[6]。
本课题结合临床症状,制备RRTI 大鼠模型,拟通过不同剂量的益正方治疗,并以玉屏风散(治疗呼吸道疾病的重要汤剂)[7]为对照,通过评价益正方对RRTI模型的疗效,并探讨了中医药治疗RRTI 的作用机制,以为益正方改善RRTI提供新思路。
1 材料与方法
1.1 材料
益正方:黄芪、茯苓、清半夏、川芎、炒鸡内金、甘草、西洋参、五味子、醋鳖甲、砂仁等中药组成;玉屏风散:由黄芪、防风和白术组成。均经河南中医院大学第二附属医院的药剂科制备形成混悬液。益正方浓度为2 g生药·mL-1;玉屏风散的浓度为1.5 g生药·mL-1。
IL-6 ELISA 试剂盒(EK0412)、TNF-β ELISA 试剂盒(EK0584)和IL-10 ELISA(EK0418)试剂盒均获自武汉BOSTER;HE 染色试剂盒(C0105M)、PAS 染色试剂盒(C0142M)、TUNEL 凋亡试剂盒(荧光法,QIA39)均获自美国Merck-Calbiochem;一抗Caspase-1(ab179515)、GSDMD(ab219800)、IL-1β(ab216995)、HMGB1(ab18256)、TLR4(ab218987)、p-NF-κB p65(ab239882)和β-actin(ab8226)均获自英国Abcam。
1.2 动物分组及模型构建
SPF 级别1 月龄SD 大鼠(体质量80-100 g)80 只(雌雄各半)购自河南省实验动物中心,许可证号SCXK(豫)2017-0001。大鼠适应生长1周后根据随机数字表法分成正常组12 只,模型组60 只。模型组大鼠通过疲劳结合饮食失节法和刨花加烟叶烟熏法诱导脾气虚证和肺气虚证[8]。具体操作如下:在1-34 天中,将大鼠置于水池中(30℃)游泳至耐力极限(即大鼠口鼻首次浸入水中),在这期间大鼠自由饮水,单日每只大鼠饲喂20 g 白菜,双日以15 mL·kg-1浓度油脂灌胃。在第13-34天中,采用刨花加烟叶烟熏大鼠30 min(各15 g)。造模后大鼠出现呼吸急促、咳嗽、精神萎靡、懒动、弓背等现象,即表明造模成功。
随后将模型组大鼠分为5 组,每组12 只:分别为RRTI 模型组、玉屏风散对照治疗组、以及益正方高、中、低剂量组,正常组还为正常组。自分组之日起开始灌胃,每日1次,连续6周。正常组和RRTI模型组灌胃生理盐水0.5 mL·100 g-1·d-1;玉屏风散对照治疗组灌胃混悬液0.5 mL·100 g-1·d-1,益正方高、中、低剂量组分别按照临床人用药量的15 倍,即0.75 mL·100 g-1·d-1;10 倍,即0.5 mL·100 g-1·d-1;5 倍,即0.25 mL·100 g-1·d-1给予益正方混悬液灌胃。
1.3 肺功能测量
根据制造商说明,使用AniRes2005 动物肺功能分析系统(北京贝兰博科技有限公司)评估大鼠的肺功能。简而言之,在治疗结束后,用3%戊巴比妥钠(70 mg·kg-1)将大鼠麻醉并置于固定仰卧位的容量盒中。最后,对大鼠进行气管插管,插管来连接呼吸机和信号调节器,将气流和体积变化的数据传输到计算机。呼吸频率预设为每分钟75 次,呼气/吸气时间比为1.5∶1。检测用力肺活量(Forced vital capacity,FVC)和0.3 秒用力呼气量(Forced expiratory volume in 0.3 seconds,FEV0.3),以两者之比(FEV0.3/FVC)作为评价大鼠肺功能的指标。
1.4 标本采集
治疗结束后,大鼠禁食(可饮水)12 h后,摘取眼球收集血液于促凝管中,用于炎症因子水平的检测。取血后颈椎脱臼处死大鼠,取部分左肺上叶组织用于制作病理切片,左肺下叶组织置于-80℃冰箱中备用。右肺用于检测肺干湿比。
1.5 血清中炎症因子(IL-6、TNF-β、IL-10)的检测
收集的大鼠血液在自然条件下凝固20 min,而后在4℃下离心20 min(2000 r·min-1),收集上清。将待测样本和标准品在15 min内添加到酶标板中孵育2 h。去除孔中液体,添加对应的生物素化抗体后孵育1 h。添加显色剂避光孵育20 min后加入终止液混匀,随后检测A450值(450 nm波长处的A值)。绘制标准曲线,通过样品的A450值和标准曲线获得样品相应的浓度。
1.6 组织病理学分析
左肺分离后部分组织用4%多聚甲醛固定,脱水后石蜡包埋,切成5 μm 厚的切片,用HE 染色后,通过光学显微镜分析其组织病理学。肺组织的炎症损伤情况以0-5的等级确定[9]:0:正常;1:炎症细胞很少;2:存在一层较深的环状炎症细胞;3:存在2-4 层厚的炎症细胞;4:炎症细胞环超过4 个细胞深度。通过PAS染色来分析气道杯状细胞。根据PAS 阳性细胞的百分比对杯状细胞的增生进行评分[10]:0:无杯状细胞;1:杯状细胞百分比小于25%;2:杯状细胞百分比介于25%-50%之间;3:杯状细胞百分比介于51%-75%之间;4:杯状细胞百分比超过75%。此外,将部分切片脱蜡、复水后进行TUNEL 染色,DAPI 复染,最后在荧光显微镜下观察细胞的凋亡情况。
1.7 肺干湿比检测
处死大鼠后,分离右肺,立即记录肺的重量作为湿重。用滤纸吸干肺上的血液,然后将肺储存在60℃的培养箱中48 h。肺的重量被记录为干重。肺干湿比(湿重/干重)用于评估肺水肿程度。
1.8 Western blot检测
经过超声处理将-80℃的肺组织均质化,并使用补充有PMSF 的RIPA 裂解缓冲液提取肺组织的总蛋白。定量后经SDS-PAGE 分离蛋白质并转移到PVDF膜上。用5%脱脂牛奶封闭后,将膜与Caspase-1、GSDMD、IL-1β、HMGB1、TLR4、p-NF-κB p65 和β-actin一抗在4℃下低温孵育过夜。添加二抗进一步培养2 h后通过ECL 化学发光观察。经Image J 软件对蛋白质条带的整体灰度值进行量化。
1.9 统计学分析
使用SPSS 22.0 进行统计分析。符合正态分布的计量资料均以平均值±标准差(±s)来表示。多组间差异比较采用单因素方差分析,进一步两两比较用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 益正方对RRTI大鼠模型肺功能损伤的影响
表1 结果显示,与正常组比较,RRTI模型组FEV0.3与FEV0.3/FVC 比值均明显下调,FVC 显著上调(P<0.05)。与RRTI 模型组比较,玉屏风散对照治疗组以及益正方高、中、低剂量治疗组FEV0.3与FEV0.3/FVC 比值均明显上调,FVC 显著下调(P<0.05)。与玉屏风散对照治疗组比较,益正方高剂量治疗组FEV0.3、FVC 以及FEV0.3/FVC 比值变化无统计学意义(P>0.05),益正方中、低剂量组FEV0.3与FEV0.3/FVC 比值明显下调,FVC显著上调,且均呈益正方剂量依赖性(P<0.05)。
2.2 益正方对RRTI 大鼠血清中炎症因子水平的影响
表2 结果显示,与正常组比较,RRTI 模型组TNFβ、IL-6 水平明显升高,IL-10 水平显著降低(P<0.05)。与RRTI 模型组比较,玉屏风散对照治疗组以及益正方高、中、低剂量治疗组TNF-β、IL-6 水平明显降低,IL-10 水平显著升高(P<0.05)。与玉屏风散对照治疗组比较,益正方高剂量治疗组TNF-β、IL-6和IL-10水平变化无统计学意义(P>0.05);益正方中、低剂量组TNF-β、IL-6 水平明显升高,IL-10 水平显著降低,且均呈益正方剂量依赖性(P<0.05)。
2.3 益正方对RRTI大鼠肺损伤的影响
图1、表3 结果显示,正常组肺组织和支气管杯状细胞无病理损伤情况,在RRTI 模型大鼠中出现肺组织间隔增厚、肺间质水肿以及炎症细胞浸润等病理改变,并且杯状细胞明显增生,在使用玉屏风散和益正方治疗后以上病理损伤程度均得到不同程度的改善。具体体现在,与正常组比较,RRTI模型组病理学评分、PAS 评分、TUNEL 阳性细胞数以及肺干湿比均明显上调(P<0.05)。与RRTI模型组比较,玉屏风散对照治疗组以及益正方高、中、低剂量治疗组病理学评分、PAS评分、TUNEL 阳性细胞数以及肺干湿比均明显下调(P<0.05)。与玉屏风散对照治疗组比较,益正方高剂量治疗组病理学评分、PAS评分、TUNEL阳性细胞数以及肺干湿比变化无统计学意义(P>0.05);益正方中、低剂量组病理学评分、PAS 评分、TUNEL 阳性细胞数以及肺干湿比均上调,且均呈益正方剂量依赖性(P<0.05)。
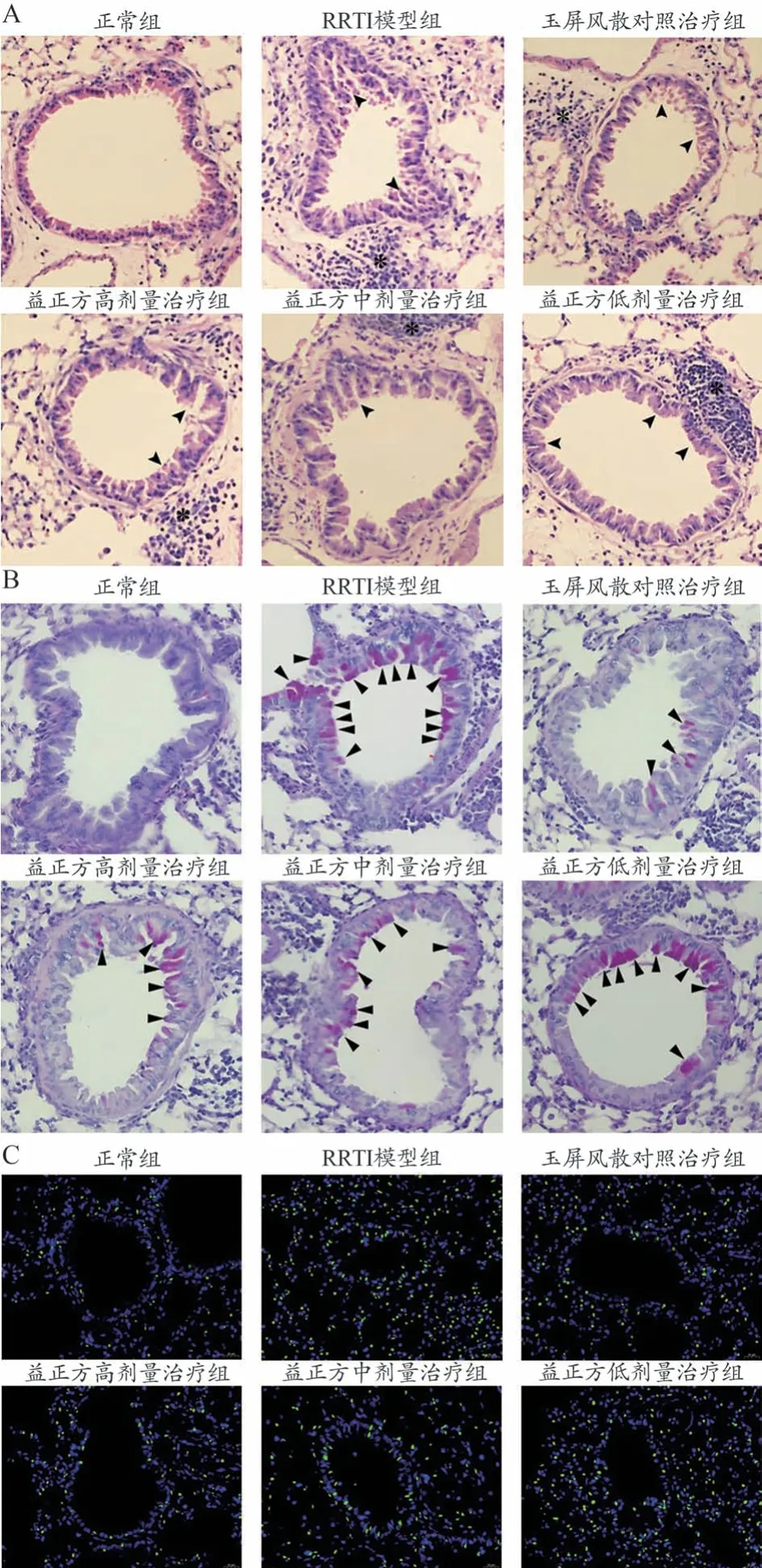
图1 组织病理学分析益正方对RRTI大鼠肺损伤的影响
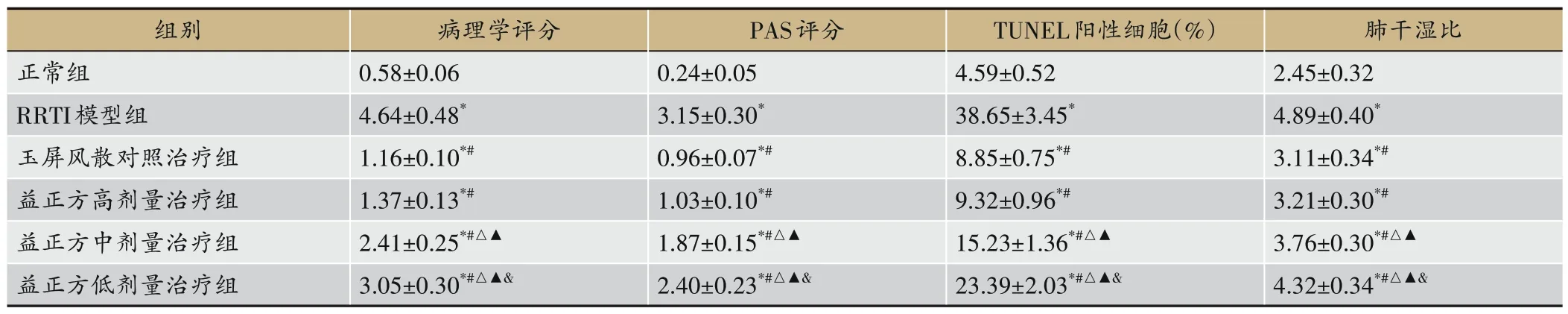
表3 益正方对RRTI大鼠肺损伤的影响(n=6)
2.4 益正方对RRTI大鼠肺泡上皮细胞焦亡的影响
图2 结果显示,与正常组比较,RRTI 模型组Caspase-1、GSDMD 和IL-1β 蛋白水平明显上调(P<0.05)。与RRTI 模型组比较,玉屏风散对照治疗组以及益正方高、中、低剂量治疗组Caspase-1、GSDMD 和IL-1β 蛋白水平均明显下调(P<0.05)。与玉屏风散对照治疗组比较,益正方高剂量治疗组Caspase-1、GSDMD 和IL-1β 蛋白水平变化无统计学意义(P>0.05);益正方中、低剂量组Caspase-1、GSDMD和IL-1β蛋白水平均上调,且均呈益正方剂量依赖性(P<0.05)。
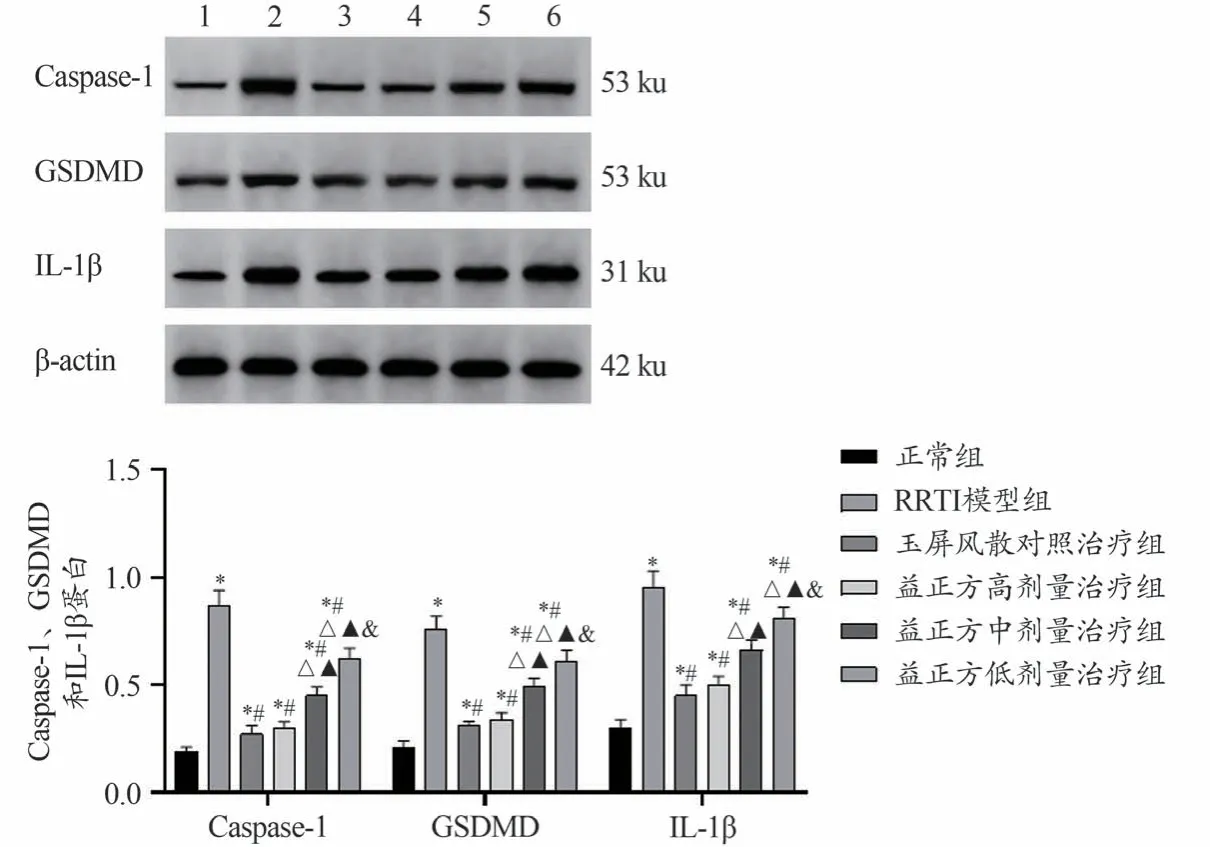
图2 Western blot检测Caspase-1、GSDMD和IL-1β蛋白表达情况
2.5 益正方对RRTI 大鼠HMGB1/TLR4/NF-κB 信号通路的影响
图3 结果显示,与正常组比较,RRTI 模型组HMGB1、TLR4和p-NF-κB p65蛋白水平明显上调(P<0.05)。与RRTI模型组比较,玉屏风散对照治疗组以及益正方高、中、低剂量治疗组HMGB1、TLR4 和p-NFκB p65蛋白水平均明显下调(P<0.05)。与玉屏风散对照治疗组比较,益正方高剂量治疗组HMGB1、TLR4和p-NF-κB p65蛋白水平变化无统计学意义(P>0.05);益正方中、低剂量组HMGB1、TLR4和p-NF-κB p65蛋白水平均上调,且均呈益正方剂量依赖性(P<0.05)。
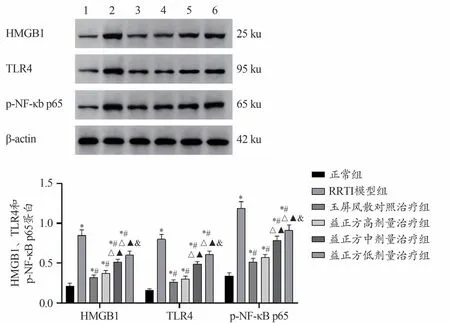
图3 Western blot检测HMGB1、TLR4和p-NF-κB p65蛋白表达情况
3 讨论与结论
历代中医学典籍中并无“RRTI”的明确记录,故将其归为“体虚感冒”、“虚症”等范畴。传统研究认为RRTI 以“肺脾气虚”为主,故治疗当以益气、健和补肺为主[8]。因此本研究通过疲劳结合饮食失节法和刨花加烟叶烟熏法诱导脾气虚证和肺气虚证的RRTI 大鼠模型,以探究益正方对RRTI的疗效。
3.1 益正方改善RRTI 模型大鼠的肺功能和炎症反应
益正方是一种中草药配方,其中黄芪具有益气、扶正的功效;茯苓则在健脾、润肺等方面有显著疗效;西洋参则在保肺机制中颇有研究[11-13]。此外,益正方已被证实是改善RRTI 的有效方剂,然而其具体机制仍不清楚。因此,本研究试图探究益正方缓解RRTI的作用机制。于是,经研究发现,益正方治疗可明显改善RRTI 模型大鼠的肺功能。与以往研究结果一致[6]。此外,肺损伤的过程中伴随着以炎症细胞浸润的急性炎症[14-15],如项忆瑾等[16]研究表明,小续命汤可能通过抑制炎症反应改善急性肺损伤,故而可推测持续性的肺部炎症也是判断RRTI 的关键指标。据报道,TNF-β、IL-6 是主要的促炎因子,在炎症性疾病中高表达,而IL-10 在炎症反应中主要发挥抗炎因子的作用[17-18]。结合本研究结果证实,益正方治疗可通过调控上述炎性因子的表达水平显著降低RRTI 模型大鼠的炎症反应。同时,进一步的研究显示,益正方治疗后可明显改善RRTI 模型大鼠病理学肺损伤和细胞凋亡情况得。以上结果表明,益正方可通过降低炎症反应、感染病理损伤、抑制细胞凋亡进而对RRTI 模型大鼠发挥保护作用。然而,益正方是如何发挥保护作用的分子机制尚不清楚。
3.2 益正方抑制细胞焦亡缓解RRTI大鼠肺损伤
既往研究表明,阻断细胞焦亡可对脂多糖诱导的肺损伤发挥保护作用[19-20]。Liu 等[21]报道显示,减少氧化应激和抑制MLRP3 炎症小体介导的焦亡可明显缓解脂多糖诱导的急性肺损伤。并且已知细胞焦亡是一种程序性细胞死亡的炎症形式。依次推测益正方在治疗RRTI中可能与细胞焦亡有关。于是,本研究进一步探究了参与焦亡的IL-1β、Caspase-1和GSDMD蛋白表达情况来探究细胞焦亡是否参与此过程。据报道,细胞焦亡具有不同于其他类型细胞死亡的独特形态和机制,其中Caspase-1 是一种白细胞介素1 转换酶,可通过蛋白水解切割炎性细胞因子的前体,如IL-1β,以及焦化诱导剂GSDMD;裂解的GSDMD 形成膜孔,导致细胞因子释放和细胞焦亡[22-23]。结果显示,RRTI模型大鼠中IL-1β、Caspase-1 和GSDMD 蛋白表达明显升高,提示RRTI 诱导细胞焦亡;而使用益正方干预后可通过降低上述焦亡相关蛋白的表达进而明显抑制细胞焦亡。以上数据证实,益正方通过抑制细胞焦亡减轻RRTI 大鼠肺损伤。然而,益正方抑制细胞焦亡的机制仍不清楚。
3.3 益正方抑制HMGB1/TLR4/NF-κB 通路对RRTI大鼠发挥保护作用
以往研究报告表明,炎症增强了核膜的通透性,使核HMGB1 蛋白能够到达细胞质,敲低HMGB1 可通过减少气道平滑肌厚度、胶原沉积、粘液分泌和气道炎症来降低呼吸道相关疾病的严重程度。TLR4 蛋白可充当HMGB1 的受体之一,参与免疫细胞反应和炎症,其在肺中的过度表达通过NF-κB 磷酸化来增加炎症相关介质的表达(如IL-6 等)进而参与调控气道炎症性疾病[24-25]。研究显示,吴茱萸碱治疗可通过下调HMGB1/TLR4/NF-κB 减轻哮喘大鼠肺组织炎症和气道重塑[10]。本研究结果与之相似,益正方治疗后可明显抑制RRTI大鼠中HMGB1、TLR4、NF-κB 蛋白表达。结合以往研究表明,益正方通过抑制HMGB1/TLR4/NF-κB通路对RRTI大鼠发挥保护作用。
综上,益正方通过缓解病理性损伤、抑制炎症反应和削弱细胞焦亡提高RRTI 大鼠肺功能,其机制可能与抑制HMGB1/TLR4/NF-κB 通路有关。本研究为益正方的临床用药提供了参考。然而,本研究并未深入探究HMGB1/TLR4/NF-κB 通路是如何参与益正方的对RRTI 大鼠的疗效改善的过程;此外并未探究是否还有其他的通路参与此过程,后续仍需继续探索。
