N7-甲基鸟苷(m7G)在肝细胞癌中的作用机制
2023-12-18江晶晶陈玉春于晓辉张久聪郑晓凤
高 春, 江晶晶, 陈玉春, 于晓辉, 张久聪, 郑晓凤
1 甘肃中医药大学第一临床医学院, 兰州 730000; 2 中国人民解放军联勤保障部队第九四〇医院消化内科, 兰州 730050; 3 兰州大学第二医院消化内科, 兰州 730030
肝癌是癌症相关死亡的主要原因,肝细胞癌(HCC)约占肝癌相关死亡的90%[1],手术切除、消融治疗、经动脉化疗栓塞、免疫治疗和全身化疗药物已经用于早期至晚期HCC 的治疗[2]。尽管近年来HCC的治疗已经取得了一些进展,但由于其发病机制的高度复杂性和靶点的单一性,使得患者的预后仍然相对较差[3]。此外,生物分子研究的最新进展在疾病分子机制、诊断生物标志物和预后生物标志物的鉴定中起重要作用。然而,目前还没有确定的可以预测治疗效果的生物标志物。因此,寻找有效的生物标志物可以帮助临床医生为患者制订精准的治疗方案。
由于高通量测序技术的不断发展,已发现转录后修饰在多种生理和病理过程中发挥着关键作用。迄今为止,已经在不同分子中发现了170 多种类型的RNA修饰,包括信使RNA(mRNA)、核糖体RNA(rRNA)、转移RNA(tRNA)和长链非编码RNA(lncRNA)[4-5]。N7-甲基鸟苷(N7-methylguanosine,m7G)修饰是最常见的RNA修饰之一,通常位于真核细胞mRNA的5′帽和内部区域,或所有物种的rRNA 和tRNA 内部区域,且是一种带正电荷的RNA 修饰[6-8]。先前的研究[9]表明,有100 多个基因与m7G 甲基化及其位点相关。此外,文献[10-12]报道m7G 甲基化修饰与部分癌症发展密切相关,并参与多种癌症相关的生物学活动,但m7G甲基化与HCC发生发展的具体机制尚未阐明。因此,本文就m7G 甲基化修饰在HCC 发病机制中的潜在作用及与m7G 相关的诊断技术和治疗策略进行简要综述,为深入研究HCC的分子机制及治疗提供新的理论支持。
1 m7G概述
tRNA 是蛋白质翻译的衔接分子,用于识别mRNA密码子并产生相应的氨基酸。tRNA 的修饰对tRNA稳定性、密码子识别和有效的蛋白质合成至关重要,研究[13]表明tRNA 修饰的失调与线粒体疾病、神经系统疾病和癌症的发展密切相关。m7G 是位于tRNA 可变环中第46 位核苷酸上的最常见的一种高度保守的tRNA 修饰,存在于原核生物、真核生物以及一些古细菌中,可促进细胞周期调控和致癌mRNA 的翻译,并最终推动细胞转化和癌症进展[12]。m7G tRNA 修饰由酵母中的Trm8p/Trm82p 异二聚体复合物和人类中相应的邻位甲基转移酶样蛋白1(methyltransferase-like 1,METTL1)和WD 重 复 结 构 域4(WD repeat domain 4,WDR4)蛋白催化(图1)[14]。m7G tRNA 修饰在酵母中是一种不必要的修饰,但在哺乳动物中,它决定着受损的干细胞的命运,并且与发育畸形等疾病密切相关。在人类中,编码WDR4 的突变导致tRNA m7G 修饰受损,并导致一种以面部畸形、脑畸形、大脑发育异常,以及伴有癫痫发作的严重脑病[15-17]。位于人类染色体21q22.3的WDR4也是一些唐氏综合征表型的候选基因,包括由人类患者染色体区域三体性导致的智力低下[18]。这表明与酵母相比,m7G tRNA 修饰在哺乳动物中可能具有更重要的生理功能。此外,据报道[19]在生长因子刺激下,METTL1 受蛋白激酶B 和核糖体S6激酶调节,并影响癌症细胞的存活率和对5-氟尿嘧啶的敏感性。这与Liu 等[20]、Okamoto 等[21]的研究结果类似,METTL1在癌症组织中上调,并可调节5-氟尿嘧啶的敏感性。然而,尚未在哺乳动物中检测到m7G tRNA 修饰的全部程度,并且由于METTL1/WDR4缺陷介导的缺陷m7G tRNA 修饰所导致的不良发育后果或相关疾病的分子和细胞机制尚不明确。
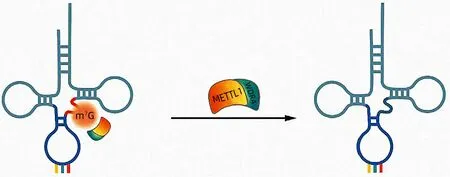
图1 m7G的结构及修饰Figure 1 Structure and modification of m7G
此外,Pandolfini 等[22]发现,由METTL1/WDR4 复合物介导的m7G 也可以发生于miRNA,进而调节miRNA 结构并促进细胞迁移。Zhang 等[23]通过对哺乳动物mRNA 内部m7G 位点进行m7G MeRIP 测序后,发现m7G 甲基化可能影响mRNA 翻译。同时,Zhao等[24]也证明了m7G 在mRNA 中的作用,该研究发现METTL1是导致缺血组织mRNA 内m7G 减少的主要潜在原因,并通过促进VEGFA mRNA 翻译以促进缺血后血管生成。
2 m7G检测方法
自m7G 首次被发现以来,众多国内外学者认为m7G 在生物学过程中起着至关重要的调节作用,但具体的调控机制尚不明朗[25]。此外,由于m7G 不影响Watson-Crick 碱基杂交,且在RNA 中相对含量较低,准确灵敏地检测m7G 存在一定困难。因此,寻找一种高效的m7G 检测方法迫在眉睫。目前检测m7G 甲基化的方法包括定量检测和位点检测。最先用于甲基化测序的检测方法是高效液相色谱法、液相色谱-串联质谱,它们通过核苷的极性不同,使用UV、质谱分离得到的核苷进行检测[26]。基于液相色谱-串联质谱的液相色谱-电喷雾电离串联质谱法具有高度特异性和极高的灵敏度,检测限值为0.2 fmol[27]。虽然这些方法可实现m7G tRNA 定量检测,但成本均较昂贵且操作不当易出现假阴性或假阳性结果。
随着高通量测序的出现,对m7G 进行位点的检测成为了可能[28],目前相关检测方法包括m7G MeRIP seq、m7G seq 和m7G miCLIP seq 技 术。传 统 的m7G MeRIP seq 方法依赖于抗体免疫沉淀,分辨率有限(~80 bp)[29]。基于逆转录终止,m7G seq 在检测人mRNA和tRNA中的m7G修饰时实现了碱基解析(图2)。Zhang 等[23]研发的m7G seq 可以在没有抗体富集的情况下,在人类细胞中以单核苷酸分辨率实现内部m7G的转录组范围映射。同时,他们在METTL1 敲除细胞中进行了m7G seq,并证实了METTL1 的tRNA m7G 甲基化功能。这种新方法使人们能够以高特异性和保真度绘制内部m7G 修饰的精确位置和序列基序,但会影响单个m7G 位点修饰水平的准确检测,因为只有一部分位点转化为可以被检测到的碱性位点。Lin等[30]使用了m7G seq 和tRNA 还原和切割测序(TRAC seq),以揭示小鼠胚胎干细胞中的m7G tRNA甲基化,最终发现Mettl1敲除的小鼠胚胎干细胞中相应密码子的核糖体表达增加。m7G seq 和TRAC seq 在m7G 甲基化的检测中具有高度特异性,因为这两种方法可以增加m7G的位点特异性切割分数,使研究者能够以单核苷酸分辨率识别tRNA 中的全局m7G 修饰。新的m7G miCLIP seq在通过修改的miCLIP方案绘制m7G修饰图中具有更高的灵敏度和特异度[7],但是该方法的应用还有待继续探索。
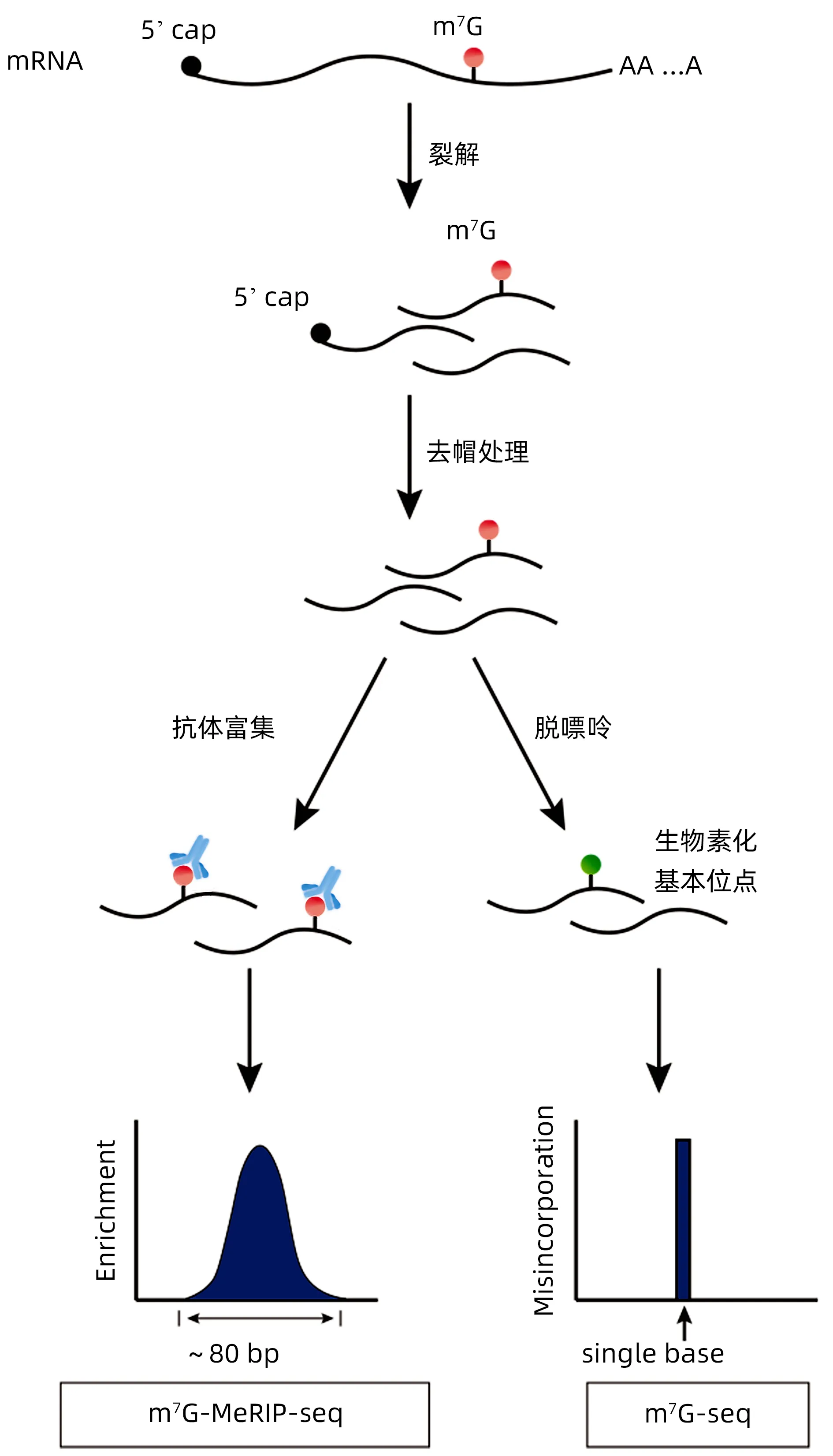
图2 m7G MeRIP seq、m7G seq检测技术的比较Figure 2 Comparison of m7G MeRIP seq and m7G seq detection techniques
3 m7G与HCC
3.1 METTL1/WDR4 复合物与HCC 相关 HCC 为全球第六大最流行的肿瘤,每年约有84.1万例新发病例和78.2 万 例 死 亡 病 例[31]。然 而,METTL1 和m7G tRNA 修饰在HCC 发生发展中的确切作用和调节机制仍不清楚。但m7G 为HCC 不明确的分子机制提供了新的线索,并可能指导新的治疗策略。一些研究基于公共数据库中的数据分析了METTL1和WDR4的表达水平,并报告了与正常肝组织相比,在HCC 样本中表达上调。Chen等[32]发现,在组织层面上,m7G tRNA修饰及其催化酶METTL1/WDR4 复合物在HCC 中升高,并与HCC患者生存率呈负相关。在细胞层面上,沉默METTL1 或WDR4 可以抑制HCC 细胞增殖、迁移和侵袭,而强制性表达野生型METTL1 可催化死亡突变体的形成,进而促进HCC 进展。这可能是因为METTL1介导的m7G 修饰增强了mRNA 翻译,并在体内外加速了HCC 的发生和进展,而METTL1 的敲除可使mRNA的翻译降低[10]。这表明靶向METTL1 和调节不当的tRNA 修饰可能是HCC 治疗的一种有前途的策略。Xia 等[33]首 次 发 现MYC/WDR4/CCNB1 信 号 通 路 在HCC 侵袭迁移中具有一定地位。转录调节因子MYC可以激活WDR4 转录,WDR4 通过促进真核翻译起始因子1A 与CCNB1 mRNA 的结合来增强CCNB1 翻译,而WDR4本身也受MYC 的调节。CCNB1通过促进P3泛素化影响HCC 中的PI53K 和AKT 磷酸化并降低P53 蛋白表达。此外,WDR4 通过诱导细胞向G2/M 周期转变和抑制细胞凋亡以减少HCC 细胞的凋亡。因此,WDR4 可作为HCC 发生和进展中的肿瘤启动子,可 能 作 为HCC 的 候 选 治 疗 靶 点。Tian 等[34]发 现METTL1 在HCC 中显著上调,并通过PTEN/AKT 信号通路表现出致癌活性。PTEN 在METTL1 低表达的患者中被激活,PTEN 的异位表达或AKT 活性的抑制可以显著减弱METTL1 介导的恶性表型。在临床样本中,METTL1 表达与PTEN 表达相反。METTL1 低表达和PTEN 高表达同时发生与总生存期延长显著相关,而单独表达METTL1 或PTEN 更与不良总生存期相关。这就提示靶向METTL1/PTEN 信号轴可能在HCC的治疗中具有潜在作用。
3.2 METTL1 介导的Arg-TCT-tRNA m7G 修饰与HCC相关 目前,关于METTL1 在癌症中的整体相关性基本未知。但研究发现,METTL1/WDR4在HCC中负性介导m7G tRNA的密码子依赖性核糖体停滞。METTL1功能增强导致m7G tRNA 修饰的增加,进而引起tRNA 亚群的丰度增加,包括Arg-TCT-4-1(5个负责解码AGA密码子的同解码器tRNA 之一),以及富含AGA 密码的mRNA(包括与细胞周期相关的密码子)的翻译相应增加。报告[35]分析表明,METTL1 或Arg-TCT-4-1 的过表达促进富含AGA 密码子的转录物的表达。这说明tRNA-Arg-TCT-4-1 上调表型复制METTL1/WDR4 过表达表型,并导致恶性转化和致癌。这与Dai 等[36]的研究结果一致,两者都表明细胞周期进展mRNA(如Cdk4)和某些致癌mRNA(例如Hmga2、Ash2l、Setdb1、Ube2t)富含与Arg-TCT-4-1 同源tRNA 相对应的AGA 密码子,因此其翻译增加(图3)。此外,Orellana等[35]研究表明,在没有增加METTL1/WDR4 活性或水平的情况下,仅仅过度表达m7G-tRNA Arg-TCT-4-1,就会出现METTL1/WDR4 过度表达现象,并且本身就是恶性转化。这些发现增加了一个重要的新概念,即翻译调控作为驱动因素而不仅仅是肿瘤发生的参与者,并且这一过程极为复杂且经常被低估。
4 前景与挑战
m7G 修饰在各种肿瘤中的作用已被广泛探讨[37]。METTL1/WDR4 作为m7G 修饰的最核心调节因子在HCC 中发挥重要作用,在临床诊断和治疗中显示出巨大潜力。据报道,METTL1和WDR4还与免疫抑制肿瘤微环境相关,并参与调节各种免疫细胞的浸润和癌症细胞与肿瘤细胞或免疫细胞之间的促肿瘤相互作用,这可能为未来的免疫治疗方法提供潜在的思路[38]。Huang 等[39]认为,METTL1 和WDR4 的上调可促进HCC 中仑伐替尼的耐药性,并赋予对METTL1 靶向的敏感性,从而为解决化疗药物耐药这一临床难题提供了一种有希望的理论依据。此外,通过转录后编辑靶向调节失调的METTL1/WDR4 或功能失调的m7G 位点可能是治愈HCC的一种潜在方法,并且可以与化疗或免疫疗法相结合,以在未来获得更好的治疗效果。但是迄今为止,尚未报道METTL1/WDR4 抑制剂或潜在的m7G 相关转录后编辑系统。与其他RNA 修饰类似,m7G 调节因子的小分子抑制剂可能是最有前途和最有效的肿瘤治疗方法。因此,有必要对ETTL1、WDR4 两种酶的详细结构进行探讨,为更早地研发有效的靶向药物做准备。
5 小结与展望
m7G 甲基化是RNA 修饰研究中的一个新兴热点,目前已被证明参与多种细胞过程,并与mRNA、tRNA和rRNA 的失调密切相关。尽管与m7G 相关的研究仍处于初步阶段,但现有的研究足以表明m7G在HCC发展过程中的关键作用。m7G 甲基转移酶METTL1 和WDR4 的功能是在靶向RNA 中的特定位置安装m7G修饰,从而影响RNA 分子(包括mRNA、miRNA 和rRNA)的生产、结构和成熟,最终调节翻译过程。目前有研究表明m7G 修饰的相关基因在HCC 中异常表达,可能作为诊断和预后预测的新生物标志物。因此,靶向m7G tRNA 修饰有望成为治疗HCC 患者的一种有前景的策略。目前,对于m7G 修饰这一复杂过程仍然具有太多的未知性和不确定性,尤其在HCC 中m7G 和其他转录后修饰是否存在相互协同或者拮抗影响等更多作用,有必要进一步研究以更全面地阐明m7G修饰在HCC中的分子机制。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明:高春负责论文撰写与修改;江晶晶、陈玉春等负责论文修改和审阅;郑晓凤负责数据收集;张久聪、于晓辉等负责拟定写作思路,指导撰写文章并最后定稿。
