急性胰腺炎机器学习模型的研究进展
2023-12-18殷民月朱锦舟高静雯林嘉希许春芳
殷民月, 朱锦舟, 刘 璐, 高静雯, 林嘉希, 许春芳
苏州大学附属第一医院消化内科, 江苏 苏州 215000
急性胰腺炎(acute pancreatitis,AP)作为一种常见的、需要住院治疗的消化系统疾病,其发病率逐年升高,根据全球疾病负担研究数据库统计,2019 年全球范围内胰腺炎发病率约为36.38/10 万,死亡率约为1.49/10 万[1]。根据2012 年修订版的亚特兰大分类标准,大部分AP 呈自限性,称为轻症AP(mild acute pancreatitis,MAP),约20%的AP 患者可进展为中度重症AP(moderate severe acute pancreatitis,MSAP)和重症AP(severe acute pancreatitis,SAP)。MSAP定义为一过性(≤48 h)器官衰竭或局部并发症,包括急性胰周液体积聚、胰腺假性囊肿、急性坏死物积聚等,或全身并发症,包括脓毒症、急性呼吸窘迫综合征、腹腔内高压等。SAP定义为持续性(>48 h)器官衰竭,包括呼吸、心血管、肾脏等器官衰竭[2]。研究[3]表明,相较于MAP,MSAP 和SAP病死率可高出十倍左右。因此,早期(<24 h)评估严重程度、识别预后相关高危因素将影响胰腺炎患者的病情进展、重症监护管理、多学科会诊等干预时机和处理措施,但是,这在临床上面临较大挑战。
传统评分系统(如APACHE-Ⅱ、Ranson、BISAP 评分)通过结合临床特征(年龄、昏迷状态等)和实验室检查(如谷丙转氨酶、空腹血糖水平等),预测AP 严重程度[4]。随后又出现基于CT影像特征的CTSI、MCTSI评分,范围0~10 分,≥4 分提示MSAP 或SAP[5]。近年来,也有研究[6]提出了一些新型评分系统,如PASS,这是依据患者腹痛症状、器官衰竭、全身炎症反应综合征、阿片类药物需求以及口服耐受性五个指标来动态监测胰腺炎患者不同阶段的临床反应,通过了基于德尔菲法的专家共识。这些评分系统虽在临床上得到很多应用,但仍存在一些局限性。传统评分系统如APACHE-Ⅱ评分涉及复杂参数、测量难度较大,如Ranson 评分需要测量入院后24 h和48 h的临床变量,实现不了动态评估;基于CT 影像特征评分与放射科医生的经验水平相关,准确性波动较大;PASS 评分所需指标并不适用于所有医院,泛化能力较低。
作为人工智能的分支之一,机器学习凭借其强大的计算能力和学习能力被广泛应用于医学领域。研究[7-10]表明,机器学习在构建医学模型方面取得了显著成就,包括疾病诊断、临床预后、生存分析等。本文就近年来AP 机器学习模型的研究进展进行综述,主要阐述机器学习在预测AP 严重程度、并发症、死亡等方面的应用,为人工智能协助AP 临床诊疗的进一步应用提供理论依据和新思路。
1 机器学习在AP中的应用现状
机器学习是计算机模拟人类大脑进行数据学习的一门科学技术,它能够从已知的大量且复杂数据中学习并总结规律,从而预测未知的结果或趋势。机器学习主要包括监督学习、无监督学习。监督学习的目标是预测一个已知的输出,如心电图的自动解读、肺结节的自动识别等,监督学习的特点是使机器学习的表现无限接近甚至超越训练有素的医生的表现。无监督学习则相反,它没有可以预测的输出,而是尝试在海量数据中找到自然而然的分类模式,这种学习方式往往会获得识别新疾病机制的机会[11]。例如,有研究[12]发现淋巴细胞减少是抗MDA5阳性皮肌炎患者预后的独立预测因子,并利用无监督学习归纳出了淋巴细胞减少程度与疾病严重程度和疾病预后的相关性,为临床医生理解抗MDA5阳性皮肌炎疾病的临床特点和表型提供可靠依据,有助于该病的诊疗及管理。
机器学习的基本步骤包括:(1)数据准备:预测结局以及一系列与该结局存在潜在关系的变量;(2)数据预处理:对原始数据进行清洗、转换、离散、归约等处理,以确保数据的完整性和规范化;随后将数据随机划分为训练集、验证集和测试集;(3)模型选择:根据既定任务,选择对应模型,例如分类任务,可选择回归模型;(4)模型训练:模型基于训练集数据进行训练,学习规律;(5)参数调整:根据模型在验证集上的性能,选择适当的参数调整,以进一步提升模型的表现;(6)模型评估:训练及调整好的模型在测试集上进行性能评估,主要指标包括敏感度、特异度、召回率、精确度、F1 值等;(7)模型预测:将模型运用到新的任务中,呈现预测结果。
目前,机器学习在AP 中应用广泛,监督学习任务主要包括预测严重程度、并发症和死亡,无监督学习任务主要为识别炎症因子表型。具体特点见表1。
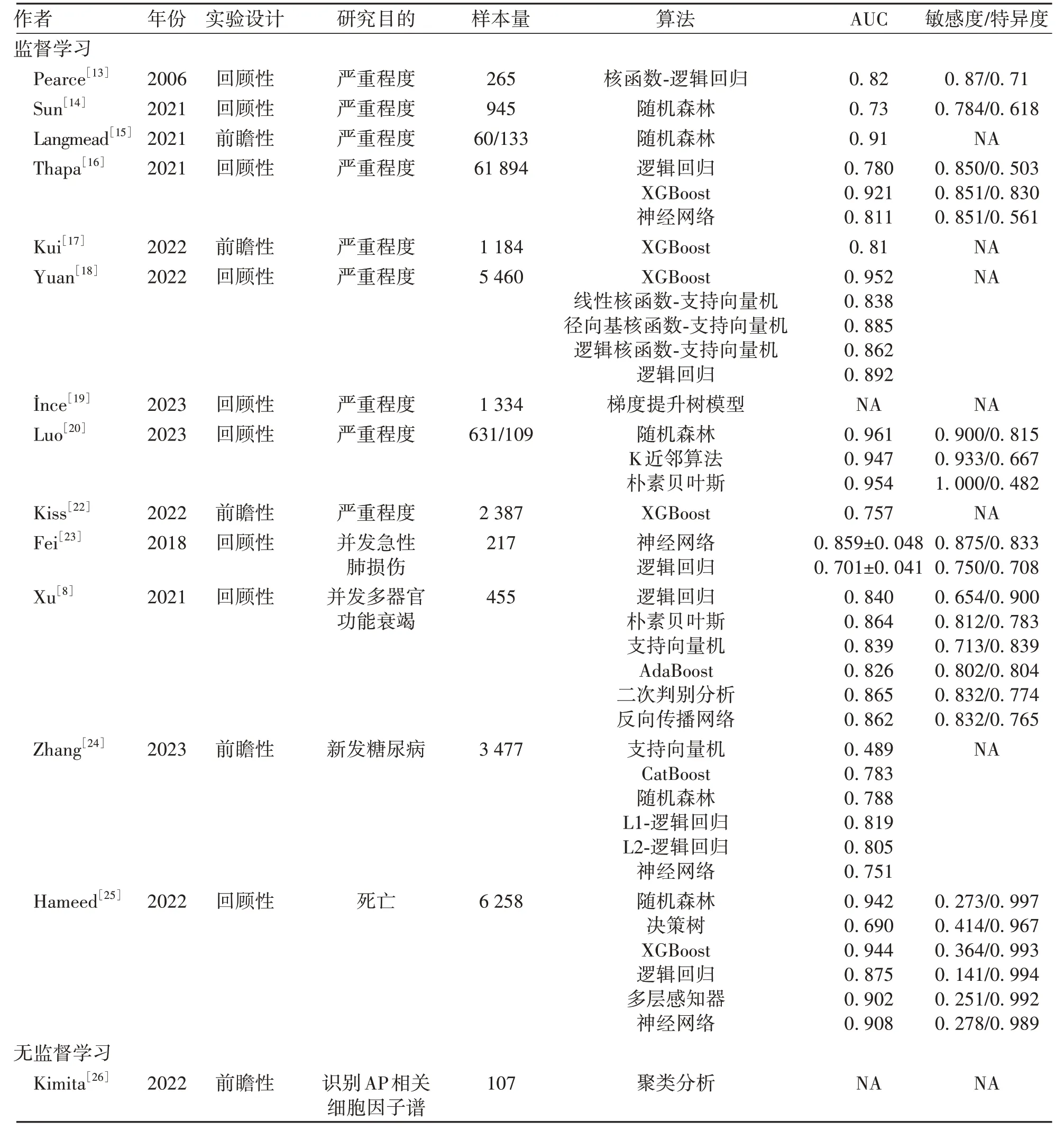
表1 机器学习在AP中应用研究的基本特点Table 1 Characteristics of studies on application of machine learning in acute pancreatitis
1.1 监督学习
1.1.1 预测AP 严重程度 Pearce 团队[13]在2006 年首次利用机器学习基于APACHE-Ⅱ评分和C反应蛋白指标建模以提升SAP预测性能,他们在逻辑回归基础上引入核函数,以去除冗余特征、识别相关特征,最终模型的AUC 为0.82,敏感度为0.87,特异度为0.71,优于传统评分系统APACHE-Ⅱ评分(AUC=0.74)。Sun等[14]开发了APSAVE 模型对AP 患者进行风险分层,通过随机森林算法对92个临床变量(包括65个静脉血结果、17个动脉血结果和9个尿检结果)进行分析,最后得出AUC 为0.73,此外,APSAVE 联合Ranson 评分可以提高模型性能至0.79。Langmead 等[15]发现新的细胞因子谱(由5 个细胞因子组成)能准确预测AP 患者持续性器官衰竭,并且在独立的、前瞻的133个患者队列里验证其性能,该作者通过随机森林算法建模,模型AUC 为0.91,准确性为0.89,阳性预测值为0.89,阴性预测值为0.90。
近年来,随着机器学习在医学领域发挥的显著作用,越来越多的算法被开发,医学研究者不再局限于个别算法,而是比较多种算法寻求最优解,同时探索新的算法来扩增样本从而解决真实世界中样本量小、数据质量差、分类不平衡的问题。Thapa 团队[16]回顾性分析61 894例AP患者入院12 h内的临床指标,利用逻辑回归、XGBoost 和神经网络算法训练模型,得出三个模型的AUC分别为0.780、0.921和0.811,经典评分系 统BISAP 和HAPS 评 分 的AUC 为0.682 和0.533。Kui等[17]设计了一个基于XGBoost 算法的简易版应用程序,以早期识别SAP 高危患者,该研究是一项多中心、多国家、前瞻性的观察性研究,该模型纳入的六个重要变量包括性别、年龄、体温、呼吸频率、腹肌反射和血糖水平,预测准确性达89.1%,平均AUC 为0.81。Yuan 团队[18]通过对5 460 例AP 患者的临床数据进行分析,采用五种机器学习算法,包括XGBoost、三种不同核的支持向量机以及逻辑回归算法,结果提示基于XGBoost 算法的模型在外部测试集上获得最高的AUC,该模型包括年龄、合并症、神志状态、肺部浸润、降钙素原、中性粒细胞百分比、谷丙转氨酶/谷草转氨酶、白蛋白/球蛋白、胆碱酯酶、尿素、血糖、谷草转氨酶和血清总胆固醇。土耳其有项研究[19]基于梯度提升算法回顾性分析1 334 例AP 患者的临床变量和CTSI 评分,并采用上采样方法增加训练集中的小分类样本,预测AP严重程度,结果提示联合CTSI评分可提升模型准确性。Luo 等[20]利用五种机器学习算法(随机森林、K 近邻算法、朴素贝叶斯、神经网络和分类树)构建SAP 的预测模型,并与经典评分系统(BISAP、Ranson 和GCS 评分)进行比较,结果表明,基于随机森林算法的模型性能最佳,其AUC达0.961。
研究[21]表明,10%~20%的AP 容易进展为急性坏死性胰腺炎,从而进一步增加病死率(约15%),当合并感染时,病死率增加至少2 倍,可达30%~39%。Kiss等[22]利用XGBoost算法基于血糖、C反应蛋白、性别、白细胞等临床变量预测急性坏死性胰腺炎,经过交叉验证之后,AUC 达0.757,且随着样本量的增加,AUC也不断提高。
1.1.2 预测AP 并发症 多器官功能衰竭同样会增加AP 患者的病死率,呼吸系统、心血管系统和肾脏系统最容易发生衰竭。Fei团队[23]利用神经网络和逻辑回归算法对217 例SAP 患者建模,评估SAP 并发急性肺损伤风险,两种模型的AUC 分别为0.859±0.048 和0.701±0.041。Xu 等[8]开展了一项多中心、回顾性研究,利用六种机器学习算法(逻辑回归、朴素贝叶斯、支持向量机、AdaBoost、二次判别分析和反向传播网络)预测MSAP 和SAP 患者的多器官功能衰竭,最终AdaBoost模型性能最佳(AUC=0.826)。
研究表明,AP 后新发糖尿病的风险相较于无AP患者高2 倍以上。Zhang 等[24]利用一系列机器学习算法建模以预测AP 后糖尿病的发生,包括支持向量机、CatBoost、随机森林、逻辑回归、神经网络,结果表明,逻辑回归模型获得最高的AUC(0.819)和F1值(0.357)。
1.1.3 预测AP 死亡 临床上关于AP 患者死亡预测模型的研究有限,主要原因包括:(1)样本量小,数据质量差;(2)分类不均衡。Hameed等[25]通过扩增三个公开数据库(MIMIC-Ⅲ、MIMIC-Ⅳ、EICU)中AP 患者的数据,并通过上采样、下采样等方式平衡分类(生存和死亡),最终利用随机森林、决策树、XGBoost、逻辑回归、多层感知器和深度神经网络算法预测死亡,结果表明经扩增后,基于MIMIC-Ⅲ所得到的最高AUC是0.748(基于多层感知器),基于MIMIC-Ⅳ的最高AUC为0.958(基于深度神经网络),基于EICU的最高AUC 为0.702(基于深度神经网络),基于三个数据集的最高AUC为0.944(基于XGBoost)。
1.2 无监督学习 AP 的特征之一是细胞因子风暴,其通过诱发全身炎症反应综合征导致胰腺和其他器官功能障碍甚至衰竭。针对这一现象,Kimita 等[26]首先利用随机森林区分AP患者和健康人群的细胞因子/趋化因子,两组人群中共22 个细胞因子/趋化因子存在显著差异。接着,基于这22 个细胞因子/趋化因子对胰腺炎患者进行聚类分析,结果分为2类,其中1类含75例患者,2类含32例患者。与1类患者相比,2类患者的抑胃肽(P=0.001)、多肽YY(P=0.017)、胃饥饿素(P=0.014)、胰岛素(P=0.001)水平显著升高,而铁调素(P=0.016)水平显著降低。这一发现有助于对胰腺炎患者进行早期风险分层,给予靶向抗炎药物和诊疗方案,实现精准医疗。
无监督学习应用于AP 的研究非常有限,但上述研究揭示了无监督学习可观的、潜在的临床意义,值得进一步探究。
2 深度学习在AP中的应用前景
近年来,随着人工智能的快速发展,深度学习在医学领域的应用愈发广泛,尤其是计算机视觉领域,主要包括分类[27-29]、目标检测[30-32]和语义分割[33-35]等任务。性能最佳、应用最广泛的深度学习框架为卷积神经网络,类似人类大脑神经网络的架构,基于图像和图像相应结局成对形式的数据集进行训练,充分且深层地学习影像特征,并不断迭代更新,缩小误差,属于监督学习范畴[36]。Tong 等[37]基于超声增强图像鉴别胰腺导管腺癌和慢性胰腺炎,首先由放射科医生单独诊断,然后利用ResNet框架提取深度特征构建模型,让放射科医生根据模型结果再次诊断,最后比较前后两次诊断的准确性,结果表明,模型性能优于第一次放射科医生诊断,并且在模型的帮助下,放射科医生的诊断敏感度和特异度都得到明显改善。Chen 等[38]归纳了人工智能(深度学习和影像组学)在胰腺疾病中的应用,包括胰腺癌检测、胰腺病变鉴别、胰腺癌预后和治疗效果以及胰腺神经内分泌瘤和囊性病变的诊断,反映了人工智能在医学影像中的良好前景。
因此,深度学习凭借其基于特定任务自动学习自适应特征的能力以及丰富复杂的超参数,能反映更高阶的成像模式,并捕获更多的成像异质性。而目前关于深度学习在AP 中的研究有限,这一研究方向具有一定的探索意义和临床价值。
3 多模态模型在AP中的应用前景
现代化医疗信息常依赖多种模态的信息数据,包括图像像素信息、结构化实验室检查、非结构化叙述性文本和语音信息等[39],多模态信息的整合有利于临床医生做出全面的鉴别诊断,指导临床诊治工作,对医疗行业的发展至关重要。
随着机器学习和深度学习的快速发展,多模态融合的理念已取得初步成效[40-43]。Wang 等[44]将临床变量和影像组学特征结合起来,构建了一个列线图以预测接受立体定向治疗的肝细胞癌患者的总生存期,结果表明该列线图的性能优于单独临床模型和单独影像组学模型(C 指数:0.76~0.84 vs 0.72~0.75 vs 0.66~0.77)。Huang 等[45]在预测胰腺神经内分泌瘤的疾病进展任务中,分别基于超声增强图像、临床变量以及两者结合的特征构建多因素逻辑回归模型,结果表明,多模态模型效果优于单独的深度学习模型和临床模型(AUC:0.85 vs 0.81 vs 0.78)。
综上,多模态融合可以提升模型的性能,从复杂、海量的数据中提取充分信息并排除冗余信息,以达到最佳的预测作用。但目前尚未有关于多模态模型在AP中应用的研究,这一研究方向值得深入探究。
4 结论
随着人工智能技术的发展,大多数基于临床变量的AP预测模型研究正在不断克服样本量小、分类不均衡、信息偏倚等问题,模型性能也因此不断提升。此外,在临床变量的基础上,加入影像组学和深度学习的应用,既符合真实世界临床诊疗数据多模态来源的特点,又能进一步提升模型性能,为临床决策提供更准确的帮助。但是,机器学习在AP中的应用仍存在一些局限性。首先,数据准备方面仍有提高空间,例如对于缺失值、异常值的清洗方式,对于不平衡数据集的预处理方式,以及对于小样本多变量的共线性问题等,都需要被合理、科学地解决。其次,在模型部署方面尚有欠缺,大部分研究构建的模型未能实现日常应用,缺乏临床实践性。此外,需要开展多中心、前瞻性研究以解决部分数据异质性问题和提高模型泛化能力。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:殷民月、朱锦舟负责课题设计,撰写、修改论文;刘璐、高静雯、林嘉希参与文献检索与归纳;许春芳负责指导撰写文章并最后定稿。
