间充质干细胞及其外泌体治疗自身免疫性肝炎的研究进展
2023-12-18罗龙龙王丽菲卢利霞李初谊于晓辉张久聪
罗龙龙, 王丽菲, 郑 英, 李 斌, 卢利霞, 李初谊, 于晓辉, 张久聪
1 甘肃中医药大学第一临床医学院, 兰州 730000; 2 中国人民解放军联勤保障部队第九四〇医院消化内科, 兰州 730050
自身免疫性肝炎(AIH)主要表现为高球蛋白血症、自身抗体阳性和组织学上界面性肝炎及汇管区浆细胞浸润等[1]。随着人类生活环境的改变,诊疗水平的提高,以及生物制剂的广泛使用,AIH 发病率在全球范围呈逐年上升趋势,已成为继病毒性肝炎和代谢脂肪性肝病之后的第三大类肝病[2]。目前临床上主要采用激素类药物,同时辅以硫唑嘌呤等药物治疗,但其长期应用会引起严重的代谢综合征、骨质疏松、脊柱骨折等并发症,严重影响患者的生活质量。服用硫唑嘌呤的患者可表现为关节疼痛、发热、胃肠道不适等,最严重的可表现为骨髓毒性。二线药物适用于对一线治疗反应不佳或对糖皮质激素或硫唑嘌呤的副作用不耐受的AIH 患者,如吗替麦考酚酯、他克莫司均有较好疗效。这些药物不良反应有:神经反应(震颤,头痛),肾脏反应(高血压,肾功能不全)以及脱发等。另外,对于AIH 引起的急性肝衰竭,肝移植是一种有效的治疗方法,但其缺陷主要有供体缺乏、手术创伤大、费用高等[3]。
因此,AIH需要新的治疗措施,近年来间充质干细胞(mesenchymal stem cell,MSC)在AIH治疗中的潜在优势逐渐突显。有文献[4]报道MSC 可向肝脏迁移,分化为肝细胞,替代受损细胞进而恢复肝功能。MSC 还可通过其免疫调节功能促进肝细胞存活进而抑制炎症。MSC来源外泌体(mesenchymal stem cell-derived exosome,MSC-EXO)具有类似MSC 的功能,且具有更低的免疫原性、较长的循环半衰期、良好的渗透性和良好的生物相容性[5]。因此本文就MSC 和MSC-EXO 在自身免疫性肝炎中的研究进展作一综述,以期为AIH 的诊治提供新的思路。
1 MSC及其外泌体概述
1.1 MSC MSC 源自出生前胚胎发育阶段的中胚叶和外胚层,存在于多种组织器官,是一种可从骨髓、脂肪组织、牙髓、脐带和胎盘、外周血以及诱导的多能干细胞中分离得到的具有多向分化潜能的干细胞[6]。MSC 可以调节其局部环境、细胞通信和释放多种因子,并参与组织损伤的再生。此外,MSC 具有归巢能力,可以迁移到损伤部位,具有分化为损伤部位局部成分的能力[7],并能够分泌有助于组织再生的趋化因子、细胞因子和生长因子[8]。大量证据表明,MSC 可作用于自然杀伤细胞、树突状细胞、巨噬细胞、B 淋巴细胞和T 淋巴细胞,通过抑制激活,增殖和分化为效应细胞[9]。因为MSC具有自我复制、自我更新和无限繁殖的特性,并具有非常强大的免疫调控和再生的特征,被普遍应用到移植物抗宿主疾病、心血管疾病、肿瘤、骨关节炎、自身免疫性疾病、糖尿病和退行性疾病中[10]。
1.2 外泌体 外泌体是一种直径为40~160 nm的细胞外囊泡,富含DNA、RNA、脂质、蛋白质等生物活性物质,通过不同的信号通路调节细胞间通信。外泌体含有大量的膜联蛋白、四跨膜蛋白家族(如CD63、CD81 和CD9)和 热 休 克 蛋 白(如Hsp60、Hsp70 和Hsp90)[11]。外泌体由脂肪细胞、上皮细胞、星形胶质细胞等多种健康细胞产生和释放。此外,其还存在于脑脊液、滑膜、血液等多种体液中,在炎症、抗原呈递和细胞稳态等多种生物过程中发挥着重要作用[12]。
研究[13-14]表明,MSC-EXO 通过向受损细胞或组织传递信息参与组织再生,并发挥类似于MSC的生物活性。不同组织来源的MSC-EXO 具有不同的功能,如人脐带MSC-EXO 可以表达标志性蛋白CD9 及CD63,能够通过上调调节性T 淋巴细胞(Treg)和抑制辅助性T淋巴细胞(Th)17参与自身免疫功能调节[15]。骨髓MSC-EXO 通过Wnt/β-catenin 途径减少CCl4诱导的大鼠肝纤维化,促进肝细胞再生[16]。因此,可利用MSC-EXO 修复受损组织,调节免疫反应和发挥抗炎作用来治疗由免疫失衡介导的AIH,以及修复受损的肝细胞。
2 AIH的发病机制
AIH 的具体原因目前尚不明确,但其发生机制与其自身抗原呈递后的免疫活化和机体的免疫耐受被打破有关。
2.1 自身抗原呈递后的免疫活化 在AIH 期间,CD4+Th0在适当的共刺激信号存在的抗原呈递过程中被激活。一旦被激活,Th0通过微环境中存在的细胞因子和抗原可以分化成不同的Th细胞群。在IL-12存在的情况下,Th0 分化为Th1,而IL-4 丰富的环境则有利于分化为Th2。此外,TGF-β、IL-1 和IL-6 促进分化为Th17[17]。每个细胞亚群都释放细胞因子,通过一系列级联反应,最终导致对肝细胞的自身免疫攻击(图1)。
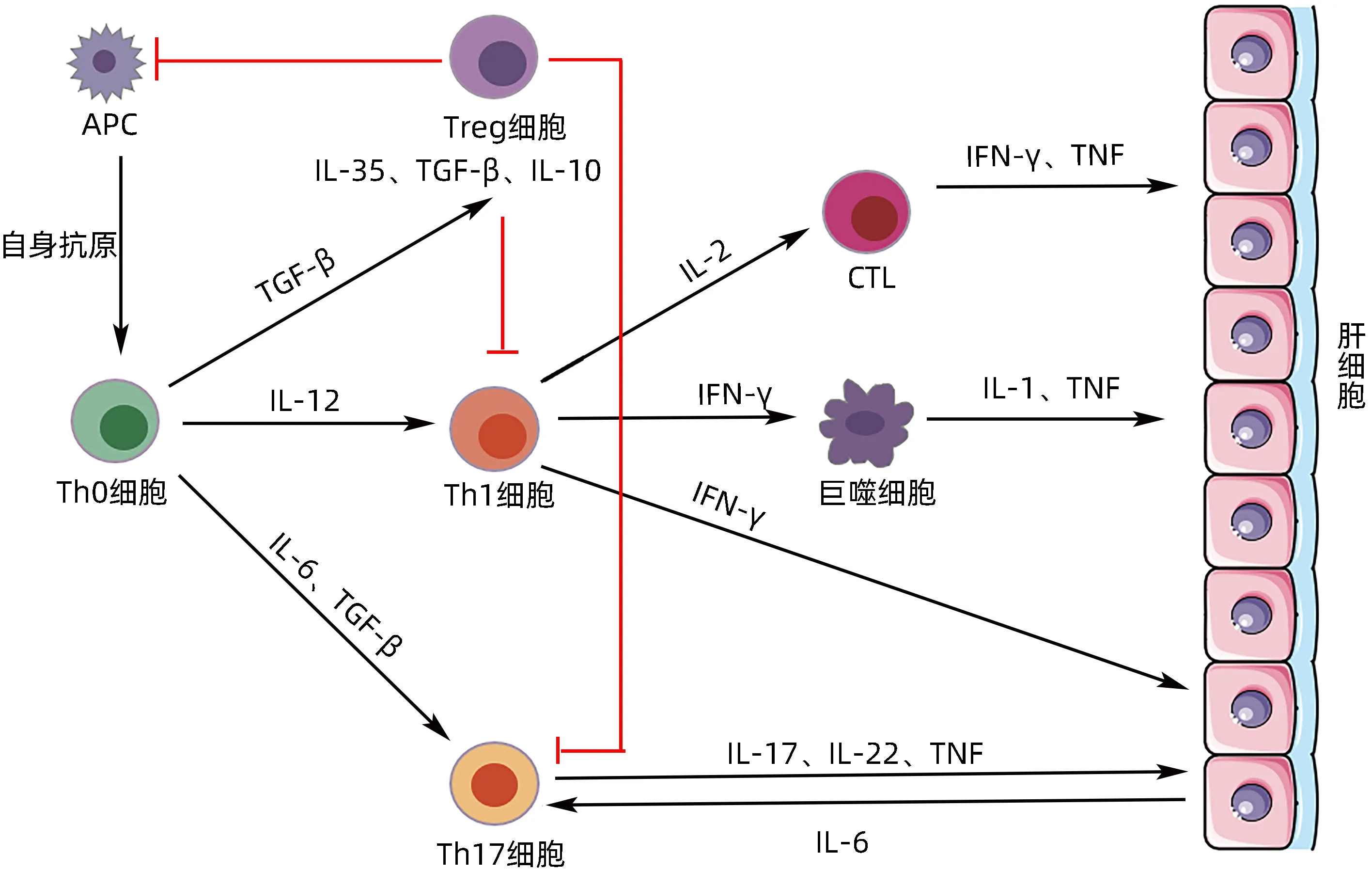
图1 AIH的发病机制Figure 1 The pathogenesis of AIH
分化的Th1 可产生IL-2 和IFN-γ,同时激活CTL,后者产生IFN-γ和TNF,肝细胞接触IFN-γ会导致主要组织相容性复合体(MHC)Ⅰ类分子和MHC Ⅱ类分子的异常表达,从而导致T 淋巴细胞的进一步激活和肝损伤[18]。Th2通过分泌细胞因子诱导B淋巴细胞成熟为浆细胞,而B 淋巴细胞又分泌自身抗体以抗体依赖的细胞毒补体依赖的方式攻击正常肝细胞,导致肝细胞死亡[19]。Th17 可产生促炎症细胞因子IL-17、IL-22和TNF 并诱导肝细胞分泌IL-6 来促进自身免疫[20]。但Th17在AIH中的其他作用仍在研究中。
2.2 免疫耐受被打破 自身免疫性疾病是由自我耐受机制的破坏所造成的。Treg在维持免疫耐受方面起着核心作用,并在自身免疫性疾病(包括AIH)中起着关键作用。Treg 作为免疫抑制细胞,通过分泌免疫抑制细胞因子,如IL-10、TGF-β和IL-35,以及颗粒酶和穿孔素,抑制CD4+T 淋巴细胞和CTL 介导的自身免疫反应[21]。Treg 的数量与疾病活动的标志物(如抗可溶性肝抗原抗体和抗肝肾微粒体1抗体)滴度成反比[22],表明Treg 数量的减少有利于AIH 发展。在AIH 中,Treg表达外核苷三磷酸二酯水解酶1(NTPDase 1,也称为CD39)的数量减少,不能充分水解促炎症的核苷酸,并且不能有效抑制效应CD4+T淋巴细胞产生IL-17,说明AIH 免疫调节缺陷是由于Treg 数量和功能减少所引起的[23]。AIH 患者肝脏中叉头状转录因子3(factor forkhead box P3,FoxP3)增加,特别是在疾病的活跃期,被称为肝脏中Treg的富集[24]。
最新研究[25]表明滤泡辅助性T 淋巴细胞(T follicular helper,TFH)在AIH 发病中也起重要作用,TFH 是辅助性CD4+T 淋巴细胞的一个亚群,通过产生IL-21 和表达CD40 配体等刺激分子,能够诱导成熟浆细胞中B 淋巴细胞的激活和分化,分泌免疫球蛋白。IL-21是通过mTOR途径调节Treg的分化和功能,促进Th17 的产生,并通过自分泌信号促进TFH 的分化。严重的AIH 患者血清中IL-21 的水平非常高,并与疾病活动相关。
3 MSC移植治疗AIH的作用机制
MSC 发挥其治疗作用的具体机制是抑制淋巴细胞活化和增殖以及促进Treg形成(图2)。MSC通过分泌NO、IL-10、PD-L1、TGF-β1、IL-6、吲哚胺2,3-双加氧酶、前列腺素E2、肝细胞生长因子等抗炎因子抑制T淋巴细胞增殖和CD8+T 淋巴细胞的活化,并能减轻细胞毒性[26]。
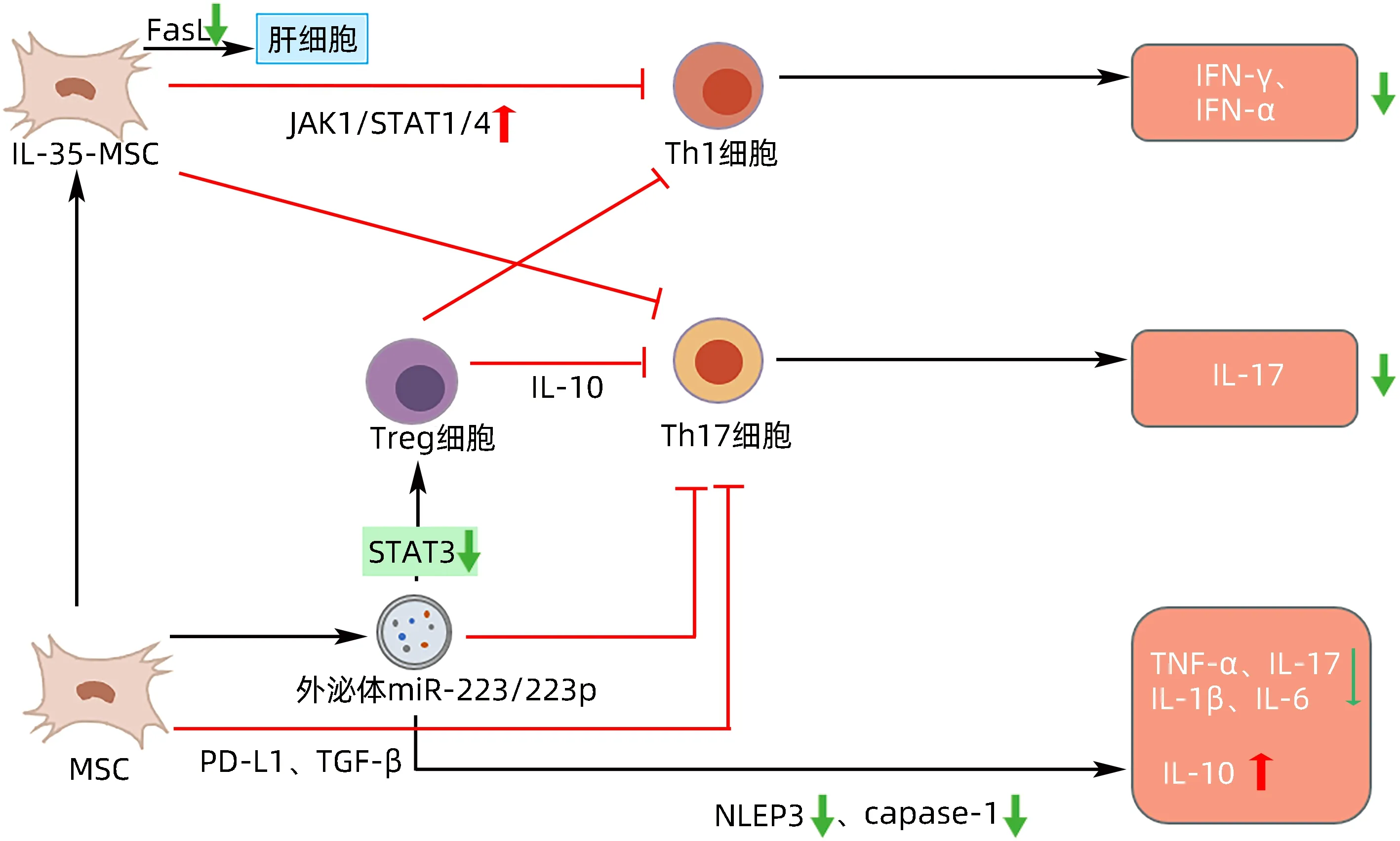
图2 MSC移植治疗AIH的作用机制Figure 2 Mechanism of action of MSC transplantation for AIH
3.1 MSC抑制自身抗原呈递后的免疫活化 Chen等[27]研究了骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)移植对实验性自身免疫性肝炎的治疗作用,发现BMSC 移植,特别是多剂量移植可以上调肝脏PD-L1 并抑制IL-17 的分泌从而发挥免疫抑制作用,进而改善小鼠肝功能。扁桃体源性MSC 通过PD-L1表达减弱Th17的分化,直接调控STAT3的磷酸化[28]。此外,有研究[29]发现,利用慢病毒转染构建的PD-L1 高表达的MSC-EXO,通过与PD-1 在细胞表面相互作用成功激活T 淋巴细胞、巨噬细胞、树突状细胞的免疫抑制信号。此项研究通过构建溃疡性结肠炎和银屑病小鼠自身免疫性疾病模型,进一步发现PD-L1 高表达的MSC-EXO 可特异性靶向肝脏病变部位,有效调节Th1、Th2、Th17 和Treg 细胞亚群之间的平衡,从而减弱AIH的自身免疫性反应。
MSC 的免疫调节作用不仅是由于可溶性因素的作用,也与细胞间接触有关。MSC 构成性地表达FasL和PD-L1。FasL 可诱导活化的T 淋巴细胞凋亡,而MSC 表面的PD-L1 与T 淋巴细胞表面的PD-1 结合,通过MHCⅡ发挥免疫抑制作用。MSC 还能分泌IFN-β,增加T 淋巴细胞表面PD-1 的表达,加强对T 淋巴细胞的抑制[30]。
IL-35是近年来发现的一种新型的细胞因子,其能诱导Treg的产生进而限制炎症反应[31]。Wang等[32]在刀豆蛋白A 诱导的重型肝炎小鼠模型中,通过灌注IL-35-MSC,研究了其在刀豆蛋白A 诱导的自身免疫性肝炎中的保护作用。结果发现MSC 可以通过减少肝细胞分泌的IL-17减轻肝损伤,而IL-35-MSC不仅可以减少Th17 分泌IL-17,还可以通过JAK1-STAT1/STAT4信号通路降低Th1上IFN-γ和肝细胞FasL 的表达,从而防止肝细胞凋亡。
3.2 MSC 维持免疫耐受 AIH 发病机制的核心是免疫调节的丧失,其治疗应该集中于恢复Treg 扩展的能力,从而增加其数量和功能。MSC 可以促进Treg 的增殖和转化,抑制Th17 的增殖和部分细胞因子分泌。在炎症环境中,MSC 通过分泌IL-10、血凝素-1 和其他抗炎细胞因子来抑制T 淋巴细胞的活化和增殖。此外,MSC 也可以分泌TGF-β 等抗炎细胞因子来促进Treg 的增殖和分化[33]。Chen 等[34]发现MSC 在脂多糖的刺激下可分泌肝细胞生长因子来诱导完全分化的Th17 向有功能的Treg 转化,从而调节了CD4+T 淋巴细胞群中Th17/Treg平衡。
有研究[35]表明,BMSC能显著增加Treg的比例,诱导CD4+CD25-细胞向Treg分化,抑制Th17的分化,从而发挥免疫调节作用。Kim等[36]发现胎盘源性的MSC通过FoxP3 促进T 淋巴细胞向Treg 分化。Melief 等[37]研究表明,MSC 分泌TGF-β1 参与了对T 淋巴细胞的免疫调节作用,TGF-β1可在T淋巴细胞受体共刺激下诱导Treg,促进单核细胞活化为Ⅱ型巨噬细胞,巨噬细胞产生大量的IL-10 进一步抑制Th17 的致病性。此外,TGF-β 还可诱导Foxp3 表达,抑制Th17 的分化,并刺激Treg的发育。
4 MSC-EXO治疗AIH的作用机制
MSC-EXO是一种重要的旁分泌效应体,通过携带亲代细胞的生物活性物质在细胞间通信中发挥重要作用。MSC-EXO 包括细胞质、膜蛋白、转录因子、脂质、DNA、RNA等,这些分子可转移到靶细胞通过抑制炎症反应、调节免疫发挥其治疗作用[38]。MSC-EXO作为无细胞疗法的载体,在自身免疫性疾病的治疗中受到广泛关注,因为它们不仅具有MSC本身的大部分治疗作用,而且降低了引入活细胞的风险。在临床治疗中,MSC-EXO 相比MSC 具有明显的优势(如损伤组织修复高效、靶向递送、安全性高等),未来有可能完全替代MSC 治疗[39]。因此,一种使用MSC-EXO 的新型无细胞疗法有望治疗AIH。
MSC-EXO 通过特定的miRNA 调节肝脏Treg 和Th17 的免疫对AIH 起治疗作用。Lu 等[40]发现携带miR-223-3p 的MSC-EXO 可减弱AIH 肝脏中的炎症反应。其机制与miRNA-223-3p 介导的对STAT3 基因和炎性细胞因子(IL-1β 和IL-6)表达的调节以及Treg/Th17 比值的升高有关。在BMSC-EXO 中,miR-223 通过下调实验性AIH 模型中NLRP3 和caspase-1 的蛋白水平来逆转肝脏炎症和细胞死亡,同时降低血清和肝脏组织中促炎症因子(TNF-α、IL-17A 和IL-1β)的水平。Zhao 等[41]发现MSC-EXO 作为地塞米松的载体,在肝脏中大量定植,并有效地内化到巨噬细胞,对巨噬细胞有明显的抑制作用,进而抑制AIH的发展。
5 小结与展望
AIH 患者的现有治疗方法有限,迫切需要一种新的治疗方法。MSC 具有改善组织微环境、促进组织再生的能力,其低免疫原性和高安全性使其成为AIH 最有希望的治疗选择。移植后,MSC 迁移至受损肝脏并进行靶向分化,通过外泌体传递关键细胞因子,保护肝脏,并通过抗炎和免疫调节机制减缓AIH 的进展。作为一种新型的无细胞疗法,外泌体可以将多种生物分子输送至靶细胞,参与组织修复和再生,避免MSC过度迁移和致癌的潜在风险。尽管MSC 和MSC-EXO 在AIH 动物模型中已经显示出明显的治疗效果,但仍需继续深入开展基础和临床研究,全面评价MSC 和MSC-EXO 移植治疗的安全性和有效性。可以预见,在研究人员和临床医生的不懈努力下,利用MSC 和MSC-EXO治疗AIH将给患者带来新的希望。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:罗龙龙负责检索文献,撰写论文;王丽菲、郑英、李斌、卢利霞、李初谊参与修改论文;于晓辉、张久聪负责拟定写作思路,指导撰写文章并最后定稿。
