快速滤过型净化结合液相色谱-蒸发光散射法检测茶叶中5 种糖类成分
2023-12-14董晓倩白春蓉刘松南
董晓倩,白春蓉,兰 韬,田 旭,祁 娟,王 翠,丁 洁,刘松南,*
(1.北京食品科学研究院北京市茶叶质量监督检验站,北京 100162;2.国家茶叶产品质量检验检测中心(四川),四川 雅安 625300;3.中国标准化研究院,北京 100191)
茶叶是以茶树鲜叶为原料采用特定工艺加工而成的产品,因原料和工艺特点茶叶本身含有一定的糖类成分。茶叶中的可溶性糖类成分主要有果糖、葡萄糖、蔗糖等,这些糖类成分是茶汤中主要的甜味来源,对茶汤的滋味及品质起重要作用,有助于形成各品种各等级茶叶固有的感官品质特征[1]。在茶叶加工过程中人为添加蔗糖等糖类成分能够改善茶叶的口感、提升干茶的光泽度和紧结度,从而虚假提升茶叶的品质,还能增加茶叶的质量。不法生产厂家正是抓住这些特点,在茶叶加工过程中通过加糖达到以次充好、增加质量进而牟利的目的[2]。根据GB/T 30766—2014《茶叶分类》的规定,茶叶产品不得含有任何添加物[3]。人为加糖不仅扰乱了传统茶叶市场,让守法厂商处于被动境地。同时,由于蔗糖等糖类易吸潮、易变质和易滋生细菌等特点,人为的加糖对茶叶质量安全也有较大的隐患。因此,茶叶中的糖类含量分析是茶叶品质管理的必要手段。
因果糖、葡萄糖、蔗糖等糖类成分不属于食品添加剂[4],不在我国茶叶食品质量和安全标准的控制范围内,我国也没有适用于茶叶中这些糖类成分的检测方法,这导致茶叶中添加糖类成分的掺假行为长期不受行业监管,不法加糖行为不被查处,合法厂商的正当权益长期受到侵犯,消费者的知情权和健康权利得不到保障。为确保茶叶中糖类成分含量在正常、合理范围内,需要开发适用于茶叶中主要糖类成分的准确定量检测方法,获取茶叶中主要糖类成分的含量数据。
目前,糖类成分的检测主要有薄层色谱法[5]、酶法、液相色谱-蒸发光散射法/示差折光检测法/电雾式检测法[6-8]、液相色谱-质谱联用法[9-10]、气相色谱法[11-12]、气相色谱-质谱联用法[13]、毛细管电泳法[14-15]等。其中,薄层色谱法多用于定性及半定量分析,精密度和准确度较差;酶法能检测的糖类有限,不能同时检测多种糖成分;气相色谱-质谱联用法和毛细管电泳法需要柱前衍生,操作复杂、重复性差[16];液相色谱-质谱联用法操作简便、选择性好,但是设备昂贵,检测成本高。液相色谱-示差折光检测法操作简便、适用范围广,但是检测结果易受温度、流速等影响,且对梯度洗脱适应性较差。蒸发光散射检测器是一种质量型检测器,用于无紫外吸收或者紫外末端吸收的大分子物质的定性定量检测,适合用于糖类成分的定量分析测定。
在对茶叶中糖类成分的检测研究中,大多为用水提取后直接上机分析,对其净化的研究较少[17-18]。GB 5009.8—2016《食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》第一法(高效液相色谱法)中也没有净化步骤,其适用范围也没有茶叶这一食品类别[19]。而茶叶的水提物中含有大量的干扰物质,如果不进行净化将会严重影响色谱柱寿命及仪器系统,因此净化步骤对于茶叶样品前处理非常重要。快速滤过型净化(multi-plug filtration cleanup,m-PFC)技术是在QuEChERS净化基础之上进一步简化形成的一种快速新型的净化技术,操作简便、快速,便于机械化,前处理效率高,广泛应用于农残检测的净化[20-22],目前鲜见该方法应用在糖类成分检测过程中。
聚酰胺粉是由酰胺基单体聚合而成的高分子聚合物,具有比表面积大、吸附性良好等特点,目前已应用于天然有机苷原、黄酮类、多酚类等成分的提取[23-25],但将聚酰胺粉作为糖类成分检测的净化材料尚鲜见文献报道。考虑到茶叶中含有大量的茶多酚、黄酮等成分,在糖类检测过程中这些成分会随着提取溶剂进入提取液中干扰检测,需要进行净化。聚酰胺粉因具有吸附前述成分的功效,有作为净化吸附剂的可能性。
本实验拟结合m-PFC前处理手段,考察聚酰胺粉作为净化吸附剂填料的可能性,建立液相色谱-蒸发光散射法同时检测茶叶中5 种可溶性糖类成分的方法,以期为茶叶中糖类成分的准确定量检测以及掺杂糖类现象的监督监管提供技术手段。
1 材料与方法
1.1 材料与试剂
茶叶(绿茶、白茶、花茶、红茶、乌龙茶、普洱茶各30 个),包括吴裕泰、正兴德、京华、张一元、七彩云南、八马、忆江南、福茗源、天福、中茶10 个品牌。
鼠李糖(纯度98%)、果糖(纯度99%)、葡萄糖(纯度98%)、蔗糖(纯度99%)、麦芽糖(纯度98%)上海安谱实验科技股份有限公司;乙腈(色谱纯)西格玛奥德里奇(上海)贸易有限公司;聚酰胺粉(100~200 目,经改性处理)、N-丙基乙二胺(N-propylethylenediamine,PSA)(40~60 μm)、多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)(10~20 nm)、石墨化碳黑(graphitized carbon black,GCB)(120~400 目)、m-PFC净化柱管 北京科德诺思技术有限公司;实验用水由Milli-Q纯水机(0.22 μm过滤膜,美国Millipore公司)制得。
1.2 仪器与设备
LC-20A液相色谱仪(配有蒸发光散射检测器)、AEL200分析天平(感量0.1 mg)、UV-2600紫外-可见分光光度计 日本岛津公司;JJ500电子天平(感量0.01 g)常熟双杰测试仪器厂;KQ-250B型超声波清洗器 昆山市超声仪器有限公司;H1650高速台式离心机 长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 标准溶液的配制
标准贮备溶液:准确称取鼠李糖、果糖、葡萄糖、蔗糖、麦芽糖1.000 0 g分别至10 mL容量瓶中,用10%乙腈溶液定容至刻度,混匀,配制成质量浓度为100 mg/mL的标准贮备溶液,4 ℃冰箱冷藏保存,有效期为1 个月。
混合标准工作溶液:准确吸取5 种糖类成分标准贮备溶液各1.00 mL于10 mL容量瓶中,用水定容至刻度,混匀,配制成质量浓度10.0 mg/mL的混合标准工作溶液,4 ℃冰箱冷藏保存,有效期为7 d。
1.3.2 提取
取茶叶样品经粉碎机粉碎,过80 目筛,装袋密封保存,备用。
称取上述茶叶粉末1 g(精确至0.001 g)于50 mL离心管中,准确加入20.0 mL水旋涡提取1 min,静置提取10 min,期间振摇一次。向上述溶液中加入10 mL二氯甲烷,旋涡混匀1 min,静置5 min后再次旋涡1 min,于3 500 r/min离心10 min,收集上层溶液,待净化。
1.3.3 净化
将m-PFC柱管下接0.22 μm有机微孔滤膜,吸取前述上层溶液1.00 mL移入m-PFC柱管内,安装注射杆并缓慢推动,控制流出速率1 滴/s,同时直接收集净化液于进样瓶中,上机分析。
1.3.4 色谱条件
色谱柱:迪科玛Polyamino HILIC 色谱柱(250 mm×4.6 mm,5 μm),配备相应保护柱;柱温:40 ℃;进样体积10 μL;流动相:水和乙腈;梯度洗脱程序见表1。流速1.0 mL/min;漂移管温度70 ℃;氮气压力350 kPa。

表1 梯度洗脱程序Table 1 Gradient elution program
1.3.5 提取液及净化液中茶多酚、游离氨基酸、咖啡碱、黄酮含量的测定
提取液及净化液中茶多酚、游离氨基酸、咖啡碱含量的测定分别按照GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》、GB/T 8314—2013《茶 游离氨基酸总量的测定》、GB/T 8312—2013《茶 咖啡碱测定》进行测定;黄酮含量参照何书美等[26]的方法进行测定。
1.4 数据处理
图谱采集及数据定量分析采用Lab Solution数据处理系统及Excel进行,图像处理采用Origin 8.0进行。
2 结果与分析
2.1 色谱条件优化
GB 5009.8—2016第一法对糖类成分的分析采用乙腈-水(70∶30,V/V)等度洗脱的方式,本实验首先采用该方法进行糖类成分的分析,结果表明5 种糖混合标准工作溶液能够达到基线分离、分离效果较好,但是当采用该条件分析乌龙茶实际样品时,在蔗糖峰附近存在1 个干扰峰(图1a),影响其准确定量。当采用梯度洗脱时,干扰峰与蔗糖峰达到基线分离(图1b),满足分析要求,因此本实验采用梯度洗脱的方式对糖类成分进行分析,梯度洗脱程序见表1,5 种糖类成分的色谱图见图1c。

图1 标准溶液及乌龙茶样品中糖类成分色谱图Fig.1 Chromatograms of saccharides in standard solution and oolong tea samples
2.2 提取条件的优化
2.2.1 提取方式的选择
实验比较振荡提取法、加热提取法和超声辅助提取法对5 种糖类成分的提取效率,结果表明采用3 种不同的方式提取时,回收率没有显著差异。采用振荡提取方法简便、易于操作,因此本实验选取振荡提取进行后续实验。
2.2.2 提取溶剂的选择
研究表明有机溶剂乙腈的存在会减少提取液中杂质的含量[27],利于后续的净化操作,但其对糖类成分提取效率的影响不得而知。本实验以白茶为例,向其添加质量分数为1%的5 种糖,通过回收率考察提取溶液中水/乙腈比例(0%、30%、50%、70%、100%)对糖类成分提取效果的影响。结果表明,随着提取溶液中乙腈比例的减少,糖类成分的提取回收率不断增加,当用纯水提取时,5 种糖的回收率最高(图2),表明乙腈的存在虽然会减少杂质的溶出,但是会影响糖类成分的提取效率,因此本实验选取用纯水进行提取。
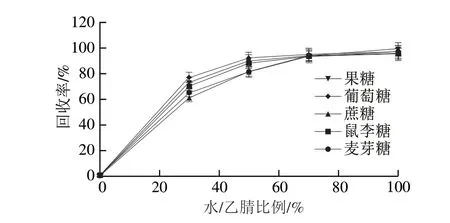
图2 提取溶液中水/乙腈的比例对5 种糖分回收率的影响Fig.2 Effect of solvent composition,water/acetonitrile ratio on the recoveries of five saccharides
采用纯水提取时,提取溶液中的杂质较多,不利于后续的净化,因此本实验首先采用有机试剂反萃取的方式去除提取液中部分杂质。本实验比较了在水中溶解度较低的乙酸乙酯(8.3 g/100 mL、20 ℃)、二氯甲烷(1.3 g/100 mL、20 ℃)作为反萃溶剂的除杂效果。结果表明,乙酸乙酯和二氯甲烷都能够明显去除提取液中的色素成分,且不会影响待测糖类成分的回收率。考虑到乙酸乙酯在水中溶解度更大,影响提取溶液的体积,同时密度比水小,会在提取液的上层,不利于后续步骤中提取液的取出,因此本实验选取二氯甲烷作为反萃溶剂进行净化。
2.2.3 提取次数的选择
按照1.3.2节的方法分别提取1、2、3 次,净化后上机分析,考察提取次数对提取效率的影响。结果表明在提取第一次时5 种糖的回收率均在98%以上,满足分析要求,因此本实验选择提取一次进行后续实验。
2.3 净化条件的优化
茶叶提取液中主要的杂质成分为茶多酚、色素、生物碱等,如不进行净化处理会对色谱柱、检测器等仪器系统造成很大的污染。因此本实验首先考察聚酰胺粉和PSA的用量对茶叶提取液中杂质的去除效果。
在净化过程中,最常用的净化剂有MWCNTs、GCB、C18、PSA等。本实验室前期研究结果表明,C18对去除茶叶提取液中杂质效果甚微[28],因此本实验不再考察C18对杂质的吸附效果。聚酰胺粉是一种由酰胺基单体聚合而成的高分子化合物,内含的酰胺键能够与醌类、酚类、硝基类化合物形成氢键而具有吸附作用[29],理论上而言对于茶叶提取液中杂质成分具有吸附作用。本实验考察MWCNTs、GCB、PSA、聚酰胺粉作为净化剂使用的可能性。
2.3.1 净化剂对5 种糖吸附效果评价
在考察净化剂去除杂质的效果前,首先考察不同吸附剂对目标物的吸附能力,以确保净化剂在去除杂质的同时,不会影响待测化合物的回收率。将质量浓度为1.0 mg/mL的5 种糖混合标准工作溶液分别经200 mg聚酰胺粉、GCB、MWCNTs、PSA直接净化后上机检测,考察4 种净化剂对5 种糖的吸附效果。结果表明,聚酰胺粉和PSA对5 种糖吸附效果不明显,MWCNTs和GCB对5 种糖呈现不同程度的吸附作用,尤其是对蔗糖和麦芽糖的吸附效果极为明显(图3a)。分别称取不同质量的MWCNTs和GCB净化剂,制备成m-PFC净化柱,按照前述操作进行净化,考察不同质量的两种净化剂对糖类成分的吸附能力,结果见图3b、c。由图3可知,当用量为15 mg时,MWCNTs和GCB已经对单糖(鼠李糖、果糖、葡萄糖)产生了吸附作用,对于双糖(蔗糖、麦芽糖)的吸附更为严重,不具备作为糖类成分检测时净化剂的能力,因此本实验仅选取聚酰胺粉和PSA进行后续研究。
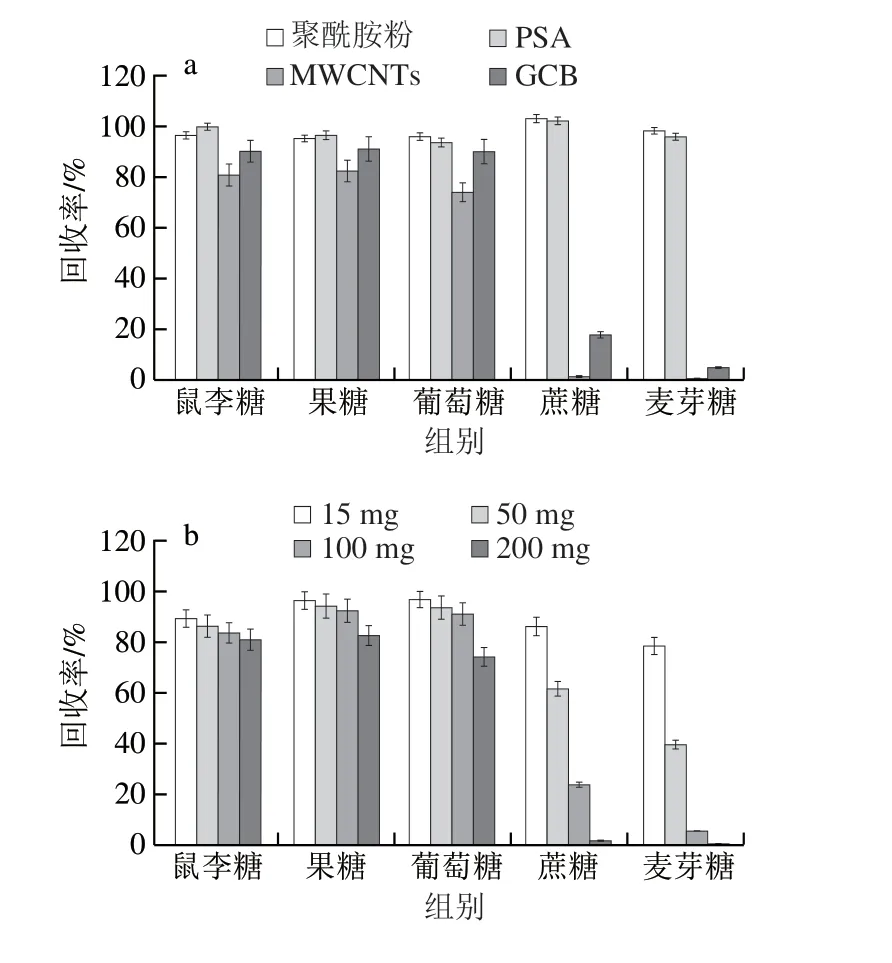
图3 净化剂对5 种糖类成分回收率的影响Fig.3 Effects of sorbents on the recoveries of five saccharides
2.3.2 净化剂对杂质去除效果评价
由图4可知,除了游离氨基酸外,聚酰胺粉对茶多酚、咖啡因和黄酮的去除效果明显优于PSA。当采用200 mg聚酰胺粉进行净化时,能够去除80%以上的大分子多酚和黄酮类物质。选取水提物颜色最深的普洱熟茶作为研究对象,考察不同用量的聚酰胺粉和PSA对色素去除的效果。由图5可以发现,PSA对于色素类物质的去除几乎没有作用。而随着聚酰胺粉用量的增加,净化液的颜色逐渐变浅,且澄清透明,表明聚酰胺粉对于去除茶叶水提物中的色素具有很好的效果。考虑到PSA对于茶叶水提液的净化效果较差,同时过多的净化剂不利于净化液的获得,本研究最终仅选用聚酰胺粉一种净化剂,用量200 mg进行后续的净化实验。将聚酰胺粉填装至m-PFC柱管制成净化柱后分别对6 类茶叶提取液进行净化,结果表明仅有花茶、普洱茶净化后仍有些许颜色外,其他茶叶提取液均无色澄清透明,净化效果较好(图6)。

图4 聚酰胺粉和PSA对杂质去除效果评价Fig.4 Evaluation of removal efficiency of polyamide powder and PSA on interfering components
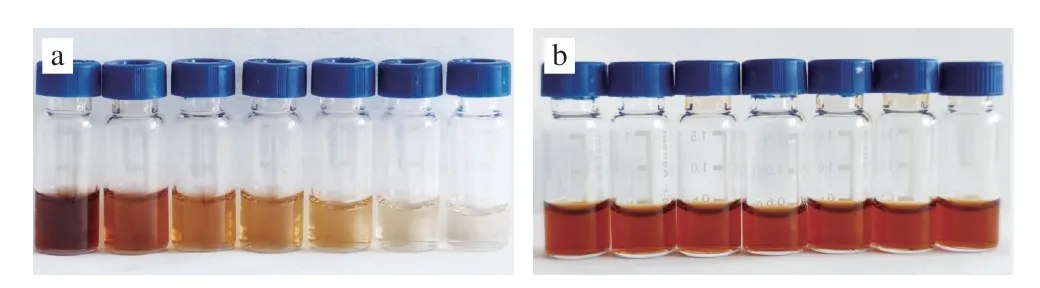
图5 聚酰胺粉及PSA用量对普洱茶色素去除效果Fig.5 Effect of different amounts of polyamide powder and PSA on pigment removal from Pu’er tea
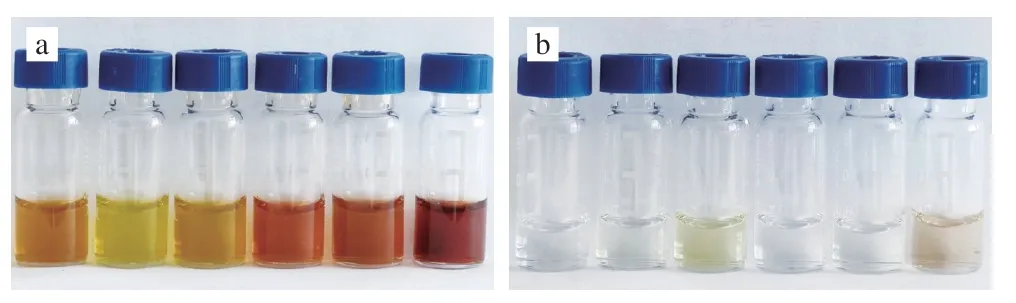
图6 6 种不同茶叶净化前后比较Fig.6 Comparison of six different tea samples before and after purifciation
2.4 线性关系、检出限(limits of detection,LOD)及定量限(limits of quantification,LOQ)
准确配制鼠李糖、果糖、葡萄糖、蔗糖、麦芽糖系列标准工作溶液,以质量浓度的常用对数为横坐标、峰面积的常用对数为纵坐标绘制标准曲线。当鼠李糖质量浓度为10.00 mg/mL,果糖质量浓度为2.00 mg/mL,葡萄糖、蔗糖、麦芽糖质量浓度为5.00 mg/mL时,出现平头色谱峰,蒸发光散射检测器响应值达到饱和,分别稀释至9.50、1.50、4.50 mg/mL后得到良好色谱峰。以信噪比等于3时所对应的糖质量浓度为仪器的LOD,得出鼠李糖的LOD为0.05 mg/mL,果糖、葡萄糖、蔗糖、麦芽糖的LOD为0.02 mg/mL。综上,鼠李糖、果糖、葡萄糖、蔗糖、麦芽糖的线性范围分别为0.05~9.50、0.02~1.50、0.02~4.50、0.02~4.50、0.02~4.50 mg/mL。在其相应的线性范围内绘制标准曲线,同时以信噪比3和10分别作为方法的LOD和LOQ,结果见表2。峰面积对数与其质量浓度对数线性关系良好,相关系数大于0.99,LOD为0.04~0.1 g/100 g,LOQ为0.10~0.20 g/100 g。
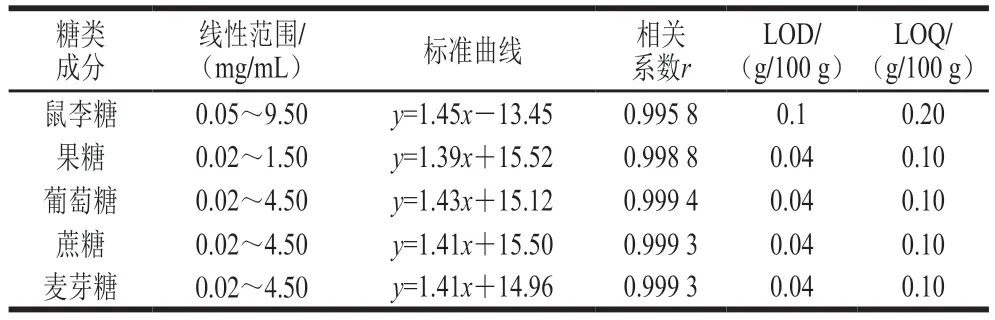
表2 5 种糖类成分的线性范围、标准曲线、相关系数、LOD及LOQTable 2 Linear ranges,regression equations,correlation coefficients,LODs and LOQs of five saccharides
2.5 回收率及精密度实验结果
选取已准确测定各糖含量的绿茶样品(其中蔗糖含量为1.0 g/100 g,鼠李糖含量小于0.10 g/100 g,果糖、葡萄糖、麦芽糖含量均小于0.04 g/100 g),然后按照蔗糖添加0.50、1.0、1.5 g/100 g(0.5、1、1.5 倍本底),其余4 种糖添加0.10、1.0、10 g/100 g三个水平进行加标回收实验,进样浓度超出线性范围时进行适当稀释,每个添加量做6 次平行,扣除本底含量后分别计算回收率。表3表明,5 种糖类成分在3 个水平的平均加标回收率范围为91.0%~103%,相对标准偏差为1.0%~4.6%,满足分析要求。

表3 5 种糖类成分的加标回收及精密度实验Table 3 Recoveries and precision RSDs of five saccharides
2.6 与国标方法结果的比较
参照国标方法不进行净化直接上机分析,进样100 针后,柱压明显升高(由6 MPa升至10 MPa),说明有较多杂质残留在柱头上。而本方法净化去除了大部分杂质,上机溶液澄清透明(图6),进样100 针后柱压无明显变化,说明本方法明显延长了色谱柱的使用寿命。同时,本方法净化步骤简单、操作方便、易于通过批量化操作提高前处理效率。
2.7 实际样品检测结果
随机选取180 个茶叶样品(绿茶、白茶、花茶、红茶、乌龙茶、普洱茶各30 个),按照本实验方法进行糖类成分的检测,结果表明,不同茶叶中糖类成分各有不同,鼠李糖和麦芽糖的含量最低,所分析样品中均未检出,果糖、葡萄糖、蔗糖均有不同程度的检出,其中果糖含量范围为0.04~0.55 g/100 g,葡萄糖含量范围为0.04~0.60 g/100 g,蔗糖含量范围为0.04~6.14 g/100 g,说明果糖、葡萄糖和蔗糖在茶叶中普遍存在,含量差异较大。对于茶叶中是否添加蔗糖,需进行进一步研究。
3 结论
本实验结合m-PFC技术和液相色谱-蒸发光散射法,建立茶叶中鼠李糖等5 种糖类成分的检测方法。相较于其他检测方法,本方法创新使用了聚酰胺粉作为净化材料,开发了适用于茶叶中5 种糖类成分检测的m-PFC净化小柱。相较于传统的GCB、MWCNTs固相萃取柱,本小柱价格低廉、操作简便快速、便于批量化实验。净化步骤减少了上机溶液中的杂质,较大限度地延长色谱柱使用寿命,保护液相色谱流路系统。方法的线性、回收率及精密度等符合理化检验要求[30],为茶叶中糖类成分的精确定量及是否添加了糖类成分预测提供了可靠技术手段。
