酱香白酒第5轮次窖池发酵不同分层酒醅微生物群落与感官、理化性质差异分析
2023-12-14王玉荣侯强川田龙新刘菊珍周加平
王玉荣,侯强川,田龙新,刘菊珍,周加平,郭 壮,*
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.襄阳市酱香型白酒固态发酵企校联合创新中心,湖北 襄阳 441053;3.酱香型白酒固态发酵襄阳市重点实验室,湖北 襄阳 441614)
白酒(又称高粱酒)是我国一种传统的蒸馏酒,深受广大消费者的喜爱[1]。其主要以谷物等为原料,经纯粮固态或半固态发酵而成,这也是与其他蒸馏酒的主要差异之一[2]。白酒按香型划分为酱香型、浓香型和清香型等十二种香型[3],其中酱香型的酿造工艺最为复杂和独特,其粮曲原料在长达一年的生产周期中,需经过多次发酵和多轮取酒[4-5]。相关研究已经证实,不同轮次所获得的白酒品质存在较大的差异,且基酒品质以第3、4、5轮次较好,亦被人称为“大轮回”[6]。基酒经过陈酿和精心勾调后方可获得酱香型成品白酒,具有酱香、醇厚、细腻和回味悠长等特点[7]。
酱香型白酒作为传统的发酵酒,其品质与发酵微生物的组成和多样性具有密切的联系[8],Hou Qiangchuan等[9]已经证实3 种低温大曲中微生物的结构和功能存在较大差异,且大曲的品质直接或间接影响成品酒的香气和质量。酱香型白酒的发酵属于开放式发酵,使得酒醅作为一个天然的培养基,不仅包含大曲中的微生物,还可以富集生产环境中的微生物进行发酵[10],而不同产地的白酒即使工艺相同,其品质也存在细微的差异[11]。因此,研究人员针对酒醅中的微生物展开了大量卓有成效的研究。崔守瑜等[10]基于纯培养技术对贵州酱香型白酒发酵过程中的不同轮次发酵过程酒醅中微生物构成进行解析,发现不同轮次酒醅中微生物构成存在较大差异;张春林等[12]对第2轮次酒醅中微生物多样性及其理化特性进行关联分析,结果显示许多微生物对酒醅的理化性质具有较大的影响。在白酒基酒取酒过程中采用“分层起槽”的方式[13],王玉荣等[14]对第4轮次不同分层酒醅的理化性质和微生物多样性进行了研究,并证实不同分层中酒醅的理化指标和微生物构成存在明显差异,且差异主要是由温度导致。
湖北作为酱香型白酒生产的重要省份,目前少有科研人员针对该地区酱香型白酒酒醅展开系统的研究,特别是不同轮次酒醅中微生物在白酒发酵过程中的影响尚不明确。本研究采用高通量测序技术对第5轮次不同分层酒醅中微生物构成和多样性进行解析,并通过多组学手段对酒醅的理化和感官指标进行分析,探究微生物在第5轮次白酒发酵过程中的作用,为后续发酵工艺的改良提供必要的数据支撑。
1 材料与方法
1.1 材料与试剂
平板计数培养基、马铃薯葡萄糖琼脂培养基、MRS培养基 北京奥博星生物技术有限责任公司;氢氧化钠、氯化钠、酒石酸钾钠、葡萄糖 国药集团化学试剂有限公司;DNeasy mericon Food Kit DNA基因组提取试剂盒 德国QIAGEN公司。
1.2 仪器与设备
SA 402B电子舌 日本Insent公司;PEN3电子鼻德国Airsense公司;CN-KT001电子天平 深圳千确电子有限公司;HH-6数显恒温水浴锅 国华(常州)仪器制造有限公司;LRH-150数显生化培养箱 上海一恒科技有限公司;K1100凯氏定氮仪 海能未来技术集团股份有限公司;DG250型厌氧工作站 英国Don Whitley公司;R930机架式服务器 美国Dell公司;MiSeq高通量测序平台 美国Illumina公司。
1.3 方法
1.3.1 样品采集与前处理
本研究所有酱香型酒醅样本均采集自湖北省襄阳市某酒厂,采用时间为2021年7月。本研究所涉及的窖池长宽高分别为4.8、2.3 m和1.8 m,并按照由低到高分为下层(距池底60 cm,温度32 ℃)、中层(距池底120 cm,温度33~35 ℃)和上层(距池底180 cm,温度37 ℃)。分别对窖池第5轮次不同分层酒醅样本进行采集(所有酒醅样本在池中的发酵时间为28 d),每层采集5 份样本(对角线交点和4 个角落)。上层酒醅编号分别为F5S1~F5S5;中层酒醅编号分别为F5Z1~F5Z5;下层酒醅编号分别为F5X1~F5X5。每份酒醅样本分别采集600 g,并一式两份至于无菌无酶的自封袋中低温运回鄂西北传统发酵食品研究所,一份立即用于活菌计数,一份于-80 ℃备用。
1.3.2 理化特征分析
参照GB 5009.5—2016《食品中蛋白质的测定》中凯氏定氮法对酒醅中蛋白质含量进行测定[15];参照DB 34/T 2264—2014《固态发酵酒醅分析方法》中滴定法对酒醅酸度进行测定,并采用葡萄糖标准溶液反滴定法对酒醅中还原糖和淀粉含量进行测定[16];准确称取4 g酒醅样本于专用样品盘中,并使用卤素水分测定仪对其水分含量进行测定[14]。
1.3.3 活菌计数
参照GB 4789.35—2016《乳酸菌检验》方法对酒醅中细菌和乳酸菌总数进行计数[17];参照GB 789.15—2016《霉菌和酵母计数》方法对酒醅中霉菌和酵母菌总数进行计数[18]。
1.3.4 酒醅滋味品质分析
准确称取20 g酒醅样本于100 g蒸馏水中搅拌均匀后12 000 r/min离心10 min,取上清液抽滤后置于4 ℃冰箱中24 h,取下清液备用。使用电子舌对滤液的酸味、苦味、涩味、咸味和咸味等基本味,以及后味A(涩的回味)、后味B(苦的回味)和丰度(鲜的回味)等基本味的回味进行数字化测定,并均以F5S1为对照,每份样品重复测定4 次,取后3 次数据为本实验的测试数据用于后续分析[19]。
1.3.5 酒醅风味品质分析
准确称取15 g酒醅样本于电子鼻样品瓶中封口,置于60 ℃水浴锅中保温20 min,并于室温平衡20 min。样品采用顶空进样,平行测定3 次。使用电子鼻对酒醅样本的风味特征进行采集,电极响应曲线在50 s后达到平台期,选用59、60 s和61 s所对应的响应值进行后续分析[20]。
1.3.6 微生物多样性分析
使用微生物基因组提取试剂盒对酒醅样本中微生物的宏基因组DNA进行提取,并使用微量紫外分光光度计对提取物的纯度和浓度进行检测,将检测合格的DNA提取物置于-80 ℃备用。分别使用带有核苷酸标签(Barcode)的338F/806R和ITS1F/ITS2R引物对酒醅中细菌的16S rRNA和真菌的ITS序列进行扩增[21-22]。使用1.0%的琼脂糖凝胶电泳对扩增产物进行检测,并将检验合格的扩增产物使用Illumina MiSeq平台进行双端测序。
参照Yang Chengcong等[23]的方法对下机序列进行质控,基于QIIME(v1.7.1)平台对酒醅样本中微生物的构成和多样性进行分析[24]。首先,本研究参照崔梦君等[25]对莽椒中细菌中微生物的多样性分析的主要步骤对酒醅中微生物构成和多样性进行解析。同时,参照Wang Yurong等[20]对豆豉中真菌多样性的主要分析步骤对酒醅中真菌微生物的构成和多样性进行解析。进一步将获得的代表性序列与标准数据库进行同源性比对,通过4 种α多样性指数(Shannon指数、Simpson指数、Chao1指数和发现物种数)对酒醅中微生物多样性和丰富度进行分析,并通过加权/非加权的Uni-Frac距离进行主坐标分析。本研究下载了酱香白酒第4轮次窖池不同分层酒醅微生物序列数据与本研究数据进行了合并分析[14]。
1.3.7 下载数据的核酸登录号
本研究下载酱香白酒第4轮次窖池不同分层酒醅微生物序列数据纳入分析,该数据在MG-RAST数据库的登录号为mgp102959。
1.4 数据分析及可视化
本研究使用Wilcoxon test对不同分层和轮次酒醅中微生物相对丰度、α多样性指数和酒醅的理化指标进行显著性分析;使用R软件对酒醅中的潜在关键物种进行识别;使用Spearman秩相关性分析对酒醅中部分菌属和其理化指标及感官品质进行分析,并使用Gephi软件进行网络图绘制。其他数据的可视化均使用R(V 4.2.2)软件和Origin 2021完成。
2 结果与分析
2.1 不同分层酒醅理化指标和活菌计数分析
酒醅作为重要的发酵基质,其理化特性不仅直接影响着白酒的品质,还通过影响微生物生长间接影响白酒的品质。本研究首先对酒醅的酸度、水分含量和淀粉含量等理化指标进行了比较分析,结果如表1所示。

表1 不同分层酒醅理化特性和活菌计数Table 1 Physicochemical properties and viable microbial counts of different layers of alcoholic fermentative material
由表1可知,在检测的6 个指标中,仅蛋白质含量在不同分层中差异不显著(P>0.05);中层酒醅的酸度、乙醇体积分数、淀粉含量和还原糖含量均显著高于下层(P<0.05),其中淀粉含量和还原糖含量亦显著高于上层(P<0.05);而上层的水分含量和还原糖显著高于下层(P<0.05)。由此可见,不同分层酒醅中的理化指标存在较大差异。为此,本研究使用纯培养技术对酒醅中的乳酸菌、菌落总数、酵母菌和霉菌进行计数以初步估计酒醅中的微生物数量。结果显示,乳酸菌在上中下层中的乳酸菌数分别为4.07、4.00(lg(CFU/g))和4.08(lg(CFU/g));菌落总数分别为5.34、5.67(lg(CFU/g))和5.63(lg(CFU/g));而酵母菌和霉菌数分别为5.50、5.61(lg(CFU/g))和5.20(lg(CFU/g))。而经检验发现,不同分层酒醅中菌落总数、乳酸菌数、酵母菌和霉菌数差异不显著(P>0.05)。
2.2 不同分层酒醅感官品质差异分析
通过酒醅风味在一定程度上可以反映成品酒的品质,在前期通过对酒醅滋味和风味品质进行分析,对于控制成品酒的质量十分重要。因此,本研究通过仿生设备对不同分层酒醅的感官品质进行了数字化分析,结果如图1所示。
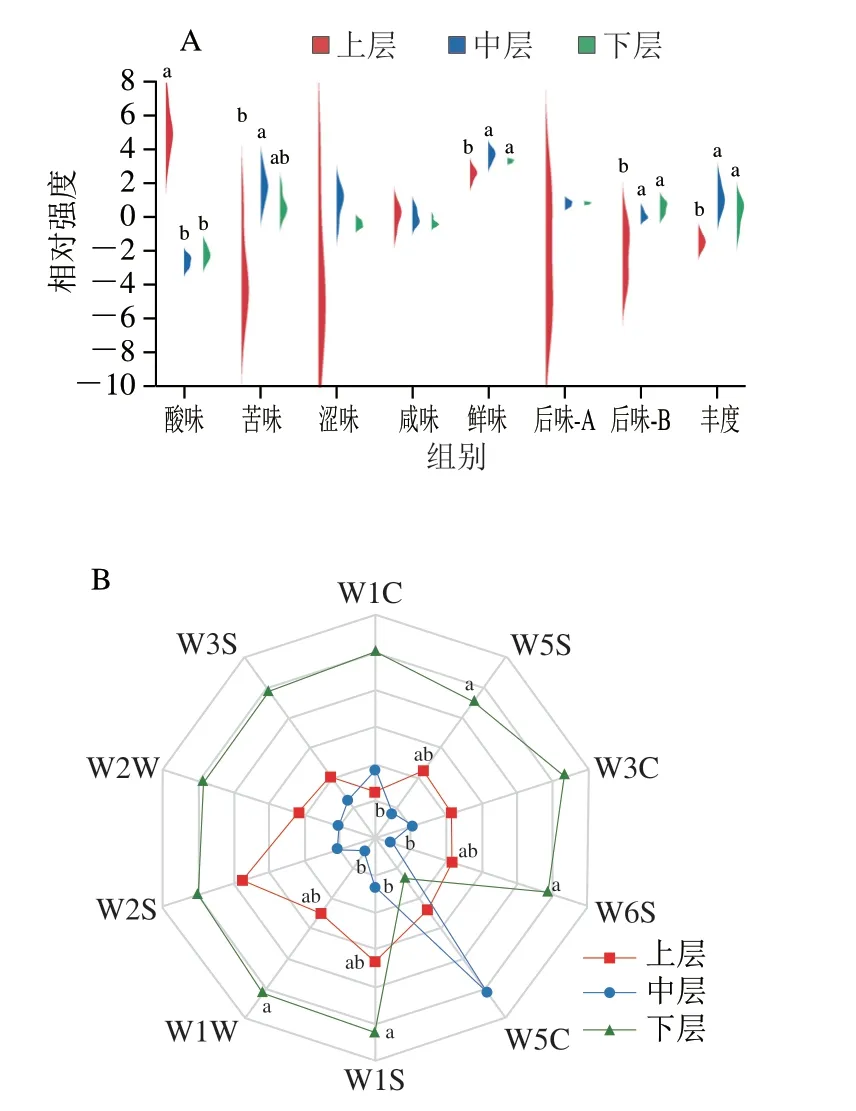
图1 不同分层酒醅滋味(A)和风味(B)比较分析Fig.1 Comparative analysis of taste (A) and flavor (B) of different layers of alcoholic fermentative material
由图1A可知,在5 个基本味中,上中下层的涩味和咸味均不存在显著差异(P>0.05),而酸味强度在上层酒醅中显著高于中层和下层(P<0.05),苦味强度在上层酒醅中显著低于中层(P<0.05),而鲜味在上层酒醅中显著低于中层和下层(P<0.05);在3 个基本味的回味中,上中下层的后味-A差异不显著(P>0.05),而上层酒醅的后味-B和丰度显著低于中层和下层(P<0.05)。由图2B可知,第5轮次不同分层酒醅在W1C、W3C、W5C、W2S、W2W和W3S上均差异不显著(P>0.05),但下层酒醅在W5S、W6S、W1S和W1W均显著高于中层(P<0.05),而与上层无显著差异(P>0.05)。
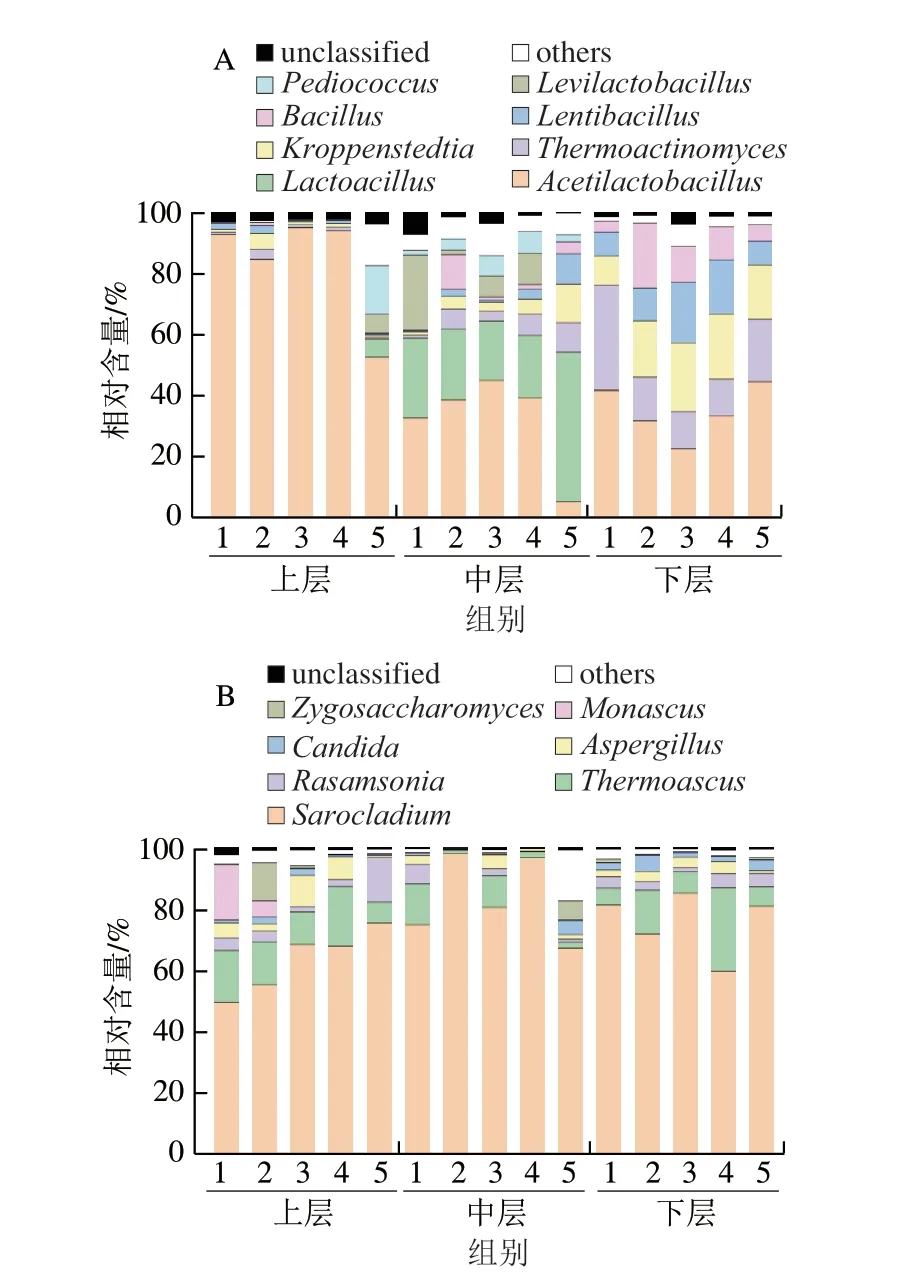
图2 不同分层酒醅中微生物属水平构成Fig.2 Genus-level composition of microbial communities in different layers of alcoholic fermentative material
2.3 不同分层和轮次微生物群落差异分析
微生物在白酒发酵过程中十分重要,而酒醅作为微生物发酵的主要载体,对酒醅中微生物多样性进行解析十分必要。本研究采用高通量测序技术对酒醅中微生物的构成进行解析,结果如图2所示。
由图2a可知,不同分层酒醅中优势细菌属(平均相对含量大于1.00%)共有8 个,分别为Acetilactobacillus、Lactobacillus和Thermoactinomyces等,其平均相对含量分别为50.23%、9.65%和8.46%。由图2b可知,不同分层酒醅中的优势真菌属(平均相对含量大于1.00%)共有7 个,分别为Sarocladium、Thermoascus和Rasamsonia,其平均相对含量分别为74.18%、10.43%和3.55%。值得注意的是,不同分层酒醅中微生物的优势细菌构成存在较大的差异,而优势真菌构成的差异较小。因此,本研究对不同分层和轮次酒醅中优势菌属的差异进行了分析,结果表2所示。
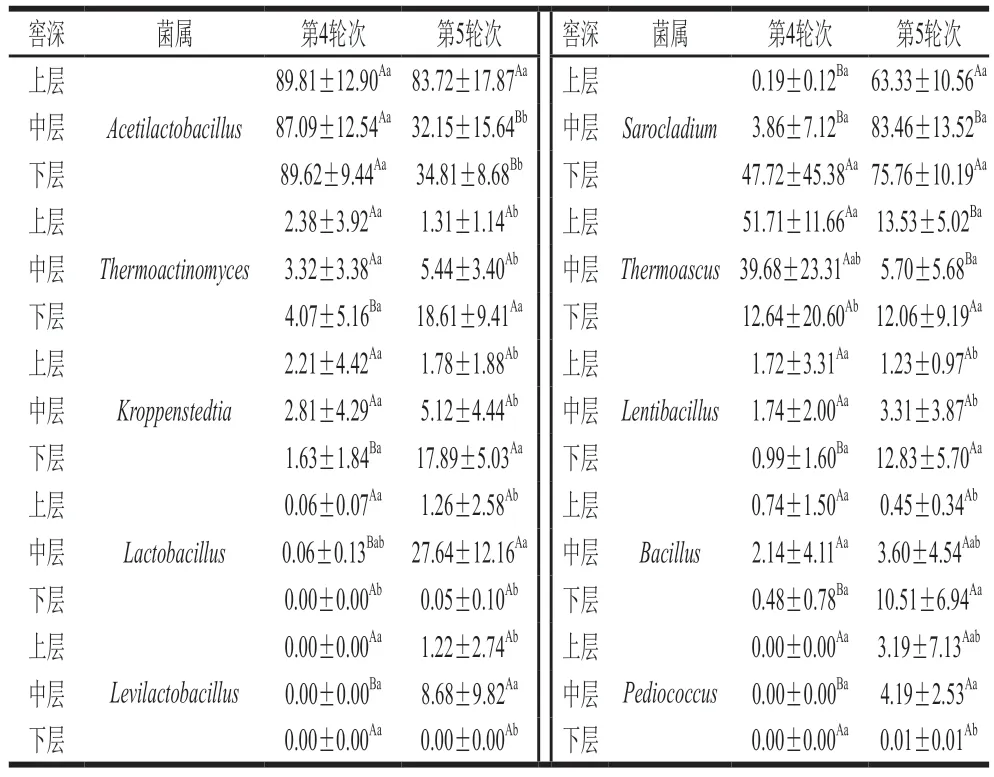
表2 不同轮次和分层酒醅属水平的比较分析Table 2 Comparative analysis of bacterial and fungal communities at genus level in different rounds and layers of alcoholic fermentative material
由表2可知,酒醅的15 个优势菌属中有10 个菌属在不同轮次或分层中存在显著差异(P<0.05),其中8 个为细菌属,2 个为真菌属。进一步分析发现,优势菌属在第4轮次的不同分层中存在较大差异,在第5轮次的不同分层中差异较小。同时,本研究亦发现,优势细菌属的相对丰度在酒醅的上层均差异不显著(P>0.05),差异主要集中在酒醅中层和下层,而优势真菌属的差异则主要集中在酒醅上层和中层。
2.4 不同分层和轮次微生物多样性差异分析
在解析第5轮次酒醅中微生物构成的基础上,本研究进一步对微生物的多样性进行比较分析,以进一步解析不同轮次和分层中微生物菌群结构的差异,其比较结果如图3所示。
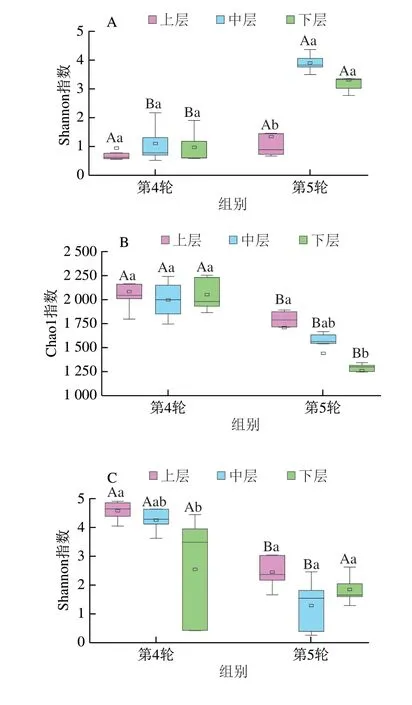
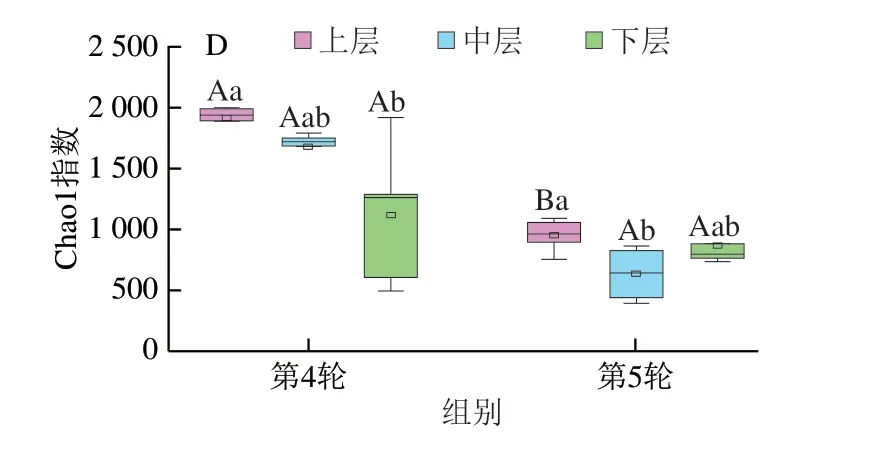
图3 不同轮次和分层酒醅微生物α多样性指数比较分析Fig.3 Comparative analysis of bacterial and fungal α-diversity indexes in different rounds and layers of alcoholic fermentative material
由图3A、B可知,第5轮次上层酒醅细菌群落的Shannon指数显著低于中层和下层(P<0.05);而Chao1指数显著高于下层(P<0.05),但与中层无显著差异(P>0.05)。由图3C、D亦可知,第5轮次不同分层酒醅中真菌群落的Shannon指数无显著差异(P>0.05),而上层真菌微生物的Chao1指数显著高于中层和下层(P<0.05)。值得注意的是,本研究在第4轮次上并没有发现类似的规律,且第4轮次不同分层酒醅细菌群落的Shannon指数和Chao1指数均无显著差异(P>0.05)。对比第4、5轮次中微生物的多样性发现,不同分层的微生物群落的Shannon和Chao1指数亦存在较大差异。本研究进一步基于加权Uni-Frac距离对不同轮次和分层的酒醅微生物群落结构进行主坐标分析,结果如图4所示。

图4 基于Uni-Frac距离的不同轮次和分层酒醅微生物主坐标分析Fig.4 PCoA plots of microorganisms in different rounds and layers of alcoholic fermentative material based on Uni-Frac distance
由图4A可知,第4轮次酒醅样本几乎全部位于X轴负半轴,而第5轮次酒醅样本则几乎全部位于X轴正方向,两者在二维空间上呈现明显的分离趋势。对比不同分层酒醅发现,第4轮次不同分层酒醅中微生物的群落结构较为相似,而第5轮次则呈现相反的趋势。由图4B可知,第4、5轮次酒醅样本分别位于X轴的负方向和正方向,两者呈完全分离趋势。但与图4A所不同,第4轮不同分层酒醅样本较为分散,而第5轮不同分层酒醅样本较为集中。由此可见,不同轮次酒醅中微生物结构存在较大的差异。
2.5 微生物群落与理化指标间关联分析
为探究酒醅微生物对其品质的影响,本研究采用Spearman秩相关性分析对酒醅中优势菌属与理化特性及感官品质进行了解析,相关性分析结果如图5所示。
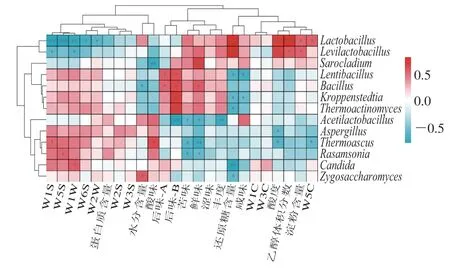
图5 不同分层酒醅中理化指标、感官品质与优势菌属的相关性分析Fig.5 Correlation analysis of physicochemical and sensory quality and dominant microbial genera in different layers of alcoholic fermentative material
由图5可知,第5轮次酒醅中的优势菌属与其各品质指标间存在这较为复杂的相关关系。水分含量与Bacillus显著负相关(P<0.05),而与Zygosaccharomyces显著正相关(P<0.05);酸度、乙醇体积分数和淀粉含量均与Lactobacillus及Levilactobacillus显著正相关(P<0.05);酒醅中还原糖含量与微生物的相关关系较为复杂,其与Lactobacillus及Levilactobacillus显著正相关(P<0.05),而与Lentibacillus、Kroppenstedtia和Thermoactinomyces、Candida和Zygosaccharomyces显著负相关(P<0.05)。进一步分析发现,Lactobacillus与W1S、W5S、W1W、W6S和W2W显著负相关(P<0.05),而与W5C显著正相关(P<0.05);Acetilactobacillus、Thermoascus和Rasamsonia与苦味显著负相关(P<0.05),而Lentibacillus、Bacillus、Kroppenstedtia和Thermoactinomyces与后味-B显著正相关(P<0.05)。
3 讨论
酒醅作为酱香型白酒发酵的重要基质,对其品质的好坏具有决定作用[26]。相关研究已经证实第4、5轮次酒醅所发酵的基酒品质最佳[6]。本研究团队在前期针对同一窖池第4轮次不同分层酒醅中的微生物和感官理化性质进行了分析,发现同一窖池不同空间分布酒中下层酒醅微生物及风味组成更为独特[14]。在此基础上,本研究针对酱香白酒第5轮次窖池不同分层酒醅展开了进一步研究。
尽管同一窖池不同分层酒醅中的温度和水分等环境因素存在较大差异[10],但菌落总数、乳酸菌数、酵母菌和霉菌数均无明显差异,这与第4轮次检测结果存在较大的差异[14],这可能与窖池深度和发酵轮次有关[27]。在理化指标上,第5轮次中层和下层的差异较大,中层酒醅的酸度、乙醇体积分数、淀粉含量和还原糖等指标均高于下层,而上述指标均与微生物的生长存在密切的关系,且微生物亦可通过自身代谢影响其含量。因此,许多经验丰富的酿酒师可以通过上层指标判断发酵进程和基酒的品质[28]。随着窖池深度的增加,酒醅的水分含量呈现明显下降趋势,这与酒醅的发酵温度密切相关。酒醅下层的温度较高,上层温度较低,这使得水分向上迁移,而水分含量和温度的差异可能直接导致酒醅菌群结构存在较大的差异。进一步分析发现中层和下层酒醅的滋味品质较为相似,而上层酒醅较为独特,而值得注意的是,上层酒醅的苦味和苦的回味较淡。在风味方面,上层和中层酒醅整体较为接近,与下层差异较大,但不同分层在芳香味上均无明显关系,而有研究表明白酒的芳香味的陈酿有关[29]。由此可见,第5轮次不同分层酒醅中理化和感官品质之间均存在较大差异。
测序结果显示第5 轮次酒醅中的优势菌属分别为Acetilactobacillus、Lactobacillus、Sarocladium和Thermoascus等,与前人的研究一致[30]。相关研究证实Acetilactobacillus、Lactobacillus和Thermoascus可积极参与白酒的发酵进程,且Acetilactobacillus和Lactobacillus对于白酒的香味形成具有积极作用[30]。通过对不同轮次和分层酒醅中的差异菌属进行甄别发现优势菌属在第4轮次的不同分层酒醅中存在较大差异,但在第5轮次酒醅中差异较小。值得注意的是,大部分优势菌属在第5轮次的酒醅中富集,其相对丰度明显高于第4轮次。在α多样性方面,不同轮次之间亦存在较大差异,但第4轮次不同分层之间差异较小,而第5轮次不同分层之间差异较大。同时,在β多样性亦发现相同的规律。由此可见,不同轮次中微生物构成和分布规律存在较大的差异,而上述差异可能导致基酒的品质的不稳定。因此,为保证基酒品质的稳定,针对不同轮次对工艺进行调整十分必要。
相关性分析进一步证实了微生物在生态中存在的积极作用,由于不同发酵条件的差异使得微生物的构成存在明显的差异。相关研究证实,复杂生态环境中大部分微生物功能会存在“冗余”现象[31],这也导致尽管不同酒醅中微生物结构存在一定差异,但酒醅的已知可测诸多属性基本相同。本研究中第5轮次不同分层酒醅理化感官品质之间存在较大差异,这可能是由部分微生物的特殊功能相关[9]。
4 结论
本研究发现,第5轮次酒醅发酵的白酒品质较佳,不同分层酒醅的理化指标、微生物生长等存在差异。在后续研究中应进一步扩大酒醅的采样范围和数量,并结合纯培养、宏基因组学和全基因组学技术进一步解析微生物在酱香型白酒多轮次发酵过程中的积极作用,以持续揭示传统工艺、功能微生物群落演替、原酒品质之间的内在规律,为工艺创新和原酒品质提升奠定必要基础。
