浓香型大曲贮存期微生物群落演替及代谢产物的变化机制
2023-12-14徐千惠饶家权邹永芳罗惠波
徐千惠,饶家权,邹永芳,张 明,罗惠波,3,黄 丹,3,*
(1.四川轻化工大学生物工程学院,四川 自贡 643000;2.舍得酒业股份有限公司,四川 射洪 629000;3.酿酒生物技术及应用四川省重点实验室,四川 自贡 643000)
大曲作为糖化发酵剂,为白酒酿造提供了重要且丰富的菌系、酶系和物系,即为后续窖内酒醅发酵提供微生物,将原料降解成小分子物质的水解酶或催化酯类物质合成的酯化酶,以及白酒风味物质或其前体物[1]。大曲生产过程通常包括1 个月左右的主发酵期和2~6 个月左右的贮存期[2]。在主发酵期,来自于制曲原料及环境的微生物生长代谢,通过开关门窗、揭盖草帘进行工艺调控,其间,温度、湿度等不断变化,微生物菌群发生演替,同时积累了丰富的酶系以及风味物质[3]。而在贮存期,大曲大多是在自然条件下堆积存放[4],期间水分、酸度和淀粉的变化相对稳定[5],初级、次级代谢过程以及各种微生物和代谢物发生复杂变化[6]。目前对大曲质量的判断主要依赖于长期积累的生产经验和部分理化性质,这使得大曲的生产质量充满不稳定性[2]。近年来,关于大曲主发酵期间微生物群落及功能变化机制的研究非常活跃[7-9],而贮存期大曲微生物群落结构、酶系以及风味物质变化也越来越受到关注。Fan Guangsen等[2]通过高通量测序技术发现大曲在通风良好、干燥的贮存环境中微生物会进一步相互作用,达到优化微生物群落的效果,同时发现清香型大曲经贮存后酯化力和发酵力增加,而液化力和糖化力变化不大。He Muwen等[10]采用顶空固相微萃取-气相色谱-质谱(headspace-solid phase microextraction-gas chromatography mass spectrometry,HS-SPME-GC-MS)联用技术测定贮存期大曲挥发性代谢产物,发现风味物质种类逐渐积累,在贮存3 个月含量达到最高,而Zhang Yuandi等[11]发现贮存使挥发性化合物的种类和含量有所下降。总之,现有研究显示贮存过程对大曲质量具有重要影响,但关于贮存期大曲微生物群落结构及代谢产物变化机制的研究鲜有报道。
对于微生物群落的演替机制,人们广泛认可随机性过程和确定性过程同时影响菌群的组装过程[12]。Tan Yuwei等[13]采用构建零模型的方法评估了白酒发酵过程中微生物群落的组装模式,结果显示微生物群落的演替既受确定性因素(温度、有机酸和乙醇)的驱动,也受随机性过程的驱动。Xu Min等[14]发现微生物的生态位差异也影响着群落的构建过程。大曲代谢物的变化被发现与微生物群落的演替紧密相关[6]。Gan Shuheng等[4]通过宏基因组测序获得了糖化力、液化力与杆菌纲、曲霉属、罗山松属和散囊菌目间的正相关关系。He Muwen等[10]采用相关性网络分析挥发性化合物与微生物之间的关联,结果显示,曲霉属、根毛霉属、芽孢杆菌属、横梗霉属与酯类的形成呈正相关。
对于固态发酵基质而言,热量、水和氧气难以传递,Zhang Yuandi等[11]发现同一块大曲不同部位的微生物群和挥发性物质具有不同的分布特征,因此大曲曲心和曲皮的微生物生长代谢存在差异。本研究旨在通过高通量测序解析浓香型大曲的曲心和曲皮在贮存期间发生的微生物群落结构变化,并分析糖化酶、液化酶活力的变化,利用HS-SPME-GC-MS研究挥发性代谢产物的差异,构建零模型解析微生物群落的组装过程,运用相关性分析探究糖化力、液化力、风味物质与大曲微生物之间的联系,揭示浓香型大曲贮存期菌系、酶系以及物系的变化机制,为优化大曲贮存工艺、提高大曲质量提供理论依据。
1 材料与方法
1.1 材料与试剂
大曲由遂宁市某浓香型白酒厂提供。
E.Z.N.A.®Soil DNA Kit 美国Omega BioTek公司;2-辛醇(色谱纯)美国Sigma公司;其他试剂均为国产色谱纯或分析纯。
1.2 仪器与设备
离心机 德国Eppendorf股份公司;Nano Drop 2000紫外分光光度计 美国Thermo Fisher Scientific公司;50/30 μm DVB/CAR/PDMS固相微萃取头 美国Supelco公司;7890A/5975B GC-MS联用仪 美国Agilent公司。
1.3 方法
1.3.1 样品采集
每块大曲约4 kg,被分为两个部分:1.5 cm厚的外层命名为曲皮(QP),其余的内层命名为曲心(QX)[15]。分别于不同贮存时期(0、9、43、108、161 d)在曲库的对角线两端及中点处各选取一块大曲,将这3 块大曲的曲皮、曲心迅速粉碎后分别混合,密封在无菌袋中,于-80 ℃冰箱中保存。
1.3.2 DNA提取和高通量测序
准确称取7 g大曲,用E.Z.N.A.®Soil DNA Kit试剂盒提取大曲微生物DNA,用Nano Drop 2000紫外分光光度计测定其纯度与浓度。使用引物338F/806R(5’-ACTCCTACGGGAGGCAGCAGAG-3’/5’-GGACTACHVGGTWTCTAAT-3’)扩增细菌16 SrRNA 基因的V3~V4 可变区,用引物ITS1f/2043R(5’-CTTGGTCATTAGGAAGA-3’/5’-GCTGCGTTCTTCATC GATGC-3’)扩增真菌rRNA基因的ITS1区[16],采用Illumina平台进行双端测序[15]。
1.3.3 酶活力的测定
糖化力和液化力根据Zhang Yuting等[17]的方法进行测定。糖化力为1 g大曲在1 h内将可溶性淀粉转化为葡萄糖的毫克数;液化力为1 g大曲在1 h内液化淀粉的克数。
1.3.4 挥发性代谢产物的测定
称取2 g样品加到20 mL顶空瓶中,再加入2 g NaCl和50 μL质量浓度为10 mg/L的2-辛醇。将50/30 μm DVB/CAR/PDMS固相微萃取头插入顶空瓶于50 ℃条件下萃取吸附30 vmin。取出萃取头插入GC仪进样口,在250 ℃条件下解吸5 min,采用陈莹琪等[16]的方法进行GC-MS检测分析。
1.4 统计分析
测序原始序列通过DADA2进行质控操作,基于100%的序列相似性聚类得到特征序列。采用RStudio 4.1.3进行主坐标分析(principal co-ordinates analysis,PCoA)、α多样性分析、Venn图绘制、群落的平均最近分类单元指数(beta-nearest taxon index,βNTI)计算、修正Raup-Crick指数(RCbray)计算、生态位宽度计算、冗余分析(redundancy analysis,RDA)、Spearman相关性热图绘制。
2 结果与分析
2.1 浓香型大曲贮存过程中微生物群落结构变化
2.1.1 浓香型大曲贮存过程中优势微生物群落演替特征大曲微生物在持续进行的贮存过程中此消彼长,采用高通量测序技术对其演替情况进行解析。在大曲贮存期间共注释到16 个细菌门和4 个真菌门,212 个细菌属和30 个真菌属,其中将平均相对丰度前10的优势微生物属变化情况绘制成柱形图展示。由图1a可知,曲皮在入库贮存第0天的主要优势细菌是芽孢杆菌属(Bacillus)(23.69%)、假单胞菌属(Pseudomonas)(26.58%)、魏斯氏菌属(Weissella)(20.94%)等,这种优势地位到了贮存第43天被链球菌属(Streptococcus)(33.31%)、放线菌属(Actinomyces)(18.83%)取代。贮存第43~108天,魏斯氏菌属迅速生长成为绝对优势细菌(1.41%~63.08%)。贮存第108天和第161天的曲皮细菌组成较为相似,这与唐贤华等[18]得出的贮存期导致大曲微生物种类趋于平稳的研究结论一致。并且有研究结果可以解释这一现象:贮存过程中温度、水分、酸度等环境条件的变化会导致大曲微生物之间进一步相互作用,使群落结构趋于相似,最终形成一种稳定体系[19]。而在曲心,贮存前43 d的细菌组成较为一致,由芽孢杆菌属、克罗彭斯特菌属(Kroppenstedtia)、高温放线菌属(Thermoactinomyces)、假单胞菌属、葡萄球菌属(Staphylococcus)等组成。假单胞菌属的相对丰度最高,呈明显的上升趋势(15.84%~76.70%),而芽孢杆菌属在持续下降(43.24%~9.23%)。葡萄球菌属在贮存前9 d的含量较为丰富(12.73%~10.74%),随后立即让位给其他细菌,在贮存第108~161天的相对丰度保持在0.42%~1.67%。随着贮存时间的延长,除了芽孢杆菌属的相对丰度在10%左右波动外,其余在贮存开始时呈明显优势的细菌都在衰减,而乳杆菌属(Lactobacillus)、放线菌属、链球菌属、肠球菌属(Enterococcus)等相对丰度增加,这种变化与Jin Yao等[20]的发现一致。由图1b可知,曲皮和曲心在贮存过程中的真菌皆以嗜热子囊菌属(Thermoascus)为主,其相对丰度在曲皮和曲心中的变化规律大体一致,均从一个极高的相对丰度(96.89%、93.29%)波动下降。其次是曲霉属(Aspergillus),在贮存第0天几乎没有,而后大量生长,但不同的是从贮存第9天开始,曲霉在曲心中总体呈波动上升趋势(22.17%~30.35%),而在曲皮中呈快速下降趋势(60.82%~2.41%)。毕赤酵母属(Pichia)在曲心中的相对丰度很低(0%~0.96%),但在曲皮中却大量生长,是曲皮在贮存第108天的绝对优势真菌(68.89%)。
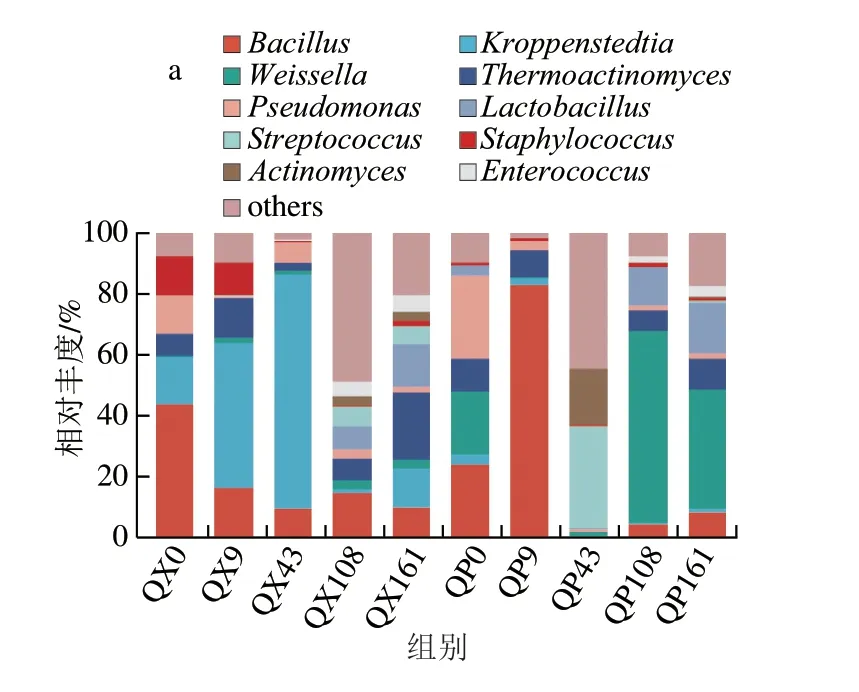
图1 大曲贮存过程中优势细菌(a)和真菌(b)在属水平的相对丰度Fig.1 Relative abundance of dominant bacteria (a) and fungi (b) at genus level during Daqu storage
总体看来,大曲贮存过程使曲皮中的魏斯氏菌属、乳杆菌属、毕赤酵母属和曲心中的高温放线菌属、魏斯氏菌属、乳杆菌属、链球菌属、曲霉属的相对丰度得到了极大提高,同时使曲皮和曲心中的芽孢杆菌属、假单胞菌属、嗜热子囊菌属等的相对丰度下降。此外,曲皮中others的变化情况显示了大曲中一些原本的极低丰度微生物可能由于适应曲库的环境条件以及微生物之间友好的相互关系而大量生长,同时一些微生物因为适应性差而走向衰竭[10,19]。这些结果都表明贮存使大曲微生物间相互作用重新平衡[6],改变了微生物群落组成。
2.1.2 浓香型大曲贮存过程中菌群结构特征的变化
不同贮存时间的大曲微生物α多样性指数如图2所示。Chao1指数反映物种的丰富度,大曲贮存前43 d的微生物丰富度相差不大,随着贮存时间的延长,曲心中细菌的Chao1指数在贮存第108天增长至最大,而真菌的Chao1指数在第43天达到最高值后减小。总体看来,贮存过程使大曲微生物的丰富度略有降低。Pielou’s evenness指数表征均匀度,在大曲贮存期间,微生物群落的均匀度呈现先增加再减少的趋势。贮存第161天的细菌群落均表现出稍稍低于贮存第0天的均匀度,而真菌群落的均匀度总体增加,表明贮存过程塑造了更为均匀的真菌群落[21]。Shannon指数反映物种多样性,大曲的物种多样性与均匀度的变化趋势较为相似,总体上贮存过程增加了大曲的微生物多样性。
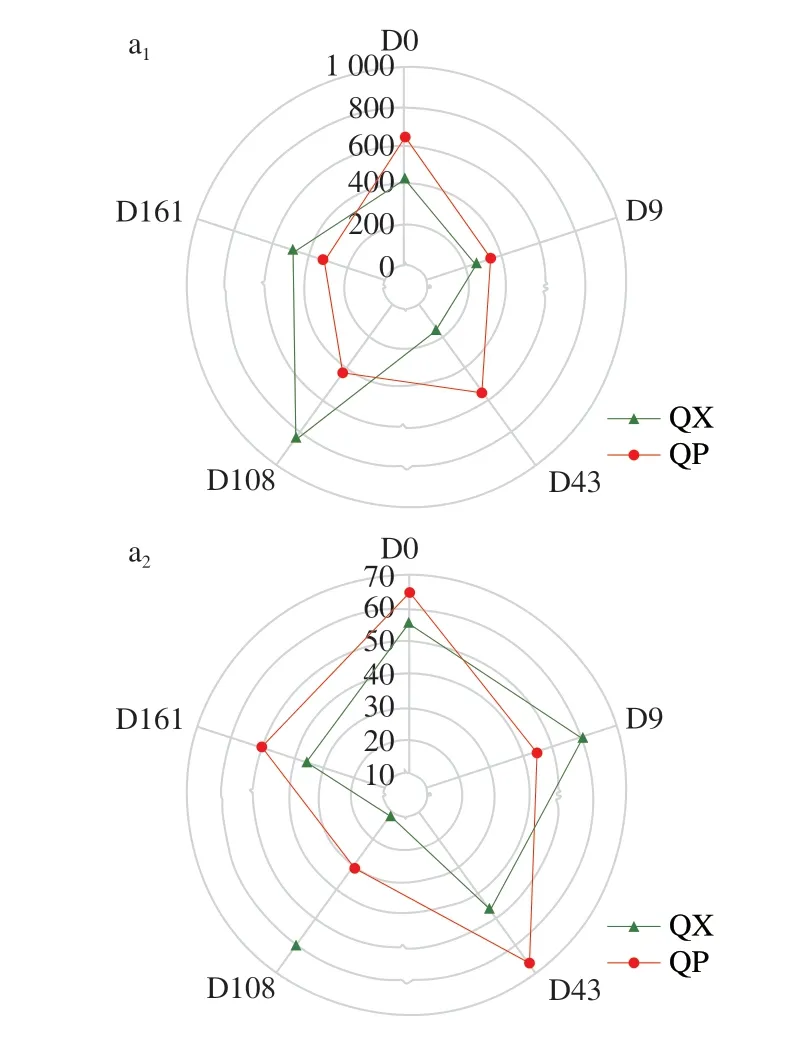
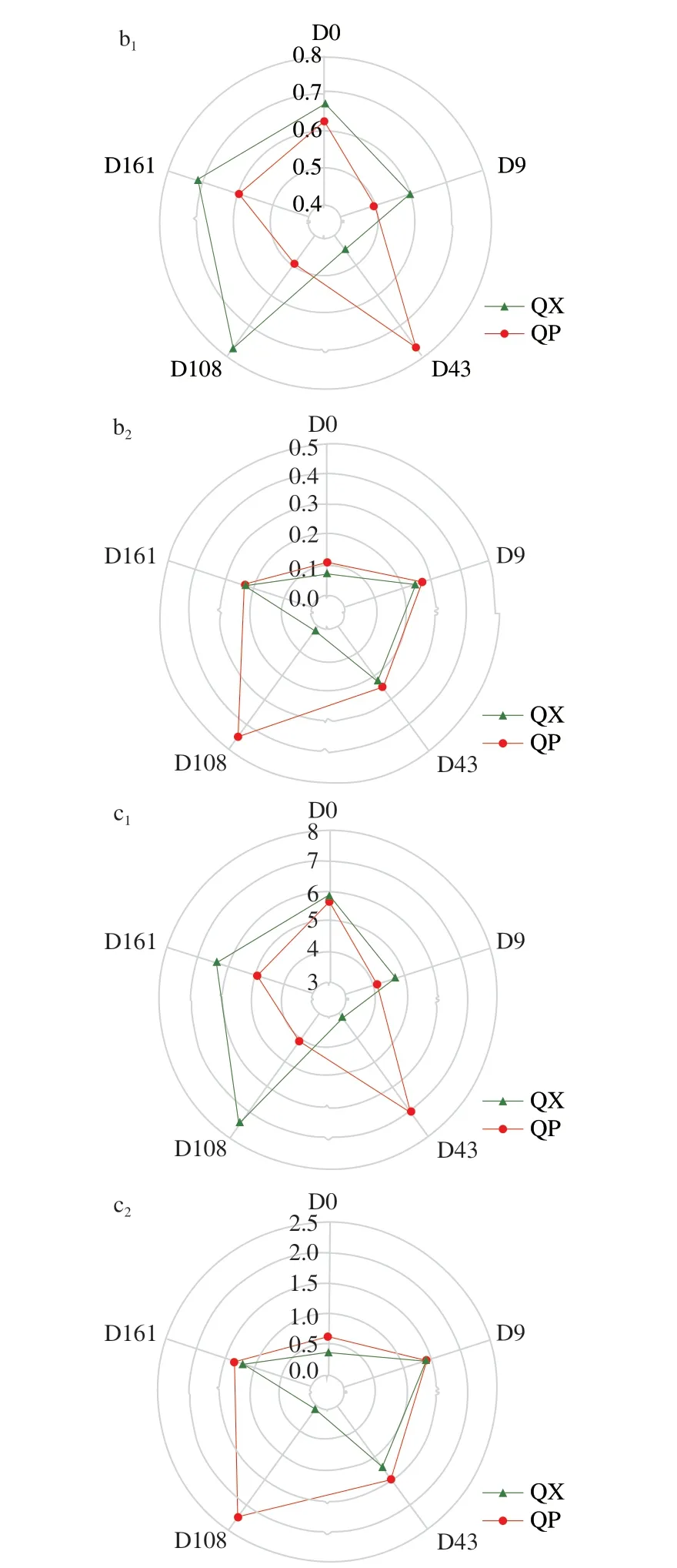
图2 大曲贮存过程中微生物的α多样性指数Fig.2 Microbial α-diversity indexes during Daqu storage
为探究大曲贮存过程中微生物群落结构的变化,对大曲样品进行PCoA。由图3a可知,PC1和PC2对细菌群落组成差异的解释度分别为29.63%和22.15%,共计51.78%。贮存前43 d的曲心细菌结构相近,但曲皮细菌样本相互分离较远,说明贮存前43 d内曲皮细菌结构发生了明显变化。贮存第108、161天曲心和曲皮的细菌样本各自聚在一起,表明大曲贮存3 个月后,细菌结构已经趋于稳定,这与以往的研究一致[4,19]。如图3b所示,PC1和PC2对真菌群落组成差异的解释度分别为53.02%和41.79%,总解释度高达94.81%。曲心的真菌结构总体距离相近,说明曲心真菌结构在贮存过程中变化不大,并且与贮存第0、43、161天的曲皮真菌结构相似性较高,但分别与曲皮在第9、108天的真菌结构相差甚远。为进一步了解大曲贮存期间微生物群落结构,Venn图展示了不同贮存时期间的共有微生物及特有微生物数量。如图4所示,在属水平上,曲皮、曲心在5 个贮存时期分别有13、14 个共有物种,其中绝大部分如曲霉属、芽孢杆菌属、乳杆菌属、毕赤酵母属、魏斯氏菌属等都属于图1中的优势菌属,但它们在贮存不同时期的相对丰度各不相同。曲皮和曲心在每个贮存时期的特有物种数量总和分别占53%和50%,表明大曲贮存过程中的微生物差异由一半的共有物种的丰度差异和一半的特有物种的物种差异组成[4]。这些结果同样表明一些原本的极低丰度微生物可能会随着贮存的进行大量生长,同时一些微生物丰度降至极低,也有研究显示部分特有低丰度微生物来自贮存环境[4]。

图3 大曲贮存过程中细菌(a)和真菌(b)样本的PCoAFig.3 PCoA plots of bacterial (a) and fungal (b) samples during storage of Daqu
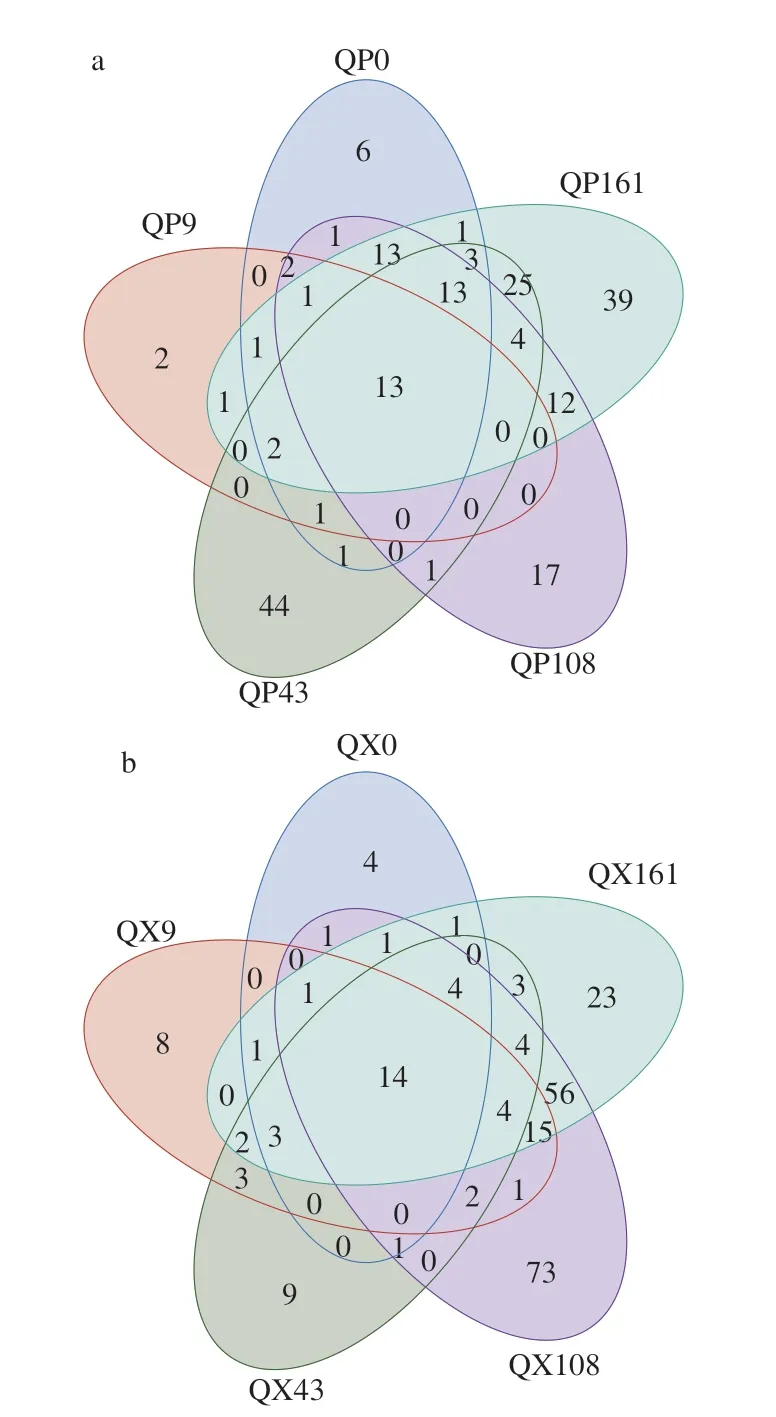
图4 大曲贮存过程中曲皮(a)和曲心(b)的物种个数Venn图Fig.4 Venn diagram for the number of microbial species on (a) and in (b)Daqu during storage
2.2 浓香型大曲贮存过程中糖化力和液化力的变化
糖化酶是微生物代谢产生的重要酶类,能将酿酒原料中的淀粉、纤维素等多糖降解为还原糖,再由酵母等微生物进一步转化为乙醇[10,22],因此糖化力是大曲重要的生化指标。由图5a可知,曲皮糖化力在贮存前108 d先上升后下降(272、398、107 mg/(g·h)),在贮存第108~161天内大幅回升(107~256 mg/(g·h))。而曲心糖化力在48~187 mg/(g·h)之间呈现比较规律的波动。液化酶能断裂淀粉分子的α-1,4-糖苷键生成糊精等中间产物[23]。图5b所示的曲皮液化力在贮存第0~43天内略有降低(0.37~0.12 g/(g·h)),从贮存第43天开始持续增加至贮存结束(0.12~0.30 g/(g·h))。曲心液化力在贮存前43 d内维持在0.08 g/(g·h),之后快速上升并稳定在0.27~0.21 g/(g·h)。总体看来,与以往的研究一致[10,23],糖化力和液化力在贮存约43 d内呈下降趋势,随后整体回升。曲皮的糖化力和液化力均在贮存后略微降低,而曲心中的二者在贮存后升高。有研究表明,大曲在贮存初期具有较高的液化和糖化活性,且二者往往呈正相关,后来酶活性降低,转变为较高的酯化活性[2],这与贮存后期酯类物质含量快速增加有关。

图5 大曲贮存过程中糖化力(a)和液化力(b)的变化Fig.5 Changes in saccharification power (a) and liquefaction power (b) of Daqu during storage
2.3 浓香型大曲贮存过程中挥发性代谢产物的变化
大曲中的风味物质可以作为酒体中香气物质的直接来源,也可作为酒中香气物质的重要前驱物来源[20]。采用HS-SPME-GC-MS分别在贮存过程的曲心和曲皮位置检测到67、70 种挥发性化合物,可分为醇类、酯类、酚类、酸类、醛酮类、烷烯类、吡嗪类和其他物质。由图6可知,曲皮中风味物质的总含量随着贮存时间呈现先下降后上升再下降的变化趋势,其中在贮存约3 个月时总含量达到最高,这在其他报道中也有同样的发现[10],相比之下,曲心中的风味物质含量总体较为稳定,仅在贮存结束时发生了较大的下降。酯类物质是中国白酒中令人愉悦的水果、花香、蜂蜜香气的主要贡献者[6],是贮存期间占比最大的挥发性风味物质,令人注意的是其在曲皮贮存第108天时发生了激增,与前述微生物群落演替结果相结合,推测这种变化可能与魏斯氏菌和毕赤酵母的剧烈增加有关。据报道,魏斯氏菌发酵产生乳酸,为乳酸乙酯的合成提供前体物质,毕赤酵母能利用蔗糖和葡萄糖制造乙酸乙酯等芳香化合物,二者均在酯化过程中发挥重要作用[24]。醇作为酸和酯的重要前体物质,其含量仅次于酯类,在贮存期间变化幅度不大。酸类、烷烯类、醛酮类物质的变化比较一致,表现为贮存初期有较高的含量,之后迅速下降,并在之后的贮存期间保持非常低的含量。总体上,贮存过程使风味物质总含量减少,这与Zhang Yuandi等[11]的研究结果一致。其中醇类物质、酯类物质略微降低,酸类物质、烷烯类物质、醛酮类物质大量减少。结果表明随着贮存时间的推移,一些重要的风味化合物被丰富,一些异杂味被减少或去除[23],同时伴随着部分风味物质的挥发[6,11],说明贮存过程有助于“净化”风味[25]、形成独特浓郁的“大曲味”[2]。
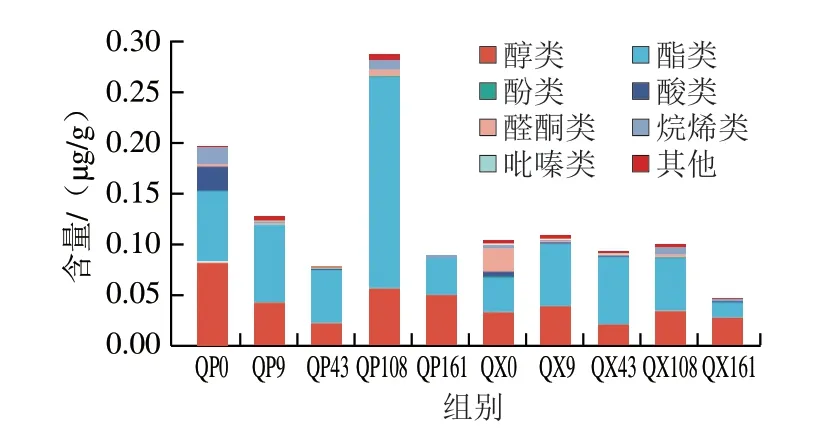
图6 大曲贮存过程中各类挥发性代谢产物的变化Fig.6 Changes of volatile metabolites in Daqu during storage
2.4 浓香型大曲贮存过程中微生物群落的演替机制
为探究大曲贮存过程中微生物群落结构的变化原因,采用系统发育零模型计算大曲微生物群落的βNTI来判断群落的构建过程[14]。如图7a所示,曲皮细菌群落的βNTI值在-1.12~5.05之间变化,曲心细菌在-1.28~5.55之间变化,二者的|βNTI|>2的占比均为40%,说明细菌群落的组装过程主要受60%的随机性过程影响,同时受40%的确定性过程影响。曲皮真菌群落的βNTI值在-0.64~3.61之间波动,其|βNTI|>2的比例为20%,说明曲皮真菌群落受随机性过程主导(80%)。而曲心真菌仅在-1.52~1.76之间波动,说明其完全受随机性过程影响(100%)。总体上,大曲贮存期间微生物群落的组装主要由随机性过程主导。相较于真菌来说,细菌受确定性过程的影响更大;相较于曲心微生物来说,曲皮微生物受确定性过程的影响更大。

图7 大曲贮存过程中微生物群落的构建过程(a)和各个生态过程对群落构建的贡献程度(b)Fig.7 Development of microbial community during Daqu storage (a),and contribution of each ecological process to microbial community development (b)
为了进一步量化随机性和确定性过程在贮存期大曲微生物群落构建中的贡献程度,图7b显示了群落的修正RCbray[14]。结果表明无论是曲皮还是曲心,对细菌群落构建的影响因素包括40%的变量选择(环境因子、微生物相互作用等)、40%的扩散限制以及20%的未定义过程(生态漂变等)。而真菌群落则大部分受未定义过程的影响(曲皮70%、曲心90%),说明主要由生态漂变等导致真菌结构发生随机变化。变量选择对曲皮真菌群落构建的贡献为30%,但对曲心真菌的贡献为0。匀质扩散只在曲心真菌群落构建过程中发挥了一定作用(10%),这种生态过程会导致群落结构的相似性[26]。而对于细菌群落来说,相对稳定的贮存环境可能导致扩散限制较大地影响了细菌在曲库中的扩散。有研究表明,真菌群落在曲心中倾向于随机分散,而细菌群落则偏好聚集状态[20]。结果表明,变量选择对微生物菌群(尤其是曲皮中)发挥较大的作用,说明贮存条件的改变及微生物间的相互作用对群落演替十分重要[26]。而目前的生产中,贮存期间几乎都未采取人工调控温湿度等措施,使气候条件成了重要因素[4],可见在大曲贮存期实施工艺调控对稳定大曲质量具有重要意义。
大曲贮存过程中微生物的生态位宽度如图8所示。曲心细菌和曲皮真菌在贮存第108天和曲皮细菌在贮存第43天时的生态位宽度发生激增,说明这时候微生物对环境资源的利用程度大大增加,这一时期的变化与图1中优势菌群结构发生剧烈演替相符合。对比贮存前后的生态位宽度,结果显示除了曲皮细菌外,其余菌群的生态位宽度经贮存后都增加,说明贮存使大曲微生物对环境资源的利用增加,对微生物间相互作用的适应状况更好[27]。贮存过程中不同时期的大曲微生物占据着不同的生态位,显示了对环境扰动的不同响应[28],这种响应是由其生理耐受性、扩散能力、分类多样性和功能多样性等共同介导[29-30],因此贮存期大曲微生物群落不同的组装过程可能是受到微生物群对环境干扰的不同响应和生态位宽度的差异所影响[14]。此结果与零模型的分析结果一致反映了贮存环境对大曲微生物生长代谢的重要性。
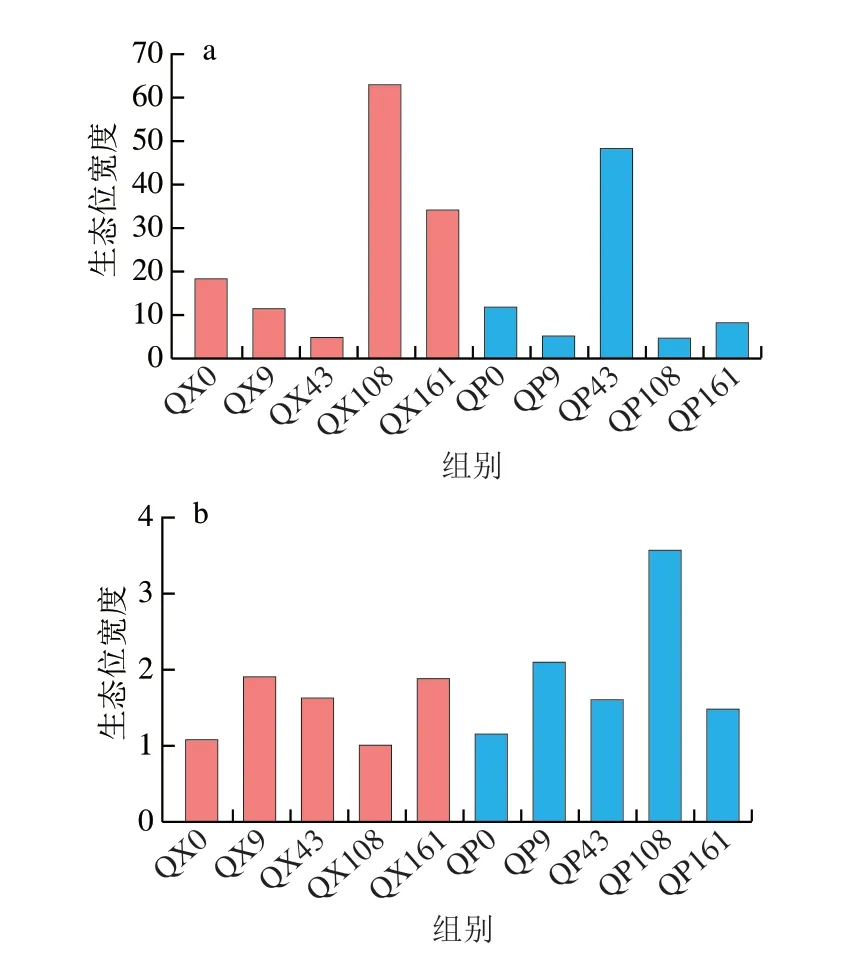
图8 大曲贮存过程中细菌(a)和真菌(b)的生态位宽度变化Fig.8 Variations in niche width of bacteria (a) and fungi (b) during Daqu storage
2.5 浓香型大曲贮存过程中重要酶活力与微生物群落演替的相关性
贮存期间大曲微生物群落不断变化,并通过代谢活动引起酶活力的变化[6]。通过RDA探究两种重要酶活力与大曲微生物间的关联,其中RDA1和RDA2(加权)标准正交物种得分大于0.09的菌属见图9[4]。如图9a所示,曲皮中,糖化力与嗜热子囊菌属呈负相关,与毕赤酵母属、魏斯氏菌属、乳杆菌属、芽孢杆菌属和曲霉属呈正相关。贮存第108天和第161天的曲皮样本与液化力极为相关,其中属毕赤酵母属、魏斯氏菌属、乳杆菌属贡献最大。由图9b可知,曲心中的糖化力和液化力均与科萨克氏菌属(Kosakonia)呈负相关,与嗜热子囊菌属、曲霉属呈强正相关,相比之下,与嗜热真菌属(Thermomyces)、高温放线菌属的正相关性较弱。结果显示,毕赤酵母属、魏斯氏菌属、乳杆菌属、嗜热子囊菌属、曲霉属等微生物通过代谢作用有助于提高糖化酶、液化酶活力。一些研究报道了嗜热子囊菌属、曲霉、根毛霉属及芽孢杆菌属等大曲核心微生物具有强大的水解能力,有助于淀粉的液化和糖化,为后续风味化合物的形成打下基础[31-32]。
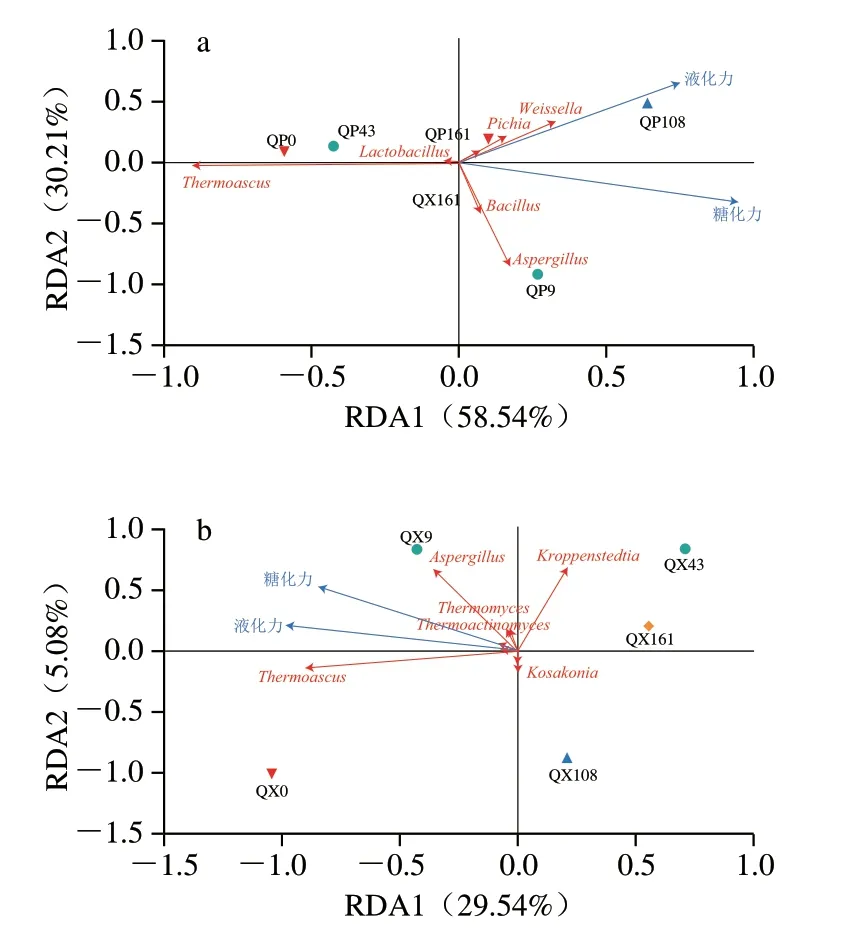
图9 大曲贮存过程中糖化力、液化力与曲皮(a)和曲心(b)微生物的RDAFig.9 RDA of saccharification power,liquefaction power and microorganisms on (a) and in (b) Daqu during storage
2.6 浓香型大曲贮存过程中挥发性风味物质与微生物群落演替的相关性
为探究大曲贮存期间挥发性风味物质的变化机制,利用Spearman相关性分析评估挥发性化合物与微生物的关联[6]。如图10a所示,曲皮中一些酯类物质如9-十六碳烯酸乙酯、肉豆蔻酸乙酯、十六酸乙酯、十八烯酸乙酯与根霉属(Rhizopus)、威克汉姆酵母属(Wickerhamomyces)等呈显著负相关。乙酸乙酯与黄杆菌属(Flavobacterium)、假单胞菌属呈显著正相关,与放线菌属、链格孢属(Alternaria)、棒状杆菌属(Corynebacterium)、梭杆菌属(Fusobacterium)等呈显著负相关。并且苯乙醇也和这些菌属呈显著负相关,而与假单胞菌属、克罗彭斯特菌属呈显著正相关。乙醇、正戊醇、2,3-丁二醇聚为一类,与醋杆菌属(Acetobacter)、链霉菌属(Streptomyces)呈极显著正相关。有研究显示,大曲中的苯乙醇、戊醇等高级醇可能是通过Ehrlich代谢途径的氨基酸分解代谢形成,也可能是由一些微生物菌株的脂质氧化形成[33-34]。在曲皮中仅检测到2,5-二甲基吡嗪、2,3,5-三甲基吡嗪两种吡嗪物质,均与假单胞菌属、克罗彭斯特菌属呈显著正相关。如图10b所示,在曲心中检测到了更多吡嗪种类,其中2,5-二甲基吡嗪、2,3,5-三甲基吡嗪与魏斯氏菌属、乳杆菌属、肠球菌属呈显著负相关,与芽孢杆菌属、嗜热子囊菌属呈显著正相关;而2,6-二甲基吡嗪、2,3,5,6-四甲基吡嗪则与微小杆菌属(Exiguobacterium)、短状杆菌属(Brachybacterium)、热杆菌属(Thermobacillus)呈极显著正相关,这与以往的研究一致[20],因此通过调节这些微生物的丰度和活性有助于白酒中作为健康因子的吡嗪含量的提升。据报道,芽孢杆菌通过分泌淀粉酶、蛋白酶、纤维素酶等将淀粉和蛋白质转化为葡萄糖和氨基酸,从而产生挥发性化合物及其前体物质,如吡嗪、芳香族化合物、酚类化合物和有机酸[15],可见芽孢杆菌对大曲的风味和质量有着重要贡献。曲心中辛酸乙酯、癸酸乙酯、十七酸乙酯等与根霉属、克雷伯菌属(Klebsiella)呈显著正相关,与威克汉姆酵母属呈显著负相关。正己酸乙酯与魏斯氏菌属、肠球菌属、乳杆菌属以及一些非优势菌如栖热菌属(Thermus)、克洛氏菌属(Crossiella)等呈显著正相关。总之,大曲贮存过程中挥发性风味物质在很大程度上受到微生物结构及其代谢活性复杂变化的影响,是风味物质挥发[11]和微生物转化共同作用的结果[6],此结果为后续考虑通过物种强化提高大曲风味质量提供一定的理论基础。

图10 大曲贮存过程中挥发性代谢产物与曲皮(a)、曲心(b)中微生物的相关性聚类热图Fig.10 Cluster heatmaps for the correlation between volatile metabolites and microorganisms on (a) and in (b) Daqu during storage
3 结论
本研究利用高通量测序探究浓香型大曲贮存过程中的微生物群落组成及结构特征。结果显示大曲的贮存过程是微生物进一步相互作用并重新平衡群落结构的过程,长时间的贮存改变了功能微生物比例[2],最终导致微生物多样性增加、群落结构趋于稳定、均匀。贮存结束后,成熟大曲的曲心微生物群落主要由芽孢杆菌属、魏斯氏菌属、高温放线菌属、克罗彭斯特菌属、乳杆菌属、嗜热子囊菌属、曲霉属等组成;曲皮微生物主要包括魏斯氏菌属、乳杆菌、高温放线菌属、嗜热子囊菌属、毕赤酵母属等优势微生物。此外研究了糖化力、液化力以及挥发性风味物质的变化规律,发现贮存过程使曲皮中糖化力、液化力有所下降,但在曲心中有所增加,同时有助于风味物质的丰富和转化,这些变化使曲香更加浓郁[10]。通过构建零模型探索微生物群落的组装机制,发现随机性过程主导了群落结构的变化,同时确定性过程也有重要影响,其中变量选择发挥了较大的作用,生态位差异也有一定影响,这一结论还需更多的研究验证。多元统计分析显示微生物区系与大曲糖化力、液化力及挥发性代谢产物之间有显著相关性,说明贮存有助于通过改变微生物群落生产出高质量大曲。
总之,贮存过程对大曲微生物群落结构的重新平衡、酶活力及挥发性代谢产物的积累与转化具有重要意义,这与Fan Guangsen等[6]的研究结果一致。引起这些变化的确定性过程是变量选择,说明大曲贮存期实施工艺调控对稳定大曲质量非常重要。此外,还应对微生物的代谢通路进行分析,进一步完善贮存期间大曲品质的变化机制。本研究对优化大曲的贮存工艺、提高大曲品质具有重要意义。
