柑橘酸腐病菌PacC的生物信息学分析及其响应pH值的表达模式
2023-12-14谭小丽胡近近陶能国欧阳秋丽李茂慧
郑 杰,谭小丽,胡近近,陶能国,欧阳秋丽,李茂慧,李 路
(湘潭大学化工学院,湖南 湘潭 411105)
柑橘作为我国重要的经济作物,种植面积和产量均居世界第一,其风味独特,营养丰富,深受广大消费者的喜爱[1]。但柑橘在采后极易受到指状青霉(Penicillium digitatum)、意大利青霉(P.italicum)、酸腐病菌(Geotrichum citri-aurantii)等采后致病真菌的侵染[2-3]。近年,柑橘酸腐病的发生呈上升趋势,在潮湿多雨季节尤为严重[4-5]。化学防治是防控柑橘酸腐病的主要方法,但常用于柑橘病害防控的杀菌剂如抑霉唑、咪鲜胺等对酸腐病的防控均没有显著效果,目前只有双胍盐类药物对酸腐病菌具有一定的抑制作用[6-7]。因此,深入研究酸腐病菌与柑橘果实在采后贮藏期的互作关系对于酸腐病的防控具有重要意义[8]。
环境pH值对病原真菌的生长发育和代谢具有一定调控作用,而病原真菌对环境pH值也具有一定的适应和调节能力。其中,由转录因子PacC介导的pH值信号响应途径在微生物中广泛存在,调控多种植物病原真菌的环境适应性、次级代谢和致病性[9]。例如,PacC的缺失可以影响果生刺盘孢(Colletotrichum fructicola)的菌丝生长、孢子萌发、附着胞形成及致病力[7];扩展青霉(P.expansum)PacC缺失突变体的生长与分生速率及其对苹果和梨果实的致病力均显著下降,且在pH>6.0时不能产生棒曲霉毒素[10]。目前,酸腐病菌对环境pH值的适应性以及PacC的调控作用还未完全揭示。因此,本研究首先研究不同pH值对酸腐病菌生长的影响,在全基因组水平筛选酸腐病菌PacC序列的信息,对其亲缘关系、基因及其编码的蛋白质结构进行预测,随后测定其在不同pH值以及果实侵染过程中的表达模式,以期为进一步研究柑橘酸腐病菌的致病机理奠定基础。
1 材料与方法
1.1 材料与试剂
酸腐病菌菌株从湘潭大学附近果园中自然腐烂的柑橘果实表面分离纯化得到[11],现保存于湘潭大学生物与食品工程系菌种保藏室。
总RNA提取试剂盒 福州飞净生物科技有限公司;RNA反转录试剂盒、qPCR SYBR Green Master Mix、PhyZolTMTotal RNA Extraction Reagent、Hifair®III 1stStrand cDNA Synthesis SuperMix for qPCR逆转录试剂盒、Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix试剂盒 翌圣生物科技(上海)股份有限公司。
1.2 仪器与设备
PHS-W型pH计 上海班特仪器有限公司;ABI 2720型PCR仪 美国ABI公司;OSE-260-03型超微量定量仪 天根生化科技(北京)有限公司;LightCycler96型荧光定量仪 瑞士Roche公司;FA1004N型分析天平 上海精密科学仪器厂;SW-CJ-1D型垂直净化工作台 济南启科仪器设备有限公司。
1.3 方法
1.3.1 柑橘酸腐病菌PacC候选基因的筛选
本课题组前期送样至北京诺禾致源生物信息技术有限公司使用SMRT技术,结合Illumina Hiseq-PE150测序和Pacific Biosciences RSII测序对酸腐病菌基因组进行测序[12]。根据基因注释信息筛选出PacC候选基因,并对其进行分析。
1.3.2 不同物种间PacC基因编码氨基酸序列比对与保守基序分析
在NCBI(https://www.ncbi.nlm.nih.gov)中查找并下载其他采后致病菌PacC编码的氨基酸序列,利用软件ClustalX和GeneDoc将不同物种间同源基因的氨基酸序列比对,利用在线网站MEME Suite 5.4.1(https://memesuite.org/meme/)并结合MEGA7.0软件与TBtools软件预测该基因的保守基序[13-14]。
1.3.3 不同物种间的PacC系统进化分析
利用MEGA 7.0软件中的邻接法构建系统发育树,并进行1 000 次重新采样评估,其他参数均为标准值[15]。
1.3.4 柑橘酸腐病菌PacC结构特征及染色体分布
利用在线网站GSDS 2.0(http://gsds.gao-lab.org/)对PacC转录因子家族成员的基因结构进行分析,利用在线网站MG2Cv2.1(http://mg2c.iask.in/mg2c_v2.1/)对其家族成员所在染色体位置进行分析[16]。
1.3.5 酸腐病菌PacC编码蛋白结构与理化性质分析
利用NCBI ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)对PacC开放阅读框进行预测,利用在线分析网站ExPASy中的在线工具ProtParam(https://web.expasy.org/protparam/)对PacC编码蛋白产物的相关理化性质预测[17],利用在线分析网站ExPASy ProtScal(https://web.expasy.org/cgi-bin/protscale/protscale.pl)程序,对PacC编码产物的疏水性和亲水性进行分析;利用在线网站TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)对PacC相关跨膜结构域进行生物学特性分析;利用SignalP 5.0 Server(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)工具对PacC信号肽进行预测[18];利用NetPhos3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)在线分析工具对PacC磷酸化位点进行分析;利用在线网站WoLF PSORT(https://wolfpsort.hgc.jp)对PacC蛋白的功能进行亚细胞定位[19];通过在线网站Swiss-Modeling(https://swissmodel.expasy.org)对PacC的氨基酸序列进行蛋白质三维结构的同源建模,获得其氨基酸序列,预测三级结构[20]。
1.3.6 不同pH值下酸腐病菌菌丝生长量的测定
参考Tan Xiaoli等[21]的方法,略有修改,于pH 1.0、2.0、2.2、2.5、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的PDB培养基中加入1 mL终浓度为106spores/mL酸腐病菌孢子悬浮液,每个处理3 瓶,置于28 ℃摇床(160 r/min)振荡培养2 d。培养结束,离心收集沉淀,沉淀用无菌水重悬两次,最后将沉淀置于-80 ℃超低温冰箱冷冻,第2天进行真空冷冻干燥,分别称量菌丝干质量。
1.3.7 果实接种
选用成熟度、大小一致的宫川蜜橘(Citrus unshiuMarc.,pH>3.0)和尤力克柠檬(Citrus limon(L.) Burm.F.,pH<3.0)作为材料,参考Li Lu等[22]的方法进行接种。蒸馏水清洗后在2% NaClO溶液中浸泡2 min,蒸馏水清洗3 次并自然晾干。用无菌手术刀在果实赤道部位划2 个3 mm×3 mm×2 mm的伤口,放置1 h后,在伤口处接种10 μL酸腐病菌孢子悬浮液(1×107spores/mL),贮藏于28 ℃、相对湿度85%~90%的密闭培养箱中,每2 d测量果实发病部位pH值,每组样品3 个平行,并将样品用液氮速冻,保存于-80 ℃超低温冰箱[23],用于后续RNA的提取。
1.3.8 实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)分析
离体条件下菌丝的收集参考Yuan Xingxing等[24]的方法,略有修改,过滤收集在pH 3.0 PDB培养基中摇瓶培养24 h的柑橘酸腐病菌菌丝,取等量分别转移至pH 1.0、3.0、5.0、7.0、9.0、11.0的PDB培养基中,摇瓶培养1 h后,收集菌丝,于-80 ℃保存,用于后续RNA的提取。
使用PhyZolTMTotal RNA Extraction Reagent提取离体条件培养以及腐烂果实的酸腐病菌菌丝总RNA,利用Hifair®III 1stStrand cDNA Synthesis SuperMix for qPCR逆转录试剂盒合成cDNA第1链。用cDNA模板检测各基因表达水平,内参基因为β-actin,利用软件Primer 5.0设计荧光定量引物,引物序列见表1,送至擎科(长沙)生物科技有限公司合成。使用Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix试剂盒进行real-time PCR。反应体系:10.0 μL Blue qPCR SYBR Green Master Mix,上、下游引物各0.4 μL(10 μmol/L),1.0 μL模板,8.2 μL ddH2O。每个样品进行3 次技术重复。反应条件:95 ℃预变性120 s;95 ℃ 10 s,60 ℃ 30 s,45 个循环,离体培养的样品以pH 3.0处理为对照,果实样品以发病2 d组织中病原菌基因转录水平作为对照,采用2-ΔΔCt法计算PacC在不同处理中的相对表达量[25]。
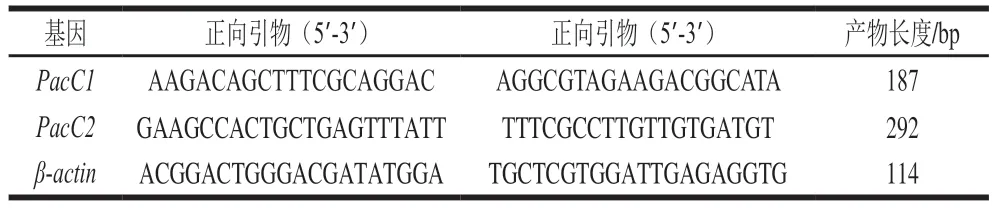
表1 real-time PCR引物序列Table 1 Primer sequences used for real-time PCR
1.4 数据处理与分析
实验所得3 个平行数据用Excel软件进行处理,采用Origin 2021软件进行绘图,利用SPSS 25.0采用单因素方差分析比较各组间的统计学差异,P<0.05认为存在显著差异。
2 结果与分析
2.1 柑橘酸腐病菌PacC生物信息学分析
2.1.1 柑橘酸腐病菌PacC候选基因的筛选结果
根据柑橘酸腐病菌全基因组基因注释信息筛选到2 个PacC候选基因PacC1和PacC2。它们与白地霉PacC基因同源性分别高达76.7%和74.7%,可能具备PacC相似功能,因此,后续对这两个基因进行生物信息学和表达模式分析。
2.1.2 不同物种间PacC基因编码氨基酸序列比对与保守基序分析
通过与酿酒酵母(Saccharomyces cerevisiae)、白色念珠菌(Candida albicans)、黑曲霉(Aspergillus niger)、指状青霉(P.digitatum)、尖孢镰刀菌(Fusarium oxysporum)等其他真菌的PacC基因编码氨基酸序列进行对比,发现酸腐病菌PacC与上述比对真菌的蛋白结构相似,均含有3 个保守的Cys2His2锌指蛋白结构域,属于C2H2蛋白家族(图1)。利用在线网站MEME并结合MEGA7.0和TBtools软件预测上述真菌PacC的保守基序,共鉴定出10 个保守基序,其中Motif1、Motif2、Motif3、Motif7、Motif9高度保守。酸腐病菌PacC1与PacC2结构相似,具有相同的保守基序(Motif1、Motif2、Motif3、Motif4、Motif5、Motif6、Motif7、Motif9)(图2)。

图1 酸腐病菌PacC与其他真菌PacC的蛋白氨基酸比对Fig.1 Alignment of predicted amino acid sequence of PacC between G.citri-aurantii and other fungi

图2 酸腐病菌PacC与其他真菌PacC保守基序分析Fig.2 Alignment of predicted conserve motif of PacC between G.citri-aurantii and other fungi
2.1.3 不同物种间的PacC系统进化分析
由系统发育树可以看出,酸腐病菌的PacC1和PacC2亲缘关系最近。测试物种中,与指状青霉(P.digitatum)、产黄青霉(P.chrysogenum)以及黑曲霉(A.niger)的亲缘关系较近,与酿酒酵母(S.cerevisiae)、白色念珠菌(C.albicans)等物种的亲缘关系较远(图3)。
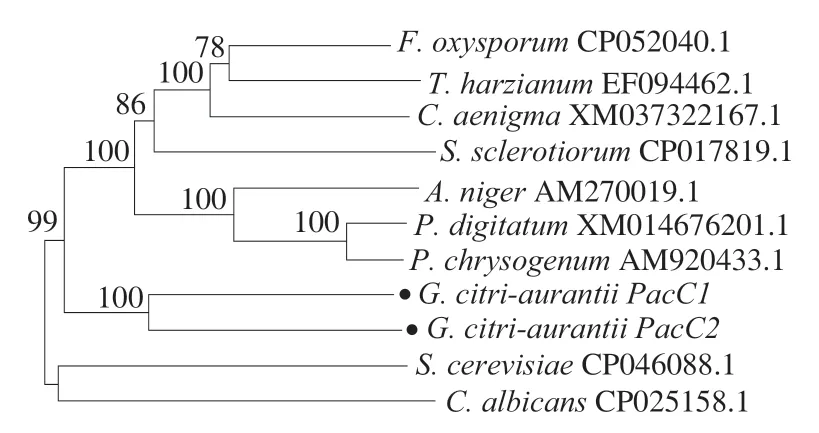
图3 酸腐病菌PacC与其他真菌PacC的亲缘关系Fig.3 Phylogenetic tree showing genetic relationship between G.citri-aurantii and fungi based on PacC
2.1.4 柑橘酸腐病菌PacC结构特征及染色体分布
利用在线网站GSDS 2.0与MG2C v2.1对PacC1与PacC2的结构与染色体分布进行分析。由图4可知,PacC1与PacC2均只有外显子结构,外显子长度分别为1 872 bp和1 779 bp,均无内含子与UTR区域。根据图5可知,PacC1与PacC2分别位于第3号染色体和第10号染色体上,第3号染色体长度为2 879 209 bp,PacC1位于1 832 639~1 834 510 bp之间。第10号染色体长度为1 531 806 bp,PacC2位于877 315~879 093 bp之间。

图4 柑橘酸腐病菌PacC结构特征Fig.4 Structural characterization of PacC of G.citri-aurantii

图5 柑橘酸腐病菌PacC染色体分布Fig.5 Chromosome distribution of PacC of G.citri-aurantii
2.1.5 酸腐病菌PacC蛋白结构与理化性质分析
由图6可知,PacC1与PacC2的蛋白结构具有一定差异。对其理化性质进行分析,发现PacC1与PacC2均为亲水性的不稳定蛋白[26],没有跨膜位点与信号肽,WoLF PSORT亚细胞定位显示二者均在细胞核内发挥功能调控作用。它们在分子质量、等电点、磷酸化位点等方面存在一定差异。其中,PacC1蛋白对应碱基数为1 872 bp,编码623 个氨基酸,PacC1分子质量为67.80 kDa,等电点为6.71,可能发生磷酸化的位点有Ser56、Thr18、Tyr8;PacC2蛋白对应含1 779 个碱基,编码592 个氨基酸,PacC2分子质量为64.32 kDa,等电点为8.50,Ser72、Thr18、Tyr13位点可能发生磷酸化(表2)。PacC1和PacC2蛋白高级结构预测见图6。

图6 PacC1(A)与PacC2蛋白(B)高级结构预测Fig.6 Prediction of protein structure of PacC1 (A) and PacC2 (B) of G.citri-aurantii

表2 酸腐病菌PacC1与PacC2理化性质比较Table 2 Comparison of physicochemical properties between G.citri-aurantii PacC1 and PacC2
2.2 不同pH值对酸腐病菌菌丝生长量和PacC表达量的影响
2.2.1 不同pH值对酸腐病菌菌丝生长量的影响
如图7所示,酸腐病菌在pH 2.0~11.0范围内均能生长,其中pH 3.0菌丝生长量显著高于其他pH值,其次是pH 4.0。在pH 2.5和pH 5.0~10.0范围内菌丝生长量没有显著差异。pH 2.2和11.0菌丝生长受到显著抑制,在pH<2.2时几乎不生长。由此可知,pH值对酸腐病菌的生长具有调控作用,酸腐病菌具有广泛的pH值适应性,但其最适生长pH值约为3.0,这与许多柑橘品种果实pH值接近[27]。
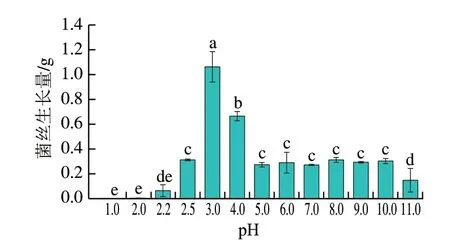
图7 不同pH值对培养2 d酸腐病菌菌丝生长量的影响Fig.7 Effect of different pH on the growth of G.citri-aurantii mycelium cultured for two days
2.2.2 离体条件下不同pH值对PacC表达量的影响
以酸腐病菌最适生长pH值(pH 3.0)为对照,比较PacC1和PacC2在不同pH值的表达情况。结果表明,PacC1和PacC2的表达均受pH值调控,且两个基因的表达变化趋势具有一定相似性。处理1 h时,PacC1和PacC2表达均在pH 11.0显著上调(P<0.05),相对表达量分别约为对照的2.24 倍和1.62 倍;PacC1表达量在其他pH值条件下没有显著差异,但PacC2在pH 1.0时几乎不表达(图8)。处理24 h时,PacC1和PacC2表达量在pH 9.0和pH 11.0均显著上调,其中pH 9.0处理中的两个基因表达量均约为对照的4.8 倍,PacC1在pH 11.0的表达量约为对照的8.5 倍,而PacC2的上调倍数更高,约为对照的13 倍,两个基因在其他pH值的表达水平相似,但pH 1.0时PacC2的表达量显著上调。

图8 不同pH值对酸腐病菌PacC1与PacC2表达的影响Fig.8 Effects of different pH on the expression levels of PacC1 and PacC2 in G.citri-aurantii
2.3 PacC在酸腐病菌侵染柑橘果实侵染过程中的表达情况
宫川蜜橘果实人工接种酸腐病菌2 d时,果实伤口处可见明显软腐症状,病斑直径为(1.97±0.13)cm,4 d出现白色霉层,病斑直径达到(3.88±0.06)cm,至发病6 d时,果实几乎完全腐烂(图9A、B)。果实发病过程中腐烂部位的pH值呈下降趋势,在6 d时下降约0.2,显著低于对照(图9C)。酸腐病菌两个PacC的表达总体呈上调趋势,但PacC1对pH值变化的响应更快,侵染4 d时表达量即显著高于2 d,侵染6 d时表达量上调至2 d的3.9 倍,而PacC2的表达量在6 d才有显著上调(图9C)。尤力克柠檬果实人工接种酸腐病菌2 d时,果实伤口处也可见明显软腐症状,病斑直径为(1.92±0.14)cm,4 d时软腐面积加大,病斑直径为(3.80±0.05)cm,至发病6 d时果实几乎被白色霉层覆盖,完全腐烂(图10A、B),发病过程中腐烂部位的pH值呈上升趋势,至接种6 d时上升约0.4,显著高于对照(图10C)。酸腐病菌两个PacC的表达量均在侵染6 d时发生显著上调(图10C)。

图9 酸腐病菌侵染过程中PacC的表达量与蜜橘果实发病部位pH值的关系Fig.9 Relationship between PacC expression and pH change of mandarin wounds infected with G.citri-aurantii

图10 酸腐病菌侵染过程中PacC的表达量与柠檬果实发病部位pH值的关系Fig.10 Relationship between PacC expression and pH change of lemon fruit wounds infectedwith G.citri-aurantii
3 讨论
采后病原真菌的侵染能力受寄主伤口、温度、湿度和环境pH值等因素的影响,其中环境pH值对病原真菌的生长和致病力有重要调控作用[28]。许多病原真菌通过调整对微量元素的利用和体内一些蛋白质的功能应对环境pH值的变化,因此具有广泛pH值适应性。目前,丝状真菌中报道较多的pH值响应机制为pal途径,该途径包含7 个基因:pacC/pacl、palA、palB、palC、palF、palH和palI,其中,PacC作为重要的环境pH值调节因子,在微生物调节、适应环境的过程中发挥重要作用[9]。PacC的结构高度保守,PacC蛋白属于C2H2蛋白家族,含有3 个保守的Cys2His2锌指蛋白结构域[29-31]。采后致病真菌中,意大利青霉和指状青霉PacC均具有此结构[9]。本实验对酸腐病菌候选PacC的氨基酸序列和保守基序进行分析,发现2 个候选基因均具有PacC的保守结构,且系统发育树也表明其亲缘关系与柑橘采后致病菌指状青霉较近,说明其可能与指状青霉PacC具有类似功能。指状青霉同样是嗜酸真菌,在侵染柑橘果实过程中PacC表达水平呈显著上调,且可能参与酸分泌过程改变环境pH值,PacC功能的缺失可导致病菌致病性显著下降[9,32]。此外,指状青霉PacC在离体碱性条件下有高水平表达,对指状青霉的环境适应性有重要意义[32]。因此,推测酸腐病菌PacC在柑橘果实致病性和病原菌环境适应性中可能具有重要调控作用。进一步对酸腐病菌两个PacC的结构和性质进行分析,发现PacC1与PacC2位于不同染色体(图5),在等电点和磷酸化位点等方面有较大差异(表2),推测这两个基因在功能上也存在一定差异。
不同的寄主组织存在显著性的pH值差异,不同病原菌生长的适宜pH值及耐受范围也存在较大差异[28]。陈彦等[33]研究发现葡萄白腐病菌(Coniella diplodiella)菌丝在pH 3.0~5.0条件下生长较为迅速,且最适pH值约为4.0;而王宏等[34]研究发现梨链格孢菌(Alternaria alternata)可在pH 4.0~12.0范围内生长,最适pH值约为7.0~8.0。本实验中,离体条件下,柑橘酸腐病菌具有较广的pH值适应能力,但pH 3.0~4.0范围的生长量显著高于其他pH值(图7),而其寄主pH值范围大多约为2.0~6.0,其中柠檬类果实pH值约为2.2,宽皮柑橘类果实pH值约为3.0,甜橙类果实pH值约为5.0[35]。因此,推测酸腐病菌在宽皮柑橘类果实中具有更强的生长能力,而实际上,酸腐病菌对pH值极低的柠檬果实也有较强侵染力,这可能与其pH值调节能力有关。
大量研究表明,中性到碱性条件下,PacC在细胞核中调节基因的表达,这些基因参与病原真菌的细胞壁合成、跨膜运输、细胞稳态、真菌毒力、菌丝生长、离子胁迫等方面[36-38]。如指状青霉PacC在碱性条件下处理48 h时的表达量即上升为对照的8.4 倍;指状青霉PacC缺失突变体在碱性环境中无法生长,对果胶的利用能力和柑橘的致病性也大幅下降[9]。但是PacC在酸性条件下的表达模式不尽相同。冯越等[39]研究发现,意大利青霉PacC在酸性环境中的表达量显著下调。而指状青霉PacC的表达不受果皮酸性环境的影响[9]。同样,灰霉病菌PacC缺失突变体的致病性在组织pH值为酸性的寄主中也没有变化[40]。本实验中,离体条件下培养的酸腐病菌从最适生长pH 3.0培养基转移到不同pH值培养基中继续培养1 h时,PacC1和PacC2均能对环境pH值进行迅速响应,在显著抑制菌丝生长的pH 11.0处理中表达迅速上调(图8),培养24 h时,两个PacC的表达量在pH 9.0和pH 11.0的处理中均显著上调,且pH 11.0处理中表达量更高(图8),说明碱性环境能诱导酸腐病菌PacC的高水平表达,这与上述采后致病菌PacC的表达情况一致。值得注意的是,PacC1和PacC2在某些酸性条件下的表达趋势有显著差异,如pH 1.0处理1 h,PacC2的表达被显著抑制,同样,PacC2的表达水平在pH 3.0处理24 h也显著下降,而PacC1的表达未发生显著变化(图8),说明酸腐病菌PacC的表达也受酸性环境调控,可能在侵染柑橘果实过程中也有类似情况,而这两个基因呈现出不同的响应模式可能与其结构和性质的差异相关。
在侵染初期,采后病原真菌通常分泌酸或碱以调节侵染位点pH值以加速侵染进程,这一过程可能与PacC的调控有关[41-43]。如炭黑曲霉(A.carbonarius)PacC缺失株侵染葡萄时不再分泌葡萄糖酸和柠檬酸[42];核盘病菌(Sclerotinia sclerotiorum)PacC直接调控草酸的分泌降低侵染位点pH 值[10]。胶胞炭疽菌(C.gloeosporioides)可在鳄梨组织中分泌氨,进而导致侵染位点pH值升高[44]。本实验中,人工接种酸腐病菌的宫川蜜橘和尤力克柠檬果实侵染位点pH值的变化呈相反趋势。宫川蜜橘果实初始pH值约为3.30,随着病斑面积的扩大,发病部位的pH值逐渐下降至3.11,说明酸腐病菌与宫川蜜橘果实互作过程中的产物可导致果实腐烂部位pH值的下降,有利于病原菌的扩繁。接种后4~6 d果实病斑面积急剧增大,同时酸腐病菌PacC的表达量也上调,说明酸腐病菌PacC很可能参与对环境pH值的调控,从而促进侵染进程。PacC在酸腐病菌侵染尤力克柠檬果实过程中也发挥类似作用,但侵染位点pH值呈上升趋势。虽然不同品种果实发病部位pH值的变化趋势不同,但发病后期的组织pH值均更接近酸腐病菌生长的最适pH值。王哲[45]的研究发现,酸腐病菌侵染柑橘果实时分泌葡萄糖酸和另一种有机酸使侵染位点pH值下降,但酸腐病菌是否能通过分泌氨上调侵染位点pH值还有待证实。
4 结论
环境pH值对柑橘酸腐病菌的生长具有调控作用,同时,酸腐病菌也可以一定程度的调节环境pH值。酸腐病菌的2 个PacC均能在碱性条件下被诱导表达,但由于基因结构和理化性质的差异,它们对pH值的响应程度和方式也有一定差别。两个PacC对于酸腐病菌广泛的pH值适应性以及柑橘果实侵染进程具有重要作用。
