图们江下游湿地不同植物群落区表层土壤中菌类的磷脂脂肪酸组成和含量
2023-12-14孙娇娇朱卫红曹光兰
孙娇娇,朱卫红,金 日,曹光兰,3*
(1.延边大学地理与海洋科学学院,吉林 延吉 133002;2.哈尔滨学院,黑龙江省寒区湿地生态与环境研究重点实验室,黑龙江 哈尔滨 150086;3.南开大学环境科学与工程学院,天津 300350)
土壤中的微生物是土壤生态系统的核心组成部分[1-2]。受水文和地貌条件以及植物群落的综合影响,不同类型湿地为土壤中微生物提供的生存环境存在差异[3-4]。磷脂脂肪酸(phospholipid fatty acid,PLFA)是细菌和真核生物细胞膜中的关键结构成分,不同微生物菌群的磷脂脂肪酸的组成和含量差异显著[5]。磷脂脂肪酸分析技术是一种基于“生物标志物”的技术,可以标记土壤中的活体微生物类群[6]。研究表明,利用磷脂脂肪酸含量数据,可以直接分析土壤中细菌、真菌和放线菌等的生物量,定量评估微生物群落结构的动态[7-8]。近年来,磷脂脂肪酸分析技术被广泛应用于土壤中微生物生态特征的研究中。
图们江流域拥有类型多样、丰富的湿地资源[9-10]。不同湿地土壤中的养分含量具有高度的空间异质性,其对土壤中的微生物群落组成有明显影响[11-13]。已经开展了图们江下游湿地土壤中微生物群落的结构[11]、图们江下游流域湿地中迁徙水鸟多样性[14]和图们江下游自然湿地土壤种子库特征[15]等方面的研究,而对湿地中不同植物群落区土壤中微生物群落的研究尚需要进一步深入。
在图们江下游流域的湿地中,主要分布着菰(Zizania latifolia)群落、灰脉薹草(Carex appendiculata)群落、芦苇(Phragmites australis)群落、大叶章(Deyeuxia purpurea)群落、大穗薹草(Carex rhynchophysa)群落、皱果薹草(Carex dispalata)群落和长芒稗(Echinochloa caudata)群落等植物群落。本研究以图们江下游珲春市湿地中的大叶章群落区、皱果薹草群落区和长芒稗群落区表层土壤中的菌类为研究对象,采用磷脂脂肪酸标记法,研究菌类的磷脂脂肪酸的组成和含量,分析湿地类型、植物类型和土壤性质对菌类的磷脂脂肪酸含量的影响。
1 材料与方法
1.1 采样地布设、土壤样品采集和分析测试
在吉林省延边朝鲜族自治州珲春市的沼泽(42°37′19.25″N,130°34′17.95″E)、河流湿地(42°35′33.26″N,130°34′59.83″E)和湖泊湿地(42°35′33.41″N,130°35′0.82″E)中,布设采样地。
在河流湿地中,选择长芒稗群落区、大叶章群落区和皱果薹草群落区,分别作为采样地1、采样地2和采样地3;在湖泊湿地中,选择长芒稗群落区和大叶章群落区,分别作为采样地4和采样地5;在沼泽中,选择皱果薹草群落区,作为采样地6。所有被选择的植物群落区的规格都大于2 m×10 m。
于2014年8月中旬,在每处采样地中,随机布设3个规格为1 m×1 m的样方,样方之间的间隔大于10 m。在每个样方中,采用五点法,利用土钻,采集0~10 深度土壤样品5份,将所有表层土壤样品中的植物残根挑拣出来,然后,将5份表层土壤样品混合均匀,分成2份,装入灭菌自封袋中,运回实验室。
在实验室中,将采集到的表层土壤样品过2 mm筛;将每个样方中的1份表层土壤样品冻干,用于测定微生物群落组成;将另1份表层土壤样品用于土壤理化指标测定。
采用烘干法,测定表层土壤样品的干质量。利用表层土壤样品的鲜质量和干质量数据,计算出表层土壤的含水量。土壤含水量等于土壤的鲜质量与干质量之差除以干质量再乘以100%。
采用电位法,测定表层土壤样品的pH(水土比为2.5∶1)。采用重铬酸钾容量法[13-14,16],测定表层土壤中的有机质含量。采用重铬酸钾-硫酸消化法[17],测定表层土壤中的全氮含量。采用碱解扩散法[18],测定表层土壤中的速效氮含量。采用渍提-钼锑抗比色法[19],测定表层土壤中的速效磷含量。采用火焰光度法[19],测定表层土壤中的速效钾含量。
采用改良的Bligh-Dyer方法[20],萃取表层土壤中的磷脂脂肪酸。利用气象色谱仪(Agilent 7890B)搭载火焰离子检测器(GC-FID)[21],检测土壤中微生物物种的磷脂脂肪酸的标志物。利用MIDI Sherlock软件,进行磷脂脂肪酸的识别与定性。
参照文献[21]和文献[22]中的相关方法,对所得到的各种磷脂脂肪酸所表征的微生物进行分类。
1.2 数据分析方法
采用双因素方差分析方法,利用SPSS 25.0软件,分析表层土壤中微生物群落结构对不同类型湿地、植物群落区及其两者的交互作用的响应。
采用最小显著性差异法,检验各类型湿地、各植物群落区的各指标值的变化。
采用Pearson相关分析方法,分析土壤中菌类的磷脂脂肪酸含量及其比值与表层土壤理化指标值之间的关系。
采用冗余分析方法,利用Canoco 5.0 软件,分析表层土壤理化指标对菌类的磷脂脂肪酸含量的影响。采用蒙特卡罗检验方法,分析表层土壤理化指标的显著性(499 次)。采用方差分解方法,分析表层土壤理化指标、湿地类型、植物类型对菌类结构变化的贡献率。
2 结果与分析
2.1 各采样地表层土壤的理化性质
由表1可知,河流湿地中的长芒稗群落区表层土壤的全氮含量、有机质含量、速效氮含量、速效磷含量和含水量都明显大于湖泊湿地中的长芒稗群落区,而前者的速效钾含量和pH略小于后者。
河流湿地中的大叶章群落区表层土壤的全氮含量、有机质含量、速效氮含量、速效磷含量、含水量和pH都明显小于湖泊湿地中的大叶章群落区,而前者的速效钾含量明显大于后者。
河流湿地中的皱果薹草群落区表层土壤的全氮含量、有机质含量、速效氮含量和含水量都明显大于沼泽中的皱果薹草群落区,而前者的速效磷含量、速效钾含量和pH略小于后者。
双因素方差分析(n=18)结果显示,除了表层土壤的速效钾含量以外,湿地类型对表层土壤的全氮含量(p<0.05)、有机质含量(p<0.001)、速效氮含量(p<0.01)、速效磷含量(p<0.05)、含水量(p<0.001)、pH(p<0.001)都具有显著影响。
除了表层土壤的速效磷含量和pH以外,植物群落类型对表层土壤的全氮含量(p<0.01)、有机质含量(p<0.001)、速效氮含量(p<0.001)、速效钾(p<0.001)、含水量(p<0.001)都具有显著影响。
除了表层土壤的速效磷含量以外,湿地类型与植物群落类型的交互作用对表层土壤的全氮含量(p<0.001)、有机质含量(p<0.001)、速效氮含量(p<0.001)、速效钾(p<0.001)、含水量(p<0.05)、pH(p<0.05)都具有显著影响。
2.2 各采样地表层土壤中菌类的组成和磷脂脂肪酸含量
在河流湿地中的长芒稗群落区、大叶章群落区和皱果薹草群落区、湖泊湿地中的长芒稗群落区和大叶章群落区、沼泽中的皱果薹草群落区的表层土壤中,检测出了17种磷脂脂肪酸。
图1显示,表征革兰氏阳性菌的6种磷脂脂肪酸 分 别 为14:0iso、15:0iso、16:0iso、17:0iso、15:0anteiso 和17:0anteiso;表征革兰氏阴性菌的3 种磷 脂 脂 肪 酸 分 别 为16:1ω7c、cyclo17:0ω7c 和cyclo19:0ω7c;表征其他细菌的3 种磷脂脂肪酸分别为磷脂脂肪酸14:0、磷脂脂肪酸15:0 和磷脂脂肪酸17:0;表征真菌的1 种磷脂脂肪酸为18:2ω6c;表征丛枝菌根真菌的1 种磷脂脂肪酸为16:1ω5c;表征放线菌的3 种磷脂脂肪酸分别为10Me16:0、10Me17:0和10Me18:0。
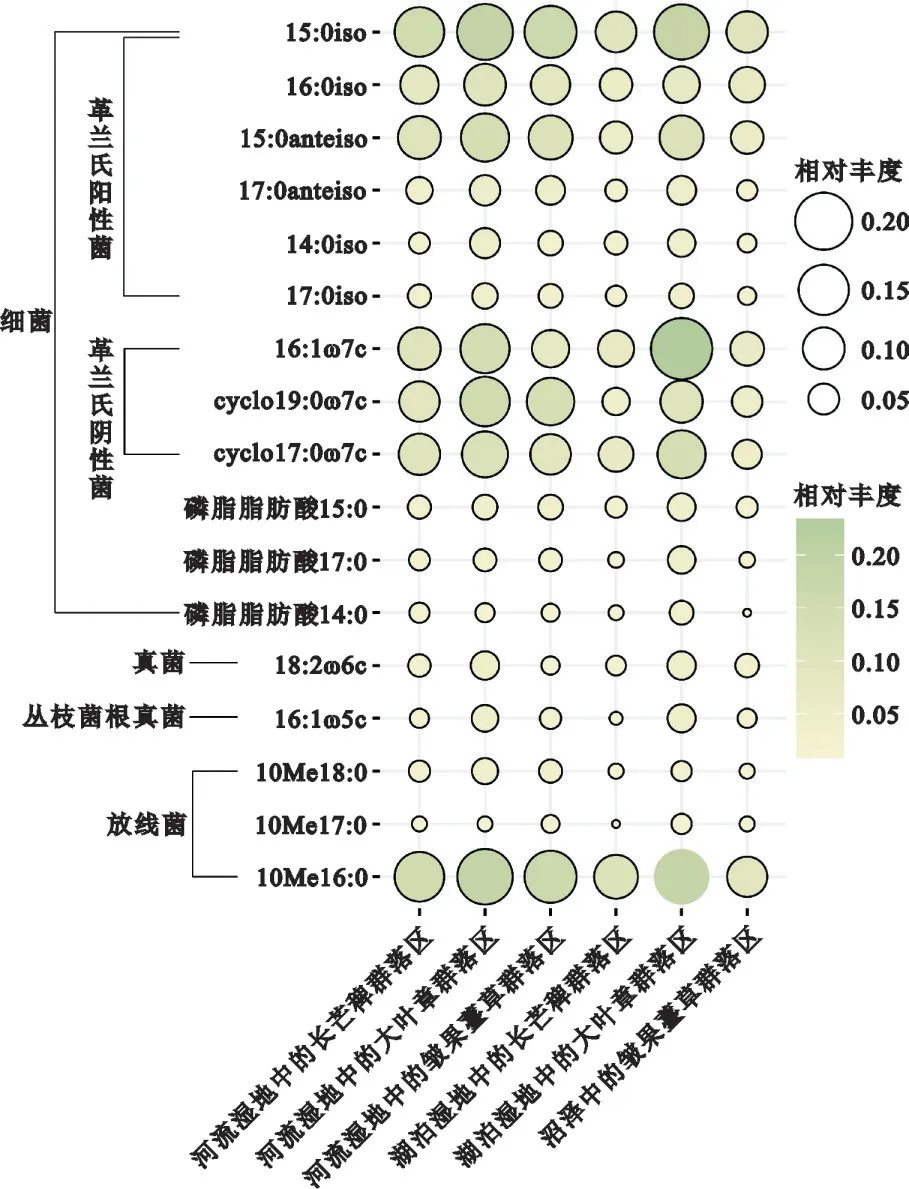
图1 河流湿地、湖泊湿地和沼泽的3种植物群落区表层土壤中菌类的磷脂脂肪酸相对丰度示意图Fig.1 Schematic map of the relative abundance of phospholipid fatty acids of bacteria in surface soil of 3 plant community areas in the river wetlands,lake wetlands and marshes
在河流湿地、湖泊湿地和沼泽中,各植物群落区表层土壤中15:0iso、16:1ω7c 和10Me16:0 的相对丰度都较大。
湖泊湿地和河流湿地的大叶章群落区表层土壤中的细菌、放线菌、真菌、丛枝菌根真菌的磷脂脂肪酸含量都最大或者第二大;除了真菌和丛枝菌根真菌的磷脂脂肪酸含量以外,沼泽的皱果薹草群落区表层土壤中的细菌和放线菌的磷脂脂肪酸含量都最小(表2)。
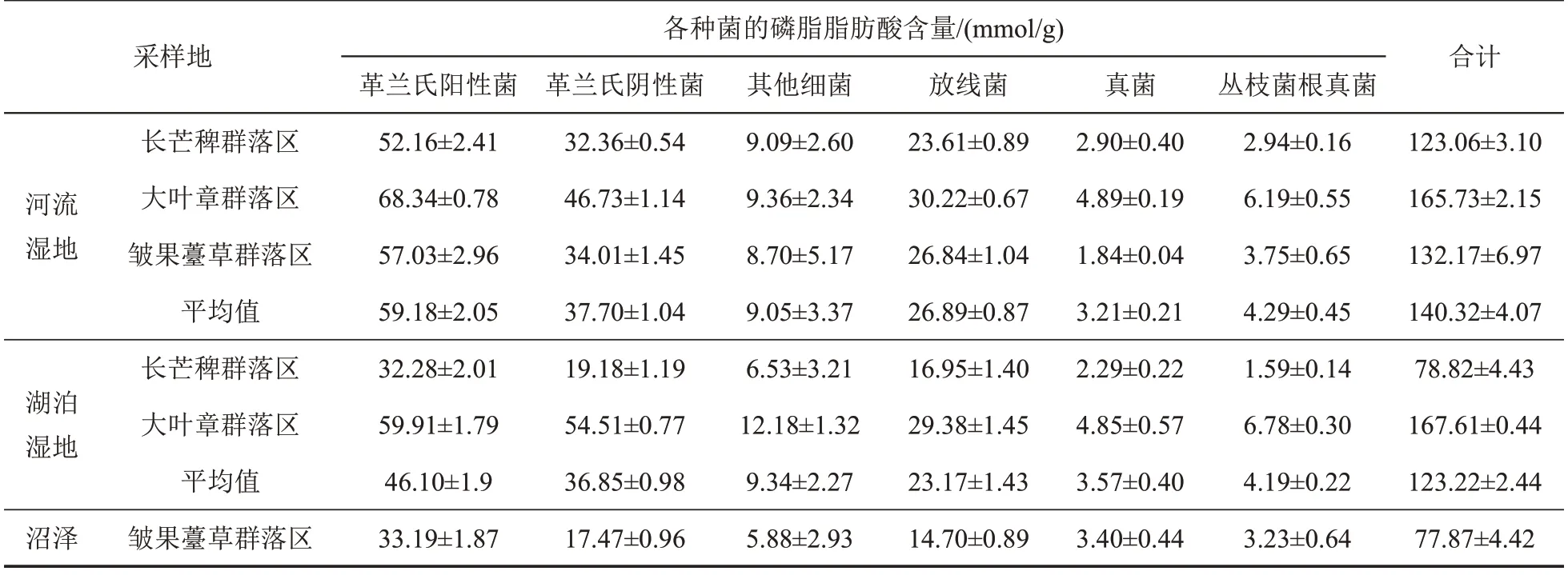
表2 河流湿地、湖泊湿地和沼泽3种植物群落区表层土壤中菌类的磷脂脂肪酸含量Table 2 Contents of phospholipid fatty acids of bacteria in surface soil of 3 plant community areas in the river wetlands,lake wetlands and marshes
在各植物群落区表层土壤的真菌与细菌的磷脂脂肪酸含量的比值、革兰氏阳性菌与革兰氏阴性菌的磷脂脂肪酸含量的比值、细菌与放线菌的磷脂脂肪酸含量的比值中,沼泽的皱果薹草群落区表层土壤中的真菌与细菌的磷脂脂肪酸含量的比值、革兰氏阳性菌与革兰氏阴性菌的磷脂脂肪酸含量的比值都最大,湖泊湿地的皱果薹草群落区表层土壤中的真菌与细菌的磷脂脂肪酸含量的比值最小,湖泊湿地的大叶章群落区表层土壤中的革兰氏阳性菌与革兰氏阴性菌的磷脂脂肪酸含量的比值最小;湖泊湿地的大叶章群落区表层土壤中的细菌与放线菌的磷脂脂肪酸含量的比值最大,湖泊湿地的长芒稗群落区表层土壤中的细菌与放线菌的磷脂脂肪酸含量的比值最小。
双因素方差分析(n=18)结果显示,除了丛枝菌根真菌的磷脂脂肪酸含量和细菌与放线菌的磷脂脂肪酸含量的比值以外,湿地类型对表层土壤中的革兰氏阳性菌的磷脂脂肪酸含量(p<0.001)、革兰氏阴性菌的磷脂脂肪酸含量(p<0.001)、细菌的磷脂脂肪酸含量(p<0.001)、放线菌的磷脂脂肪酸含量(p<0.001)、真菌的磷脂脂肪酸含量(p<0.05)、菌类的磷脂脂肪酸总含量(p<0.001)、真菌与细菌的磷脂脂肪酸含量的比值(p<0.001)、革兰氏阳性菌与革兰氏阴性菌的磷脂脂肪酸含量的比值(p<0.01)都具有显著影响;植物类型对表层土壤中的革兰氏阳性菌的磷脂脂肪酸含量(p<0.001)、革兰氏阴性菌的磷脂脂肪酸含量(p<0.001)、丛枝菌根真菌的磷脂脂肪酸含量(p<0.001)、细菌的磷脂脂肪酸含量(p<0.001)、放线菌的磷脂脂肪酸含量(p<0.001)、真菌含量(p<0.05)、菌类的磷脂脂肪酸总含量(p<0.001)、真菌与细菌的磷脂脂肪酸含量的比值(p<0.05)、革兰氏阳性菌与革兰氏阴性菌的磷脂脂肪酸含量的比值(p<0.01)、细菌与放线菌的磷脂脂肪酸含量的比值(p<0.01)都具有显著影响;除了真菌的磷脂脂肪酸含量、丛枝菌根真菌的磷脂脂肪酸含量和真菌与细菌的磷脂脂肪酸含量的比值以外,湿地类型与植物群落类型的交互作用对表层土壤中的革兰氏阳性菌的磷脂脂肪酸含量(p<0.05)、革兰氏阴性菌的磷脂脂肪酸含量(p<0.001)、细菌的磷脂脂肪酸含量(p<0.001)、放线菌的磷脂脂肪酸含量(p<0.05)、菌类的磷脂脂肪酸总含量(p<0.001)、革兰氏阳性菌与革兰氏阴性菌的磷脂脂肪酸含量的比值(p<0.001)、细菌与放线菌的磷脂脂肪酸含量的比值(p<0.05)都具有显著影响。
2.3 表层土壤中菌类结构的影响因素
Pearson 相关分析结果显示,除了真菌与细菌的磷脂脂肪酸含量的比值和真菌的磷脂脂肪酸含量以外,表层土壤中的全氮含量分别与菌类的其他8个指标值都显著相关;除了真菌与细菌的磷脂脂肪酸含量的比值以外,表层土壤中的有机质含量、速效氮含量都分别与菌类的其他9个指标值显著相关(表3)。
表层土壤中的速效磷含量、速效钾含量都分别与菌类所有10个指标值都不相关。表层土壤的含水量只分别与丛枝菌根真菌的磷脂脂肪酸含量、真菌的磷脂脂肪酸含量、革兰氏阴性菌的磷脂脂肪酸含量显著负相关,而与菌类的其他指标值都不相关。表层土壤pH 只分别与真菌与细菌的磷脂脂肪酸含量的比值、菌的磷脂脂肪酸总含量、细菌的磷脂脂肪酸含量、放线菌的磷脂脂肪酸含量、革兰氏阳性菌的磷脂脂肪酸含量显著相关,而与菌类的其他指标值都不相关。
冗余分析结果显示,排序轴1解释了土壤理化性质对菌类结构影响的91.76%(图2)。其中,表层土壤中全氮含量、有机质含量和速效氮含量是影响表层土壤中菌类的磷脂脂肪酸含量及其比值的主要因素(F=67.3,p=0.002),这与Pearson 相关分析的结果相似。
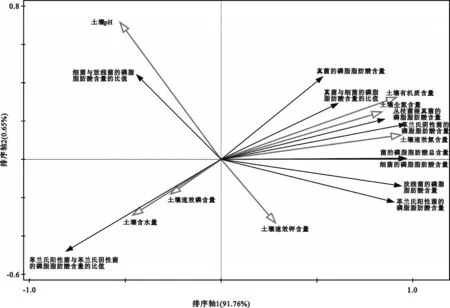
图2 表层土壤中菌类的磷脂脂肪酸含量及其比值与土壤理化指标值的冗余分析排序图Fig.2 Redundancy analysis sort diagram between contents of phospholipid fatty acids of bacteria in surface soil and their ratios and the values of physicochemical indexes of surface soil
图3 显示,土壤理化性质、湿地类型和植物类型对表层土壤中菌类的磷脂脂肪酸含量变化的总解释率为90%。其中,土壤理化性质、湿地类型和植物类型对表层土壤中菌类的磷脂脂肪酸含量变化的单独解释率分别为5%、7%和12%,土壤理化性质与植物类型对其的共同解释率为21%,土壤理化性质与湿地类型对其的共同解释率为22%,三者对其的共同解释率为8%。
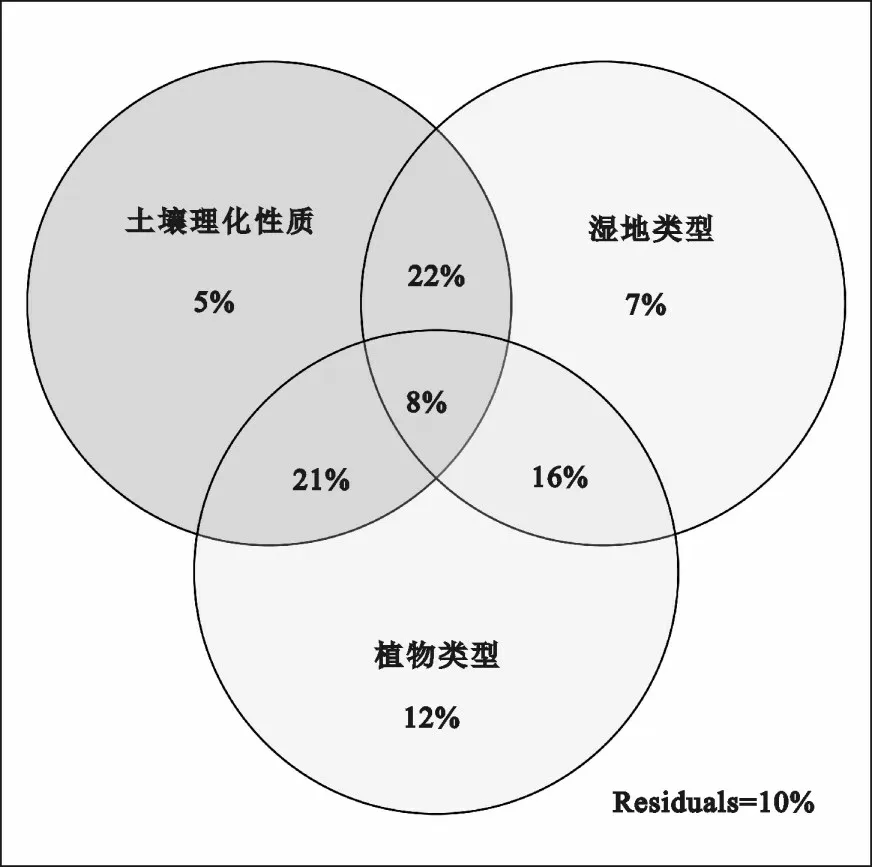
图3 土壤理化性质、湿地类型和植物类型对表层土壤中菌类的磷脂脂肪酸含量变化的解释率Fig.3 The explanation rates of physical and chemical property of soil,type of wetlands and type of plants to the changes of phospholipid fatty acid contents of bacteria in surface soil
3 讨 论
在本研究中,3种类型湿地的不同植物群落区表层土壤中的菌类的组成和磷脂脂肪酸含量存在差异。不同类型的滨海湿地土壤中的微生物群落组成存在显著差异[23]。河流和湖泊湿地明显受季节性降水的影响,特别是在丰水期,河流和湖泊湿地中都会有较丰富的营养物质输入,能促进养分在土壤中的积累[24-25]。植物可以为土壤中的微生物提供栖息地、养分和能量[26]。植物的凋落物可以为土壤中的微生物提供基质和显著影响微生物群落的结构[27]。植物根系将氧气输送至根区土壤中,并释放分泌物为微生物提供养分,其分泌物的特定代谢物对土壤中的微生物具有重要影响[28]。例如,在河流湿地中,因土壤的含水量较大,土壤缺氧,丛枝菌根真菌主要生活在植物根际区的土壤中,通过利用根系分泌物和根际释放的氧气进行生长和发育[29]。土壤的理化性质对土壤中的微生物影响较大[30]。在本研究中,表层土壤中的全氮含量、有机质含量和速效氮含量是影响土壤菌类磷脂脂肪酸组成和含量的主要因素。良好的土壤环境能够促进微生物的生长和繁殖,土壤中的有机质和氮元素能在微生物的代谢过程中为其提供可以利用的能源和合成细胞所需要的主要营养元素[31],利于微生物的大量生长。在本研究中,3种类型湿地不同植物群落区表层土壤中真菌与细菌的磷脂脂肪酸含量的比值都小于1,说明细菌的磷脂脂肪酸含量大,而真菌的磷脂脂肪酸含量较小。这可能是由于土壤偏酸性所致,细菌适宜在微碱性或弱酸性环境中生存[32]。
土壤中微生物群落结构受植物类型和土壤性质等的综合影响[33]。在本研究中,土壤理化性质与湿地类型、其与植物类型分别共同解释22%和21%的表层土壤中菌类的磷脂脂肪酸含量的变化,三者共同解释8%的表层土壤中菌类的磷脂脂肪酸含量的变化。一方面,不同类型湿地的水文条件和形成过程具有显著差异,其对土壤环境的影响大于植物对土壤环境的改造作用[34]。另一方面,虽然不同类型湿地中生长着相同的植物,但是土壤环境的差异不仅影响植物个体的生长、发育和繁殖过程,而且不同程度地影响土壤中的有机质和养分含量,进而导致不同类型湿地土壤中微生物群落结构的差异性[35]。在本研究中,大叶章群落区表层土壤中菌类的磷脂脂肪酸含量明显大于长芒稗群落区和皱果薹草群落区。与长芒稗相比,大叶章属于多年生草本植物,根茎发达,具有较好的通气组织,能改善土壤的微环境,促进土壤中微生物的生长和发育[28,36]。
4 结 论
在图们江下游湿地的长芒稗群落区、大叶章群落区和皱果薹草群落区的表层土壤中,检测出17 种磷脂脂肪酸,其分别表征细菌(革兰氏阳性菌、革兰氏阴性菌和其他细菌)、真菌、丛枝菌根真菌和放线菌。表层土壤中菌类的磷脂脂肪酸组成和含量受湿地类型、植物类型和土壤性质的共同影响。在土壤理化指标中,全氮含量、有机质含量和速效氮含量是影响表层土壤中菌类的磷脂脂肪酸组成和含量的主要因素。
