育肥饲料中添加β-胡萝卜素对中华绒螯蟹雌体卵巢发育、抗氧化免疫性能和组织色泽的影响*
2023-12-06姜晓东朱凌翔成永旭吴旭干
姜晓东 朱凌翔 成永旭 吴旭干
育肥饲料中添加β-胡萝卜素对中华绒螯蟹雌体卵巢发育、抗氧化免疫性能和组织色泽的影响*
姜晓东1, 2, 3朱凌翔1, 2, 3成永旭1, 2, 3吴旭干1, 2, 3①
(1. 上海海洋大学 农业农村部淡水种质资源重点实验室 上海 201306; 2. 上海海洋大学 水产动物遗传育种上海市协同创新中心 上海 201306; 3. 上海海洋大学 农业农村部鱼类营养和环境生态研究中心 上海 201306)
为研究饲料中添加β-胡萝卜素对中华绒螯蟹成体雌蟹育肥效果的影响, 分别在饲料中添加不同浓度的人工合成β-胡萝卜素, 配制五组实验饲料(β-胡萝卜素测定含量分别为3.3、56.7、108.9、207.9和320.0 mg/kg)投喂生殖蜕壳后雌蟹, 评价了饲料中添加β-胡萝卜素对增重率(WGR)、性腺指数(GSI)、肝胰腺指数(HSI)、常规生化组成、抗氧化和免疫指标、色泽参数和类胡萝卜素含量的影响。结果显示: (1) 饲料中添加人工合成β-胡萝卜素对雌蟹育肥期间的WGR、GSI和HSI均无显著影响, 但饲料中添加β-胡萝卜素显著增加了中华绒螯蟹肝胰腺中总脂含量; (2) 就抗氧化和免疫指标而言, 肝胰腺和血淋巴中SOD、T-AOC、GSH-Px、AKP和ACP免疫相关酶活均随着饲料中β-胡萝卜素添加量的增加呈“先增加后降低”的变化趋势, 饲料中β-胡萝卜素含量为100~200 mg/kg时, 组织中抗氧化和免疫相关酶活最高; (3) 卵巢、肝胰腺和蟹壳中虾青素和β-胡萝卜素含量均随着饲料中β-胡萝卜素添加量的增加而显著增加, 但饲料中添加β-胡萝卜素仅显著增加了卵巢和肝胰腺红度值(*)。综上, 饲料中添加人工合成β-胡萝卜素对中华绒螯蟹雌体育肥期间的增重率和性腺发育无明显影响, 但添加适量β-胡萝卜素可以提高中华绒螯蟹抗氧化免疫性能、组织色泽及其类胡萝卜素含量, 综合考虑各项指标及饲料成本, 建议中华绒螯蟹雌体育肥饲料中人工合成β-胡萝卜素的适宜含量为100 mg/kg左右。研究结果不仅有助于了解β-胡萝卜素对甲壳动物生理功能的影响, 而且有助于中华绒螯蟹功能性饲料的开发。
中华绒螯蟹; 育肥饲料; 类胡萝卜素; 养殖性能; 色泽参数
中华绒螯蟹(, 以下简称河蟹)是我国重要的经济水产养殖品种, 因富含矿物质元素、脂肪酸、氨基酸、核苷酸和胆固醇等多类营养物质而受到广大消费者的青睐, 具有较高的经济价值和食用价值(Shao, 2013)。自20世纪90年代末河蟹土池生态育苗技术得到突破, 河蟹产业规模迅速扩大, 经二十多年发展已成为我国水产养殖行业发展最迅速、最具特色的水产品产业之一。尽管我国河蟹养殖产量巨大, 但池塘养殖河蟹普遍存在煮熟后壳色、卵巢和肝胰腺颜色较淡等问题, 而野生和湖泊增殖河蟹通常壳色和卵巢颜色较红(Kong, 2012)。色泽是影响消费者对甲壳动物感官评价的重要因素之一, 色泽较淡直接影响到商品河蟹的市场价值(王世会等, 2021)。研究表明甲壳动物的体色与其体内的类胡萝卜素(尤其是虾青素)组成和含量密切相关, 因此在饲料中添加类胡萝卜素是改善池塘养殖河蟹色泽的有效方法(Jiang, 2019)。此外, 河蟹在室外池塘养殖过程中易受到氨氮、亚硝酸盐、pH值和缺氧等环境胁迫因子的影响, 并且夏季水温较高时危害尤为严重(Qiu, 2011)。这些不利的环境胁迫因子可能会对河蟹的免疫系统、生理过程、存活及生长产生负面影响(张世勇等, 2013)。研究表明, 在饲料中添加类胡萝卜素来增强河蟹抗氧化性能及抗逆性能, 是减轻河蟹受环境胁迫影响的重要手段(Wei, 2016)。
β-胡萝卜素是具有重要生理功能的天然色素, 同时也是合成维生素A的前体, 在食品和饲料添加剂等方面得到广泛应用(Gul, 2015)。除了典型的着色作用外, 研究表明β-胡萝卜素对甲壳类动物的抗氧化性能、免疫性能、抗逆性能及抗病力均具有一定的提升效果, 突出了β-胡萝卜素对于甲壳动物健康养殖的重要性(Madhumathi, 2011; Medina Félix, 2017)。众所周知, 甲壳动物无法从头合成β-胡萝卜素等类胡萝卜素, 仅可以通过储存或转化饵料中外源类胡萝卜素后将其沉积于体内, 因此甲壳动物体内类胡萝卜素沉积很大程度上依赖于饲料中补充的类胡萝卜素(Boonyaratpalin, 2001)。此外, 据报道甲壳动物可以将摄入的β-胡萝卜素转化为抗氧化活性更强且价值更高的虾青素(Martín, 2008)。这便增加了一种可能性, 即如果β-胡萝卜素在甲壳动物体内转化为虾青素的效率足够高, 那在饲料中添加β-胡萝卜素将可以提供一种可替代且成本更低的方法来实现甲壳动物的所需特性。
目前, 类胡萝卜素在河蟹饲料中的研究进展主要集中于饲料中添加虾青素对河蟹色泽、抗氧化性能及抗逆性能影响的研究, 但针对饲料中添加β-胡萝卜素对河蟹影响的研究报道很少(Long, 2017; Jiang, 2020)。先前在哺乳动物上的研究表明, 当饲料中β-胡萝卜素含量达到特定物种生长和生理状态所需的最佳水平后, 过量添加β-胡萝卜素将对动物产生促氧化作用(Siems, 2005)。本实验主要探究饲料中添加不同水平β-胡萝卜素对河蟹性腺发育、抗氧化性能、非特异性免疫和色泽的影响, 并根据这些结果探索河蟹饲料中β-胡萝卜素的最佳添加量。该研究结果不仅有助于了解β-胡萝卜素对甲壳类生理功能的影响, 而且有助于河蟹功能性饲料的开发。
1 材料与方法
1.1 饲料配方及制备
通过在饲料原料中添加不同水平人工合成β-胡萝卜素(11.75%, 广州立达尔生物科技股份有限公司)配制5组实验饲料, 使得饲料中β-胡萝卜素含量分别为50、100、200和300 mg/kg (记为Diet 2, Diet 3, Diet 4和Diet 5), 并以不添加β-胡萝卜素的饲料组作为对照组(记为Diet 1)。所有饲料原料粉碎之后过80目筛, 按照饲料配方充分混匀, 加入25%蒸馏水混合后, 用制粒机制备粒径3.0 mm、长度10 mm左右的饲料, 然后在室温下风干。为了防止饲料中β-胡萝卜素氧化, 所有风干后的实验饲料均用黑色塑料袋于–20 °C冰箱中保存备用。表1为实验饲料配方、饲料常规生化组成及主要类胡萝卜素的实际含量。
表1 实验饲料配方、生化组成及类胡萝卜素含量

Tab.1 The formulation, proximate composition, and actual carotenoid concentration of experimental diets

续表
1.2 实验设计与养殖管理
2019年8月下旬在上海海洋大学崇明基地的15个PE桶(直径×高度= 108 cm×120 cm)中进行成蟹养殖实验。从该基地的土池中随机选择300只成熟河蟹雌体(体重70~90 g)并暂养至PE桶中。室内暂养3~5 d后, 进一步选择四肢健全和活力较好的个体用于接下来的养殖实验。每组饲料组设定三个重复圆桶, 每个圆桶放16只成熟个体。为避免河蟹相互打斗影响成活率, 圆桶底部放置塑料假草。实验用水为消毒沉淀后的河道水, 养殖实验过程中圆桶水位保持在50 cm左右, 圆桶中水体的循环速度为3 L/min。所有圆桶均每天24 h连续曝气, 以保持养殖水体溶解氧(DO)大于5 mg/mL。实验期间光照周期为12 h︰12 h。河蟹养殖期间按体重的3%投喂实验饲料, 每天虹吸清除粪便和残饵。实验过程中每天测定水质, 并将水质维持在最佳范围内(pH 7~8.5, 氨氮<0.4 mg/L, 亚硝酸盐<0.05 mg/L)。
1.3 生长数据收集及样本采集
分别于养殖实验35 d及70 d后从每个圆桶中随机选择3只河蟹并对其称重。从每只河蟹第三条附肢的根部抽取2 mL左右血淋巴放至2 mL离心管中, 随后–80 °C冷冻保存。解剖河蟹获得卵巢、肝胰腺和肌肉并称重, 随后将每只河蟹头胸甲、卵巢、肝胰脏和肌肉分别于–40 °C保存, 用于后续生化分析。使用以下公式计算河蟹增重率(WGR)、性腺指数(GSI)和肝胰腺指数(HSI):
WGR(%)=(最终体重–初始体重)/初始体重×100, (1)
GSI(%)=性腺重/体重×100, (2)
HSI(%)=肝胰腺重/体重×100. (3)
1.4 抗氧化及非特异性相关酶活测定
使用IKA微型匀浆器(德国IKA公司)将解冻后的血淋巴样品匀浆, 随后将匀浆液在10 000 r/min和4 °C条件下离心20 min, 收集离心后上清液并保存于–40 °C冰箱以备后续使用。称重来自每只河蟹的约0.1 g肝胰腺样品, 并按1︰5 (/)的比例添加到预冷的生理盐水中, 然后在2 mL离心管中使用IKA匀浆器进行匀浆。然后将匀浆液在4 °C和10 000 r/min条件下离心10 min, 取上清液于–40 °C保存供以后分析。使用分光光度计和相应的实验试剂盒(南京建成生物工程研究所)测定河蟹肝胰脏和血淋巴中的超氧化物歧化酶(SOD)、总抗氧化剂能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、谷氨酸草酰乙酸转氨酶(GOT)和谷氨酸丙酮酸转氨酶(GPT)水平。
1.5 常规生化、色泽及类胡萝卜素组成测定
根据AOAC的方法对实验饲料的水分、粗蛋白和灰分含量进行测定(AOAC, 2000)。根据Folch等(1957)的方法用氯仿-甲醇(2︰1,/)提取总脂。在提取组织中总类胡萝卜素之前, 将每只蟹的头胸甲、卵巢和肝胰脏分别冷冻干燥并研磨, 随后将每个平行中的同一组织合并混合, 作为一个重复。用丙酮提取所有样品中的总类胡萝卜素, 并使用紫外可见分光光度计(型号: T6新世纪, 北京普析通用仪器有限责任公司)在470 nm波长下测定其含量(Johnston, 2000)。首先通过酶水解将酯化的类胡萝卜素水解(Wade, 2005), 然后使用Agilent 1260高效液相色谱(HPLC)系统(Agilent Technologies Inc., 美国加利福尼亚州), 按照Peng等(2008) 的方法分析组织中虾青素和β-胡萝卜素含量。Agilent 1260 HPLC系统配备了YMC™类胡萝卜素C30色谱柱(4.6×150 mm, 填料直径=3 μm, YMC Co., Ltd., 日本京都), 流动相则由A和B组成, 其中流动相A由甲醇︰甲基叔丁基醚︰甲酸(3︰2︰0.01,//)组成, 流动相B为醇︰三乙胺(100︰0.04,/)的混合物。根据虾青素和β-胡萝卜素市售标准品鉴定并定量这两种类胡萝卜素。虾青素(编号A9335)购自Sigma-Aldrich (美国), β-胡萝卜素(编号CA10947000)标准品购自Dr. Ehrenstorfer GmbH (德国奥格斯堡)。
使用色差仪(CR400, 日本柯尼卡美能达公司)测定冷冻干燥后头胸甲、卵巢和肝胰腺的色度值, 色泽参数包括*、*和*值, 分别代表亮度、红色和黄度(León, 2006)。每个实验组测定9只成蟹(3只成蟹/重复)颜色参数, 每个头胸甲、卵巢和肝胰腺样品选择三个相对光滑的点进行*、*和*值测定, 结果以每组样品平均值表示。
1.6 RNA提取和qRT-PCR
参照试剂盒操作步骤, 使用RNAiso Plus (TaKaRa)从每个肝胰腺中提取总RNA。分别使用琼脂糖凝胶电泳和紫外分光光度计(Q5000, Quawell Technology Inc, 美国)对总RNA进行定量测定。仅使用高质量的总RNA样品(OD260/280范围为1.8~2.2, RIN≥8.0)进行cDNA反转录。根据试剂盒操作说明, 使用PrimeScriptTMRT-PCR试剂盒(TaKaRa)将总RNA (2 µg)逆转录为总体积40 µL。使用SYBR RT-PCR试剂盒(RR420A, TaKaRa)在ABI实时PCR系统(ABI-7500; ThermoFisher, 新加坡)上进行所有实时反应。总反应体积为10 µL, 其中包含5 µL 2x SYBR Master Mix、1 µL稀释的cDNA、0.2 µL正向和反向引物和ROX Reference DyeII, 以及3.4 µL Rnase-free-ddH2O。扩增条件为: 95 °C持续30 s、95 °C进行5 s的40个循环, 60 °C进行34 s, 95 °C进行15 s, 60 °C进行60 s, 95 °C进行15 s。针对β-肌动蛋白内部参考基因的表达进行标准化, 并根据2–ΔΔCt方法分析数据。表2中描述了CAT (过氧化氢酶)、Trx (硫氧还蛋白)、Prx6 (过氧还蛋白)、GST (谷胱甘肽转移酶)和β-Actin的引物序列。
表2 荧光定量PCR分析的引物及相关信息

Tab.2 Primers and relative information used for quantitative real-time PCR analysis
1.7 统计分析
使用SPSS 19.0软件进行统计分析。数据表示为平均值±标准误(SE), 用 Levene 法进行方差齐性检验, 当数据不满足齐性方差时对百分比数据进行反正弦或者平方根处理, 采用单因子ANOVA对实验结果进行方差分析, 采用Tukeys-b(K)法进行多重比较; 当数据转换后仍不满足齐性方差时, 采用Games- Howell非参数检验进行多重比较。取<0.05为差异显著, 在GraphPad Prism 9软件上绘制相关图表。
2 结果
2.1 性腺发育及生化组成
饲料中添加β-胡萝卜素对成体雌蟹育肥期间增重率(WGR)、性腺指数(GSI)、肝胰腺指数(HSI)和最终成活率的影响如表3所示。经35 d育肥之后, 各组雌蟹WGR、GSI和HSI差异较小(>0.05), 分别为5.5%、7%和8%左右。经70 d育肥之后, 各组雌蟹WGR和GSI在育肥35 d的基础之上分别提高0.5%和2%左右, 而HSI则降低2.5%左右。就成活率而言, 各组成活率均在75%~85%范围内, 其中Diet 1组成活率最低, 为77.08%, Diet 4组成活率最高, 为83.33%。
表3 育肥饲料中添加β-胡萝卜素对成体雌蟹性腺发育的影响
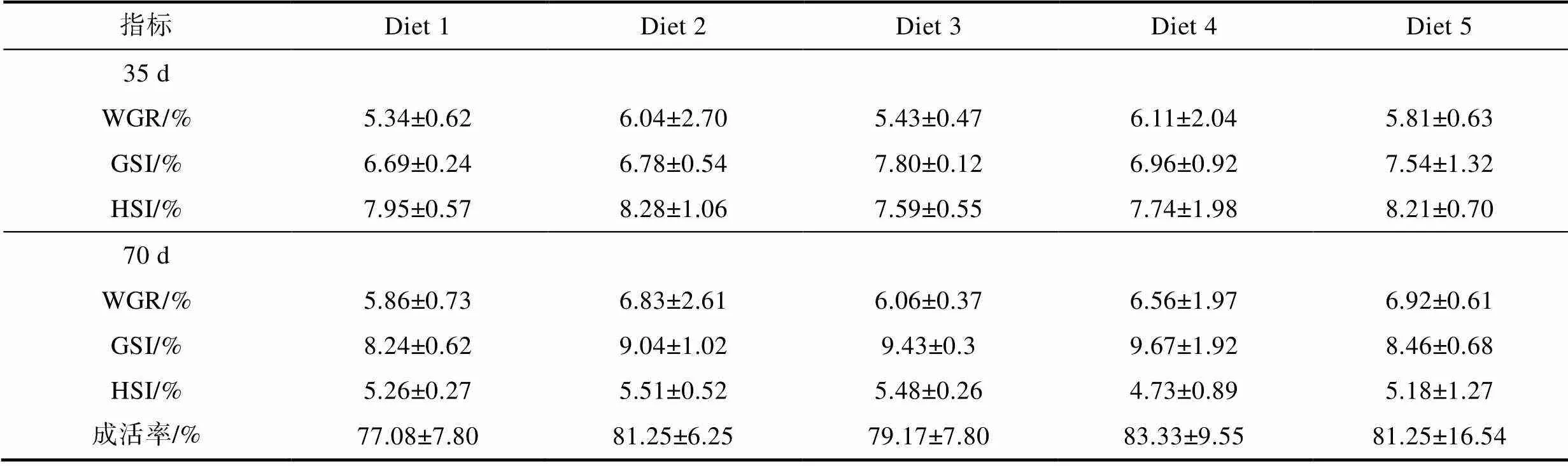
Tab.3 Effects of dietary β-carotene on the gonad development of adult female E. sinensis
育肥饲料中添加β-胡萝卜素对成体雌蟹卵巢、肝胰腺及肌肉生化组成的影响如表4所示。结果表明, 饲料中添加不同水平β-胡萝卜素对成体雌蟹卵巢和肌肉中的常规生化影响较小。肝胰腺中对照组水分含量显著高于β-胡萝卜素添加组, 而粗脂肪含量显著低于各β-胡萝卜素添加组(<0.05), 说明饲料中添加β-胡萝卜素可以显著增加成体雌蟹肝胰腺中粗脂肪含量。
表4 育肥饲料中添加β-胡萝卜素对雌蟹卵巢、肝胰腺及肌肉生化组成的影响(%湿重)

Tab.4 Effects of dietary β-carotene on the proximate composition in ovary, hepatopancreas, and muscle of adult female E. sinensis (% wet weight)
注: 上标不同小写字母表示差异显著(<0.05)。下同
2.2 免疫及抗氧化性能
育肥饲料中添加β-胡萝卜素对成体雌蟹抗氧化相关酶活的影响如表5所示。肝胰腺和血淋巴中SOD、T-AOC和GSH-Px活性均随着饲料中β-胡萝卜素添加量的增加呈“先增加后降低”的变化趋势, 且β-胡萝卜素添加量为100~200 mg/kg时这些抗氧化相关酶活的数值显著较高。与之相反, 肝胰腺和血淋巴中MDA含量均随着饲料中β-胡萝卜素添加量的增加而呈“先降低后增加”的变化趋势, 且当β-胡萝卜素添加量为100 mg/kg时含量最低。
饲料中添加β-胡萝卜素对成蟹雌体免疫相关酶活的影响如表6所示。肝胰腺和血淋巴中AKP及ACP活性均随着饲料中β-胡萝卜素添加量的增加而呈“先增加后降低”的变化趋势, 且当β-胡萝卜素添加量为100~200 mg/kg时这些免疫相关酶活最高。与之相反, 肝胰腺和血淋巴中GPT及GOT活性均随着饲料中β-胡萝卜素添加量的增加而呈“先降低后增加”的变化趋势, 且当β-胡萝卜素添加量为100 mg/kg时酶活最低。
表5 育肥饲料中添加β-胡萝卜素对抗氧化相关酶活的影响

Tab.5 Effects of dietary β-carotene meal on the antioxidant indices of adult female E. sinensis
表6 育肥饲料中添加β-胡萝卜素对血淋巴中免疫相关酶活的影响

Tab.6 Effects of dietary β-carotene on the immune indices of adult female E. sinensis
饲料中添加β-胡萝卜素对成体雌蟹肝胰腺中抗氧化相关基因表达量的影响如图1所示。CAT、Trx、Prx6及GST等基因的表达量均随着饲料中β-胡萝卜素添加量的增加而呈“先增加后降低”的变化趋势。其中, 当饲料中β-胡萝卜素添加量为100 mg/kg时,CAT、Trx、Prx6和GST表达量均为最高。基于双折线回归分析的结果表明, 当饲料中β-胡萝卜素添加量为113.64、114.20、98.17及98.97 mg/kg时, 肝胰腺中CAT、Trx、Prx6及GST等基因的表达量分别最高。
2.3 色泽及类胡萝卜素组成
饲料中添加β-胡萝卜素对各组织色泽的影响如图2所示。蟹壳色度值中*、*和*均随着饲料中β-胡萝卜素添加量的增加而呈升高趋势, 但不同β-胡萝卜素添加水平之间无显著差异; 肝胰腺色度值中*值随着饲料中β-胡萝卜素添加量的增加而显著升高, 肝胰腺*值在前四个饲料组中显著升高, 但在第五组中趋于稳定(<0.05); 卵巢*和*值均随着饲料中β-胡萝卜素添加量的增加而显著升高, 但饲料中不同水平β-胡萝卜素添加量对卵巢*值影响较小。
饲料中添加β-胡萝卜素对各组织中类胡萝卜素组成的影响如图3所示。随着饲料中β-胡萝卜素添加量从0 mg/kg增加至100 mg/kg, 蟹壳中虾青素及β-胡萝卜素含量显著增加(<0.05), 但随着饲料中β-胡萝卜素添加量从100 mg/kg进一步增加至300 mg/kg, 蟹壳中虾青素、β-胡萝卜素及总类胡萝卜素含量均趋于稳定, 分别稳定于16.7、1.7及29 mg/kg左右。肝胰腺中虾青素、β-胡萝卜素及总类胡萝卜素含量随着饲料中β-胡萝卜素添加量从0 mg/kg增加至200 mg/kg而显著增加(<0.05), 但随着饲料中β-胡萝卜素添加量从200 mg/kg进一步增加至300 mg/kg而趋于稳定, 分别稳定于2、116及135 mg/kg左右。卵巢中虾青素、β-胡萝卜素及总类胡萝卜素含量一直随着饲料中β-胡萝卜素添加量的增加而显著增加(<0.05)。
注: a.CAT; b.Trx; c.Prx6; d.GST

图2 育肥饲料中添加β-胡萝卜素对雌蟹蟹壳、肝胰腺和卵巢色泽的影响
注: a. 头胸甲; b. 肝胰腺; c. 卵巢。柱上不同小写字母表示差异显著(<0.05)。下同
3 讨论
3.1 性腺发育及常规生化
饲料添加类胡萝卜素对甲壳动物生长性能的影响取决于不同养殖条件、生长阶段、特定物种对胡萝卜素的需求以及不同类胡萝卜素来源(Wade, 2017; Angell, 2018)。本实验中虽然β-胡萝卜素添加组河蟹的最终体重和WGR比对照组高15%左右, 但各饲料组之间生长性能并无显著差异, 表明饲料中添加β-胡萝卜素对河蟹生长性能影响较小, 该结果与之前在斑节对虾(, Boonyaratpalin, 2001)和红螯螯虾(, Harpaz, 1998)上的研究结果类似。然而另外一些研究表明, 饲料中添加β-胡萝卜素可以显著提高甲壳动物生长性能, 比如Supamattaya等(2005)和Niu等(2014)研究表明饲料中添加β-胡萝卜素显著增加了斑节对虾的平均体质量, Yamada等(1990)和Chien等(1992)研究也表明饲料中添加β-胡萝卜素可以有效提高日本对虾生长性能。这些β-胡萝卜素对生长性能促进效果上的差异可能与不同的养殖条件、研究对象的生长阶段、研究对象对β-胡萝卜素的需求量以及β-胡萝卜素的来源有关(张饮江等, 2001; Wade, 2017)。性腺和肝胰腺是成熟雌蟹重要的可食部分, 而其性腺指数(GSI)是河蟹卵巢发育的重要指标(Shao, 2014)。关于饲料中添加β-胡萝卜素对甲壳动物性腺发育的影响, 之前的研究表明饲料中添加β-胡萝卜素对河蟹卵巢发育的促进作用非常有限(袁春营等, 2007), 这与本研究的结果相一致。

图3 育肥饲料中添加β-胡萝卜素对雌蟹蟹壳、肝胰腺和卵巢类胡萝卜素含量的影响
注: a. 头胸甲; b. 肝胰腺; c. 卵巢
常规成分是评价河蟹可食组织营养价值的重要指标(Shao, 2013)。在本研究中, 对照组雌蟹肝胰腺中总脂含量显著低于各β-胡萝卜素添加组, 说明饲料中添加β-胡萝卜素有利于河蟹雌体肝胰腺中脂肪的沉积, 该结果与Niu等(2014)的研究一致, 即饲料中添加β-胡萝卜素显著增加了斑节对虾总脂含量。虽然饲料中添加β-胡萝卜素对甲壳动物常规生化影响的相关研究较少, 但部分学者在饲料中添加虾青素对甲壳动物营养组成影响方面开展了有益探索, 比如吴仁福等(2018)研究表明饲料中添加虾青素显著增加了三疣梭子蟹雌体卵巢和肝胰腺中总脂含量, 此外, Jiang等(2022)研究表明饲料中添加人工合成虾青素显著增加了河蟹雌体肝胰腺中的总脂含量。饲料中添加类胡萝卜素可以增加甲壳动物组织中总脂含量, 可能与类胡萝卜素具有较少机体氧化应激及能效消耗的特性有关。
3.2 免疫及抗氧化性能
维持生物体复杂的免疫系统需要多种类型的抗氧化酶, 它们构成了针对自由基的酶防御机制的第一道防线。总抗氧化能力(T-AOC)是衡量机体抗氧化系统功能状况的综合指标(崔惟东等, 2009), MDA是酶促和非酶促脂质过氧化反应最常见的终产物之一, MDA含量可以作为衡量机体脂质过氧化程度的重要指标(Devasena, 2001)。随着饲料中β-胡萝卜素添加量从0 mg/kg增加至300 mg/kg, 河蟹肝胰腺和血淋巴中T-AOC含量呈“低-高-低”的变化趋势, 并且当饲料中β-胡萝卜素添加量为100 mg/kg时T-AOC水平最高。与之相反, 随着饲料中β-胡萝卜素添加量从0 mg/kg增加至100 mg/kg, 肝胰腺和血淋巴中MDA含量逐渐降低, 而饲料中高β-胡萝卜素添加量从100 mg/kg进一步增加至300 mg/kg, 肝胰腺和血淋巴中MDA水平异常升高。这些结果表明, 饲料中添加适量β-胡萝卜素(100 mg/kg左右)可以维持机体活性氧(ROS)产生和抗氧化活性之间的平衡, 但饲料中添加过量β-胡萝卜素对投喂对象的抗氧化性能产生负面影响, 并存在一定的毒性。Stahl等(2003)研究结果表明, 类胡萝卜素的抗氧化作用是基于它们可以猝灭单线态氧的特性, 类胡萝卜素对脂质过氧化的预防作用主要得益于该特性, 此外, 类胡萝卜素还拥有捕获过氧自由基的能力, 是过氧自由基的清除剂。类胡萝卜素与过氧自由基的相互作用可能通过不稳定的β-胡萝卜素自由基加合物进行, Diet 5中河蟹抗氧化性能的降低可以假设是在抗氧化作用过程中氧化攻击期间产生大量类胡萝卜素分解产物, 并且会通过损害线粒体功能来增加氧化应激(Siems, 2005), 但该假设有待进一步验证。
由于缺乏适应性免疫系统, 甲壳类动物依靠其体液免疫及细胞先天免疫反应来对抗入侵的微生物(Chen, 2019)。AKP和ACP是两种重要的磷酸酶, 它们在体液免疫中拥有多种功能, 其活性通常可以反映甲壳动物的免疫状态(Xue, 2000)。饲料中添加100~200 mg/kg β-胡萝卜素显著增加了河蟹肝胰腺和血淋巴中AKP及ACP活性, 说明饲料中添加适量β-胡萝卜素有效提高河蟹免疫性能。β-胡萝卜素对投喂对象免疫力的提升效果与之前在其他甲壳类动物上的报道类似, 比如, 在饲料中添加0.5%~2%富含β-胡萝卜素的杜氏盐藻可以显著提高斑节对虾()免疫性能(Madhumathi, 2011), 此外, 在饲料中添加1.5%~3%富含β-胡萝卜素的杜氏盐藻也显著增加了南美白对虾()免疫性能(Medina Félix, 2017)。
关于饲料中添加β-胡萝卜素对水生动物抗氧化相关基因表达量影响的研究很少, 本研究结果拟为β-胡萝卜素如何调节河蟹的抗氧化性能提供一个初步的认识。核因子红细胞系2相关因子2 (Nrf2)是一种转录因子, 通过同时控制内源性抗氧化酶系统中的关键成分来调节细胞氧化还原状态(Hayes, 2014)。先前的研究表明, Nrf2主要通过增加烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的水平来激活依赖于Trx和GSH的抗氧化系统来维持生物体的氧化还原稳态(Bellezza, 2018)。在依赖于Trx的抗氧化系统中, Prx和Trx是关键的抗氧化蛋白, 两者都具有氧化还原酶活性(Mu, 2009a, 2009b)。在依赖于GSH的抗氧化系统中, GST催化GSH与ROS损伤细胞结合, 从而促进其解毒(Mohankumar, 2006)。肝胰腺Prx、Trx和GST的表达水平均随着β-胡萝卜素添加量的增加呈现“低-高-低”的变化趋势, 且在Diet 3组中表达水平最高, 与肝胰腺中抗氧化相关酶活的变化趋势相一致, 这说明饲料中添加100 mg/kg β-胡萝卜素有利于维持河蟹的ROS稳态及抗氧化性能的提升。
3.3 色泽及类胡萝卜素组成
甲壳动物对类胡萝卜素具有一定的需求量, 它们可以储存大量类胡萝卜素并将这些类胡萝卜素转化为虾青素后沉积于肝胰腺、甲壳和卵巢等组织中(Babin, 2019)。成体雌蟹摄食含100~300 mg/kg β-胡萝卜素的饲料后, 实验蟹蟹壳、肝胰腺及卵巢中的虾青素均得到显著提升, 这验证了河蟹组织具有将β-胡萝卜素转化为虾青素的能力。随着饲料中β-胡萝卜素添加量从0 mg/kg增加至100 mg/kg左右, 蟹壳和肝胰腺中的虾青素和β-胡萝卜素含量均显著增加, 但随着饲料中β-胡萝卜素添加量进一步由100 mg/kg增加至200 mg/kg, 蟹壳和肝胰腺中的虾青素和β-胡萝卜素含量的变化趋于平缓, 甚至保持不变。该结果表明, 甲壳动物组织中类胡萝卜素沉积量一旦达到饱和, 饲料中类胡萝卜素添加量进一步增加将无法有效增加投喂对象组织中类胡萝卜素含量(Chien, 1992)。与实验蟹蟹壳和肝胰腺中类胡萝卜素含量“先增后缓”的变化趋势不同, 实验蟹卵巢中虾青素和β-胡萝卜素的含量一直随着饲料中β-胡萝卜素添加量的增加而显著增加。这种组织间的差异表明, 同一物种在相同条件下对饲料中β-胡萝卜素的沉积能力存在一定的组织特异性。
甲壳动物的色泽与其类胡萝卜素组成密切相关, 饲料中添加β-胡萝卜素往往可以有效改善甲壳类动物色泽, 进而提高其质量和价格。Boonyaratpalin等(2001)研究表明, 相较于添加50 mg/kg虾青素的实验饲料相比, 饲料中添加175 mg/kg β-胡萝卜素可以更加有效地改善斑节对虾的色泽。此外, 另一个研究同样表明在饲料中添加200~300 mg/kg β-胡萝卜素可以显著改善斑节对虾的甲壳色泽(Supamattaya, 2005)。前期的这些研究结果与本实验结果类似, 即饲料中添加200~300 mg/kg人工合成β-胡萝卜素显著增加了成体雌蟹肝胰腺和卵巢红度值。此外, 各组织红度值和虾青素含量均随着饲料中β-胡萝卜素添量的增加而同步增加, 这表明实验蟹各组织所表现出的红度值增加一方面是由于由β-胡萝卜素转化而来的虾青素含量的增加, 另一方面是β-胡萝卜素直接诱导的着色作用。
4 结论
综上所述, 饲料中添加50~300 mg/kg人工合成β-胡萝卜素对成体雌蟹的生长性能和性腺发育均无显著影响, 但饲料中添加β-胡萝卜素可以显著提高河蟹肝胰腺中总脂含量。就免疫及抗氧化相关指标而言, 饲料中添加适量β-胡萝卜素(50~100 mg/kg)可以显著提高成体雌蟹的免疫及抗氧化性能, 但添加过量β-胡萝卜素(200~300 mg/kg)将影响河蟹免疫及抗氧化性能。此外, 饲料中添加适量β-胡萝卜素显著提高了河蟹蟹壳、肝胰脏和卵巢中虾青素和β-胡萝卜素含量, 但饲料中添加β-胡萝卜素仅显著增加了河蟹肝胰腺和卵巢红度值。综合考虑成本、着色效果、抗氧化性能和免疫力等因素, 建议成体雌蟹育肥饲料中人工合成β-胡萝卜素的添加量为100 mg/kg左右。
王世会, 成永旭, 贾智英, 等, 2021. 两种肝胰腺色泽中华绒螯蟹营养品质比较[J]. 水产学杂志, 34(4): 27-34.
吴仁福, 龙晓文, 侯文杰, 等, 2018. 饲料中添加雨生红球藻粉对三疣梭子蟹雌体卵巢发育、色泽、抗氧化能力和生化组成的影响[J]. 水生生物学报, 42(4): 698-708.
张世勇, 傅洪拓, 乔慧, 等, 2013. 中华绒螯蟹遗传育种研究进展[J]. 中国农学通报, 29(20): 39-45.
张饮江, 何培民, 何文辉, 2001. 螺旋藻对中华绒螯蟹生长和体色的影响[J]. 中国水产科学, 8(2): 59-62.
袁春营, 崔青曼, 2007. β-胡萝卜素对中华绒螯蟹卵巢发育及免疫学指标的影响[J]. 海洋科学, 31(6): 25-28.
崔惟东, 冷向军, 李小勤, 等, 2009. 虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响[J]. 水产学报, 33(6): 987-995.
ANGELL A, DE NYS R, MANGOTT A,, 2018. The effects of concentration and supplementation time of natural and synthetic sources of astaxanthin on the colouration of the prawn[J]. Algal Research, 35: 577-585.
AOAC, 2000. Official Methods of Analysis [M]. Gaithersburg: Association of Official Analytical Chemists.
BABIN A, MOREAU J, MORET Y, 2019. Storage of carotenoids in crustaceans as an adaptation to modulate immunopathology and optimize immunological and life‐history strategies [J]. BioEssays, 41(11): 1800254.
BELLEZZA I, GIAMBANCO I, MINELLI A,, 2018. Nrf2-Keap1 signaling in oxidative and reductive stress [J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1865(5): 721-733.
BOONYARATPALIN M, THONGROD S, SUPAMATTAYA K,, 2001. Effects of β-carotene source,, and astaxanthin on pigmentation, growth, survival and health of[J]. Aquaculture Research, 32(S1): 182-190.
CHEN F Y, WANG K J, 2019. Characterization of the innate immunity in the mud crab[J]. Fish & Shellfish Immunology, 93: 436-448.
CHIEN Y H, JENG S C, 1992. Pigmentation of kuruma prawn,Bate, by various pigment sources and levels and feeding regimes [J]. Aquaculture, 102(4): 333-346.
DEVASENA T, LALITHA S, PADMA K, 2001. Lipid peroxidation, osmotic fragility and antioxidant status in children with acute post-streptococcal glomerulonephritis [J]. Clinica Chimica Acta, 308(1/2): 155-161.
FOLCH J, LEES M, SLOANE STANLEY G H, 1957. A simple method for the isolation and purification of total lipides from animal tissues [J]. Journal of Biological Chemistry, 226(1): 497-509.
GUL K, TAK A, SINGH AK,, 2015. Chemistry, encapsulation, and health benefits of β-carotene-A review [J]. Cogent Food & Agriculture, 1(1): 1018696.
HARPAZ S, RISE M, ARAD S M,, 1998. The effect of three carotenoid sources on growth and pigmentation of juvenile freshwater crayfish[J]. Aquaculture Nutrition, 4(3): 201-208.
HAYES J D, DINKOVA-KOSTOVA A T, 2014. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism [J]. Trends in Biochemical Sciences, 39(4): 199-218.
JIANG M, ZHAO H H, ZAI S W,, 2019. A defatted microalgae meal () as a partial protein source to replace fishmeal for feeding juvenile yellow perch[J]. Journal of Applied Phycology, 31(2): 1197-1205.
JIANG X D, PAN K W, YANG Y H,, 2022. Dietary DHA oil supplementation promotes ovarian development and astaxanthin deposition during the ovarian maturation of Chinese mitten crab[J]. Aquaculture Nutrition, 2022: 9997317.
JIANG X D, ZU L, WANG Z Y,, 2020. Micro-algal astaxanthin could improve the antioxidant capability, immunity and ammonia resistance of juvenile Chinese mitten crab,[J]. Fish & Shellfish Immunology, 102: 499-510.
JOHNSTON I A, ALDERSON R, SANDHAM C,, 2000. Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon (L.) [J]. Aquaculture, 189(3/4): 335-349.
KONG L, CAI C F, YE Y T,, 2012. Comparison of non-volatile compounds and sensory characteristics of Chinese mitten crabs () reared in lakes and ponds: Potential environmental factors [J]. Aquaculture, 364-365: 96-102.
LEÓN K, MERY D, PEDRESCHI F,, 2006. Color measurement inunits from RGB digital images [J]. Food Research International, 39(10): 1084-1091.
LIU L, LONG X W, DENG D,, 2018. Molecular characterization and tissue distribution of carnitine palmitoyltransferases in Chinese mitten craband the effect of dietary fish oil replacement on their expression in the hepatopancreas [J]. PLoS One, 13(8): e0201324.
LONG X W, WU X G, ZHAO L,, 2017. Effects of dietary supplementation withcell powder on coloration, ovarian development and antioxidation capacity of adult female Chinese mitten crab,[J]. Aquaculture, 473: 545-553.
MADHUMATHI M, RENGASAMY R, 2011. Antioxidant status offed withsupplemented diet and resistance against WSSV [J]. International Journal of Engineering, Science and Technology, 3(10): 7249-7259.
MARTÍN J F, GUDIÑA E, BARREDO J L, 2008. Conversion of β-carotene into astaxanthin: Two separate enzymes or a bifunctional hydroxylase-ketolase protein? [J]. Microbial Cell Factories, 7(3): 3.
MEDINA FÉLIX D, ELÍAS J A L, CÓRDOVA Á I C,, 2017. Survival ofshrimp fed on diets supplemented withsp. is improved after challenges by[J]. Journal of Invertebrate Pathology, 148: 118-123.
MOHANKUMAR K, RAMASAMY P, 2006. White spot syndrome virus infection decreases the activity of antioxidant enzymes in[J]. Virus Research, 115(1): 69-75.
MU C K, ZHAO J M, WANG L L,, 2009a. A thioredoxin with antioxidant activity identified from[J]. Fish & Shellfish Immunology, 26(5): 716-723.
MU C K, ZHAO J M, WANG L L,, 2009b. Molecular cloning and characterization of peroxiredoxin 6 from Chinese mitten crab[J]. Fish & Shellfish Immunology, 26(6): 821-827.
NIU J, WEN H, LI C H,, 2014. Comparison effect of dietary astaxanthin and β-carotene in the presence and absence of cholesterol supplementation on growth performance, antioxidant capacity and gene expression ofunder normoxia and hypoxia condition [J]. Aquaculture, 422-423: 8-17.
PENG J, XIANG W Z, TANG Q M,, 2008. Comparative analysis of astaxanthin and its esters in the mutant E1 ofand other green algae by HPLC with a C30 column [J]. Science in China Series C: Life Sciences, 51(12): 1108-1115.
QIU R J, CHENG Y X, HUANG X X,, 2011. Effect of hypoxia on immunological, physiological response, and hepatopancreatic metabolism of juvenile Chinese mitten crab[J]. Aquaculture International, 19(2): 283-299.
SHAO L C, WANG C, HE J,, 2013. Hepatopancreas and gonad quality of Chinese mitten crabs fattened with natural and formulated diets [J]. Journal of Food Quality, 36(3): 217-227.
SHAO L C, WANG C, HE J,, 2014. Meat quality of Chinese mitten crabs fattened with natural and formulated diets [J]. Journal of Aquatic Food Product Technology, 23(1): 59-72.
SIEMS W, WISWEDEL I, SALERNO C,, 2005. β-Carotene breakdown products may impair mitochondrial functions— potential side effects of high-dose β-carotene supplementation [J]. The Journal of Nutritional Biochemistry, 16(7): 385-397.
STAHL W, SIES H, 2003. Antioxidant activity of carotenoids [J]. Molecular Aspects of Medicine, 24(6): 345-351.
SUPAMATTAYA K, KIRIRATNIKOM S, BOONYARATPALIN M,, 2005. Effect of aextract on growth performance, health condition, immune response and disease resistance in black tiger shrimp () [J]. Aquaculture, 248(1/2/3/4): 207-216.
WADE N M, GABAUDAN J, GLENCROSS B D, 2017. A review of carotenoid utilisation and function in crustacean aquaculture [J]. Reviews in Aquaculture, 9(2): 141-156.
WADE N, GOULTER K C, WILSON K J,, 2005. Esterified astaxanthin levels in lobster epithelia correlate with shell colour intensity: Potential role in crustacean shell colour formation [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 141(3): 307-313.
WANG M, WANG L, ZHOU Z,, 2013. The molecular characterization of a catalase from Chinese mitten crab[J]. International Journal of Immunogenetics, 40(3): 230-240.
WEI J J, ZHANG F, TIAN W J,, 2016. Effects of dietary folic acid on growth, antioxidant capacity, non-specific immune response and disease resistance of juvenile Chinese mitten crab(Milne‐Edwards, 1853) [J]. Aquaculture Nutrition, 22(3): 567-574.
XUE Q G, RENAULT T, 2000. Enzymatic activities in European flat oyster,, and Pacific oyster,, hemolymph [J]. Journal of Invertebrate Pathology, 76(3): 155-163.
YAMADA S, TANAKA Y, SAMESHIMA M,, 1990. Pigmentation of prawn () with carotenoids: I. Effect of dietary astaxanthin,-carotene and canthaxanthin on pigmentation [J]. Aquaculture, 87(3/4): 323-330.
ZHAO D X, CHEN L Q, QIN C J,, 2010. A delta-class glutathione transferase from the Chinese mitten crab: cDNA cloning, characterization and mRNA expression [J]. Fish & Shellfish Immunology, 29(4): 698-703.
EFFECT OF DIETARY β-CAROTENE ON OVARY DEVELOPMENT, ANTIOXIDANT CAPABILITY, IMMUNITY, AND TISSUE COLOR OF ADULT FEMALE CHINESE MITTEN CRAB,
JIANG Xiao-Dong1, 2, 3, ZHU Ling-Xiang1, 2, 3, CHENG Yong-Xu1, 2, 3, WU Xu-Gan1, 2, 3
(1. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China; 3. Fish Nutrition and Environmental Ecology Research Center, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China)
To investigate the effects of dietary supplementation of synthetic β-carotene on weight gain rate (WGR), gonadosomatic index (GSI), hepatosomatic index (HSI), proximate composition, antioxidant status, color parameters, and carotenoid content of adult female Chinese mitten crab, five diets containing 3.3, 56.7, 108.9, 207.9, and 320.0 mg/kg β-carotene (denoted as Diets 1~5, respectively) were formulated to feed.that have completed puberty molting.Results show that: (1) Although the WGR, specific growth rate (SGR) and HSI of adult female.was not affected by dietary β-carotene supplementation, significant promotion of lipid content was observed in the hepatopancreas of β-carotene supplemented treatments. (2) Indicators of antioxidant capacity (T-AOC, MDA, GSH-Px) and immunity (AKP, ACP) in the hepatopancreas and hemolymph showed an apparent trend of “low-high-low” with the increase of dietary β-carotene supplementation, and the highest levels were observed in the 100 to 300 mg/kg treatments. (3) Dietary β-carotene significantly improved the redness (*) of carapace and hepatopancreas, which agreed with the significantly increased astaxanthin and total carotenoid concentrations in these tissues from different treatments. Therefore, the supplement ofβ-carotene in diet had no effect on WGR and gonad development of adult female., but enhance the antioxidative capability, non-specific immunity, color and luster, and tissue carotenoid contents. Based on these results, the optimal β-carotene content in the diets was around 100 mg/kg for adult female.. The research findings not only contribute to understanding the impact of β-carotene on the physiological functions of crustaceans but also facilitate the development of functional feeds for..
; fattening feed; carotenoid; culture performance; color parameters
* 国家自然科学基金面上项目, 31873041号; 科技部蓝色粮仓项目, 2018YFD0900103号;上海市河蟹产业体系专项, 沪农科产字(2022)第4号。姜晓东, 博士后, E-mail: 310410555@qq.com
吴旭干, 博士生导师, 教授, E-mail: xgwu@shou.edu.cn
2023-04-06,
2023-07-02
S963.73
10.11693/hyhz20230400079
